A deficiência de ferro é a doença com deficiência mais comum em todo o mundo. Na Europa, a prevalência é de 5-10% e é uma das causas mais comuns de anemia com cerca de 50%. Um desequilíbrio entre a procura e a ingestão leva inicialmente a uma deficiência de ferro de armazenamento; se houver uma oferta insuficiente dos precursores eritropoiéticos, isto leva a uma eritropoiese com deficiência de ferro, enquanto que a hemoglobina ainda é normal. Só quando os valores caem abaixo dos valores normais de hemoglobina é que se fala de anemia por deficiência de ferro.
A deficiência de ferro é a doença com deficiência mais comum em todo o mundo. Na Europa, a prevalência é de 5-10% e é uma das causas mais comuns de anemia, com cerca de 50%. A deficiência de ferro está dividida em três fases. Um desequilíbrio entre a procura e o consumo leva inicialmente a uma deficiência de ferro de armazenagem (fase I), se houver um fornecimento insuficiente dos precursores eritropoiéticos, isto leva a uma eritropoiese com deficiência de ferro (fase II), com a hemoglobina ainda normal. Só quando a hemoglobina cai abaixo dos valores normais (homens adultos: 13 g/dl, mulheres: 12 g/dl) é que se fala de anemia por deficiência de ferro (fase III). Esta encenação está principalmente centrada na eritropoiese, mas cada uma das nossas células precisa de ferro. A eritropoiese é preferencialmente fornecida no caso de deficiência de ferro, mas isto também significa que o ferro já está em falta noutros sistemas antes da anemia estar presente. As perturbações relacionadas com a deficiência de ferro já podem ocorrer nas fases I e II.
Fisiologia e fisiopatologia do metabolismo do ferro
O corpo de um adulto saudável contém 3 -5 g de ferro, a maioria dos quais sob a forma de ferro de hemoglobina, uma proporção adicional como ferro de armazenamento (homens adultos 500 -1000 mg, mulheres na pré-menopausa 200 – 400 mg) e apenas uma proporção muito pequena sob a forma de ferro de plasma. O nosso organismo obtém a parte principal das suas necessidades diárias de ferro através da reciclagem a partir de armazéns internos de ferro, mas depende da absorção enteral para evitar um equilíbrio negativo. Numa dieta normal e equilibrada, a absorção média de 1-2 mg/dia (cerca de 5 -10% do ferro contido nos alimentos numa dieta mista normal) compensa a perda fisiológica. Nas mulheres durante o período menstrual, o balanço de ferro torna-se muitas vezes negativo com uma perda diária de ferro de até 3 mg. Para manter a homeostase do ferro, é necessária uma dose diária de 8 mg (homens) e 18 mg (mulheres em idade fértil) devido à absorção apenas parcial do ferro [1]. A maior parte do ferro dietético é excretado nas fezes.
Os nossos alimentos contêm ferro em diferentes formas. Enquanto o ferro de carne é constituído em grande parte por ferro de hemoglobina bivalente, está presente em vegetais e cereais em forma trivalente. A absorção ocorre predominantemente no duodeno. O ferro de hémen derivado de carne é absorvido através de um receptor (Heme carrier protein 1) na superfície dos enterócitos. Intracelularmente, o ferro é clivado por uma hemoxigenase e ligado à mobilferrina. A partir daqui, pode ser utilizado para processos celulares ou libertado para o sangue através da ferroportina 1 na membrana basal dos enterócitos. A absorção de ferro de hulha é menos susceptível à perturbação e mais eficaz do que a absorção de ferro de vegetais e produtos de cereais. O ferro trivalente deve primeiro ser convertido em ferro bivalente pelo DCYTB (citocromo duodenal B). A captação para os enterócitos é feita através de DMT-1 (transportador de metal divalente). 1), um transportador de ferro especial dependente de pH. Este processo pode ser dificultado por numerosas substâncias (incluindo antiácidos, cálcio, oxalatos, fosfatos). A partir dos enterócitos, o ferro bivalente também entra na corrente sanguínea através do ferroportina 1-. Antes de libertado no sangue portal, o ferro bivalente é oxidado em ferro trivalente por hephaestin ou coeruloplasmina e ligado à apo-transferrina formada no fígado (apo-transferrin+2Fe3+ -> transferrin). Em condições normais, 16 – 45% das moléculas de transferrina no plasma são saturadas com ferro. A captação para as células alvo ocorre através de receptores de transferrina (TfR), cujo número na superfície da célula é regulado pela exigência de ferro da respectiva célula.
O armazenamento de ferro é predominantemente através da ferritina, que se encontra em todas as células e fluidos do corpo. Representa uma reserva muito rapidamente disponível, e a sua concentração de soro correlaciona-se bem com as reservas de ferro disponíveis em indivíduos saudáveis. A regulação da absorção do ferro pelos alimentos é feita através de uma hormona peptídeo produzida no fígado, a hepcidina. Conduz à desregulação do DMT-1 e à degradação da ferroportina 1. A elevação da Hepcidina causa uma diminuição da absorção dos alimentos, bem como uma diminuição da libertação de enterócitos no sangue portal.
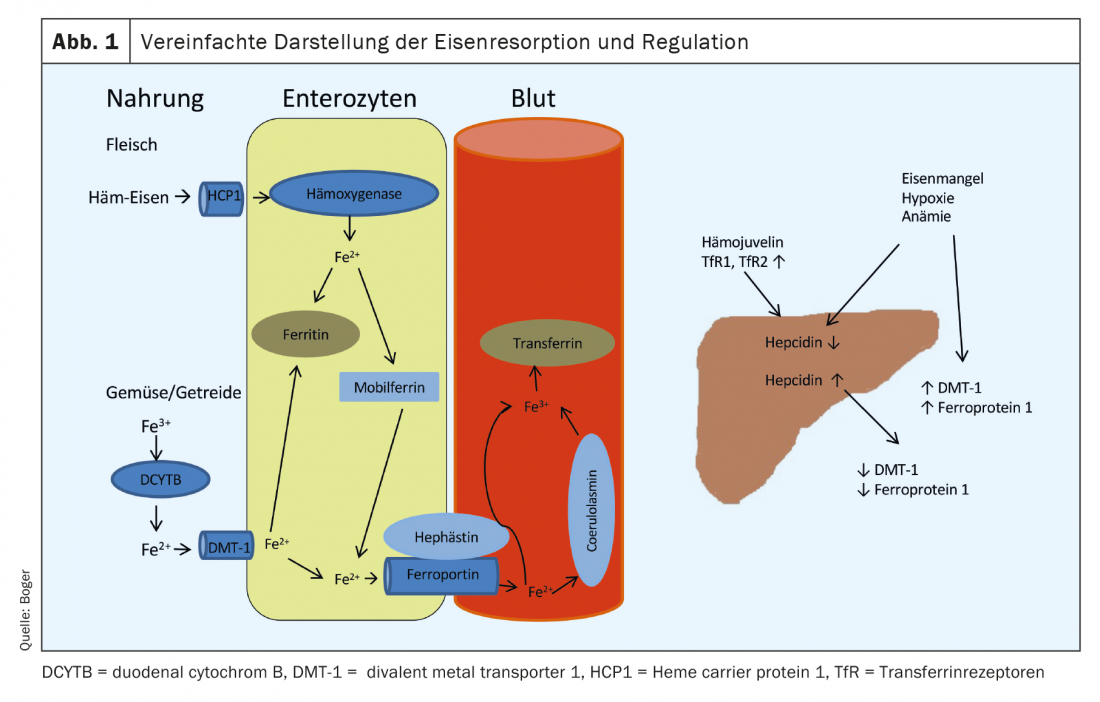
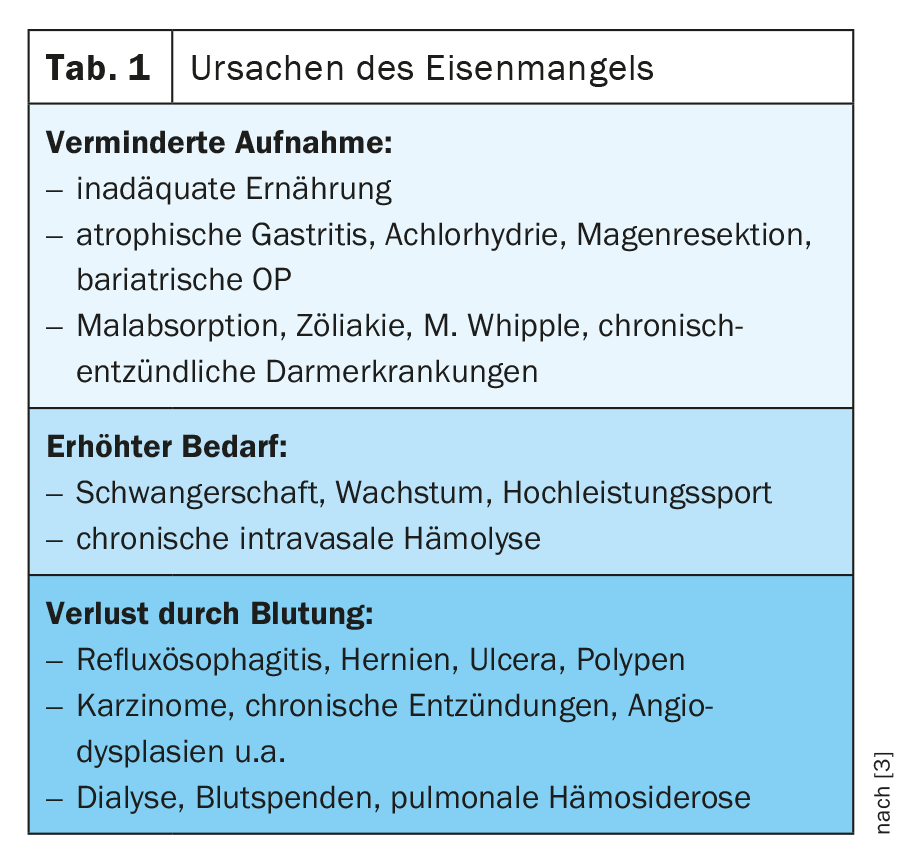
Se houver anemia, deficiência de ferro ou hipoxia, a produção de hepcidina no fígado é reduzida e a expressão de DMT-1, DCYTB, hefaestin, ferroportina 1 e HCP1 em enterócitos é aumentada [1] (Fig. 1). Uma visão geral das causas da deficiência de ferro é dada em Tabela 1.
Deficiência funcional de ferro
Para a desordem intrínseca de utilização do ferro, o termo deficiência funcional de ferro foi estabelecido nos últimos anos. O termo foi inicialmente desenvolvido para anemia renal, hoje o termo também inclui anemia em doenças crónicas (tumores, infecções, doenças auto-imunes). Entre outras coisas, a libertação de citocinas inflamatórias (por exemplo, interleucina-1α,interleucina-1β, interleucina-6, factor de necrose tumoral-α) leva à indução de hepcidina, o que resulta numa reabsorção reduzida e numa transferência interna prejudicada para a transferrina de proteínas de transporte e explica, assim, a reduzida saturação de transferrina (TSAT) como um achado indicativo de laboratório de diagnóstico.
Diagnóstico da deficiência de ferro
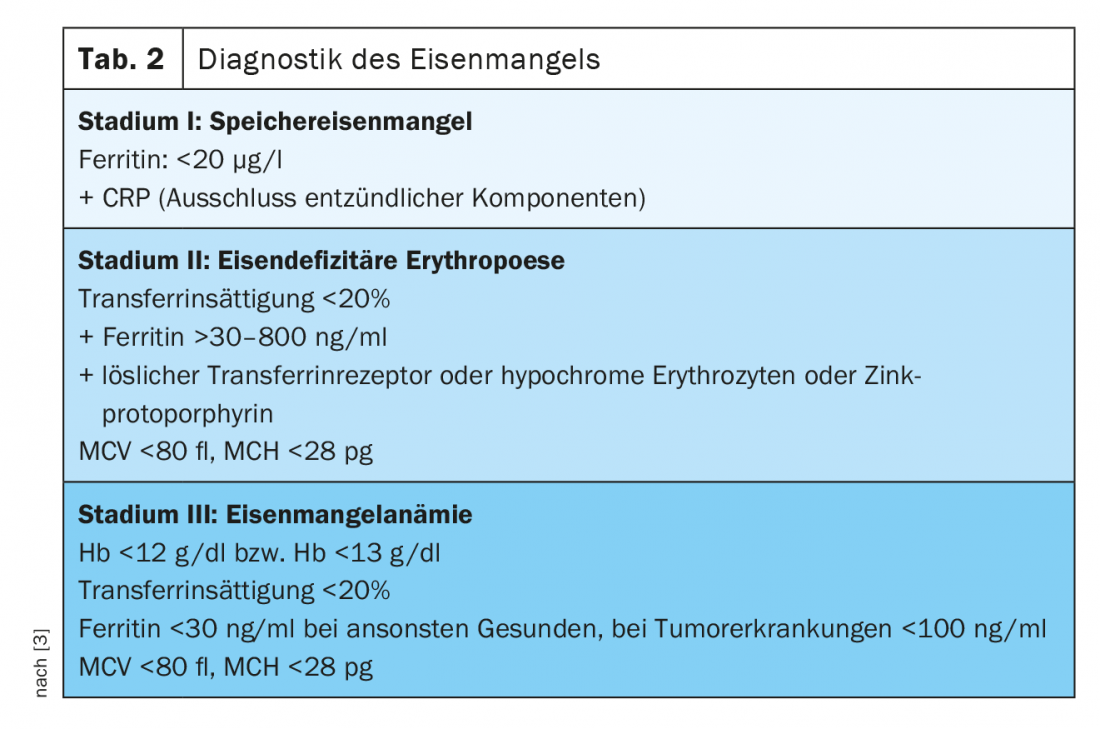
Etapa I (deficiência de ferro de armazenamento)
Ferritina em soro correlaciona-se com o estado das reservas de ferro em indivíduos saudáveis e já pode diagnosticar deficiência de ferro no -stage I. Enquanto falamos de uma deficiência de ferro em pessoas saudáveis de valores inferiores a 20 µg/l, sabemos que pacientes com neoplasias sólidas e deficiência comprovada de ferro podem ter valores de ferritina de 100 – 800 µg/l, num quarto de pacientes mesmo acima de 800 µg/l [2].
Mesmo que a coloração azul de Berlim do Esfregaço de medula óssea permite uma excelente avaliação do teor de ferro com base na proporção de sideroblastos (eritroblastos com evidência de grânulos de ferro intracelular), este método de diagnóstico invasivo não é o método de escolha para uma simples deficiência de ferro. No entanto, se uma punção for realizada em doentes oncológicos em particular devido a um problema diferente, esta coloração também pode ser realizada se a causa da anemia não for clara.
Etapa II (eritropoiese com deficiência de ferro)
O A saturação da transferrina (TSAT) como medida do ferro funcional disponível está sujeita a flutuação circadiana e pode ser reduzida em processos inflamatórios, apesar dos níveis normais de ferritina. É um parâmetro de deficiência funcional de ferro (TSAT [%]=serum ferro [µg/dl]/serum transferrin [mg/dl]×70.9). Em condições fisiológicas, até 45% das moléculas de transferrina são carregadas com ferro. Se a proporção for inferior a 20%, deve ser assumida uma situação de deficiência de ferro.
A concentração dereceptores de transferrina solúveis (sTfR) no soro depende da actividade da eritropoiese e do estado do ferro. Se houver uma deficiência de ferro de armazenamento puro, está no intervalo normal. Na eritropoiese com deficiência de ferro, os níveis de soro aumentam. Servem assim muito bem como parâmetros para diferenciar a eritropoiese com deficiência de ferro e a deficiência funcional de ferro. O chamado índice TfR-F pode ser calculado a partir dos valores do receptor de transferrina solúvel e da ferritina sérica, o que permite uma maior sensibilidade e especificidade em relação a uma afirmação sobre a eritropoiese com deficiência de ferro. Outros parâmetros para o diagnóstico de eritropoiese com deficiência de ferro é a proporção de reticulócitos hipocrómicos (HYPO). Com um fornecimento de ferro suficiente ou deficiência de ferro em fase I, a proporção de eritrócitos hipocrómicos é inferior a 2,5%. Se isto for superior a 10%, isto é prova de eritropoiese com deficiência de ferro. Também a determinação do O teor de hemoglobina dos reticulócitos (CHr) é um parâmetro muito precoce de eritropoiese ferro-deficiente.
Um parâmetro que ainda não tem sido amplamente utilizado na prática diária é o Protoporfirina de zinco (ZPP). Se não houver ferro disponível durante a síntese da hemoglobina, o zinco é metabolizado e o resultado é ZPP globin. ZPP surge da fase II da deficiência de ferro. Uma medição muito rentável por hemato-fluorometria, que pode ser utilizada como diagnóstico no local de tratamento, permite o diagnóstico e a quantificação da eritropoiese com deficiência de ferro, embora os diferentes métodos de medição e a falta de normalização dificultem uma implementação generalizada [3]. Também a medição de Hepcidina permite a diferenciação da deficiência absoluta de ferro da deficiência funcional de ferro no contexto de doenças crónicas. Na ausência de normalização, este parâmetro também não é utilizado na prática clínica diária.
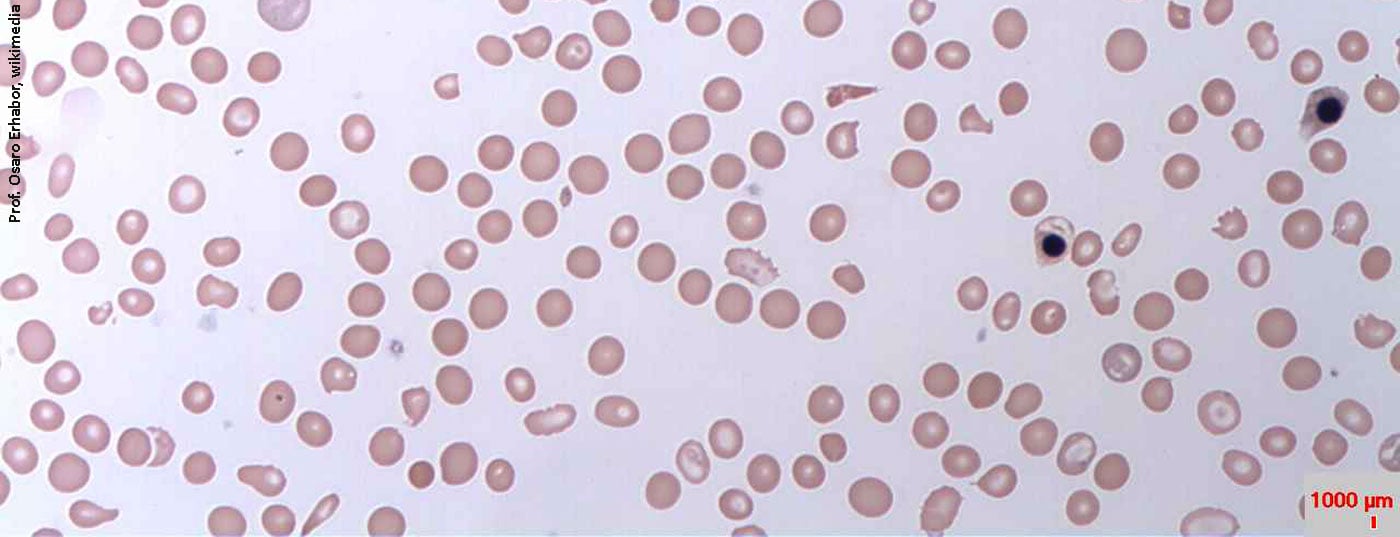
Em A fase III manifesta anemia com hipocromia (MCH <28 pg) e eritrócitos microcíticos (MCV <80 fl) ocorre com uma concentração de Hb de <12 g/dl nas mulheres e <13 g/dl nos homens. Como expressão da reactividade cruzada da trombopoiese ao aumento dos níveis de eritropoietina, a trombocitose reactiva não é invulgar (para uma visão geral do diagnóstico de deficiência de ferro, ver Quadro 2).
Os aspectos específicos do paciente oncológico
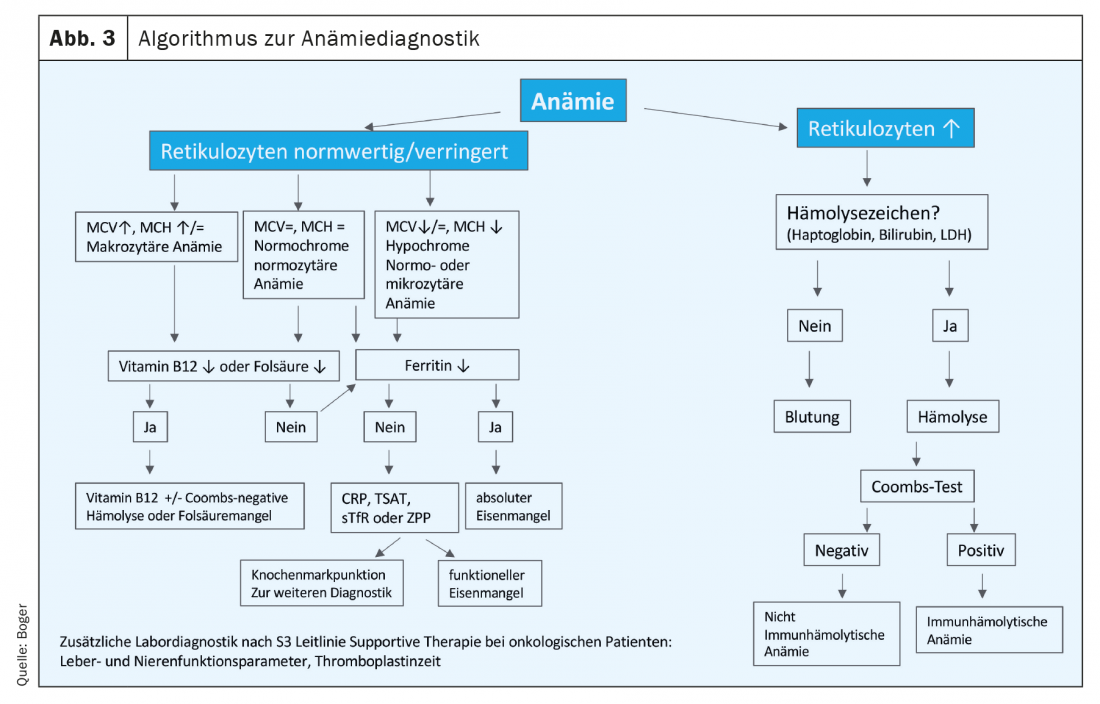
Em doentes oncológicos, a deficiência de ferro absoluta e funcional é frequentemente encontrada devido a inflamação, nutrição perturbada e perda de sangue ou redução do tempo de sobrevivência dos eritrócitos, sobrepostos a (Fig. 2).Na directriz alemã S3 Terapia de Apoio em Pacientes com Cancro, o diagnóstico adequado já é recomendado no diagnóstico inicial. Outras causas, não específicas do tumor, de anemia devem também ser esclarecidas [4]. Um algoritmo para o diagnóstico da anemia está disponível em Figura 3 compilada.
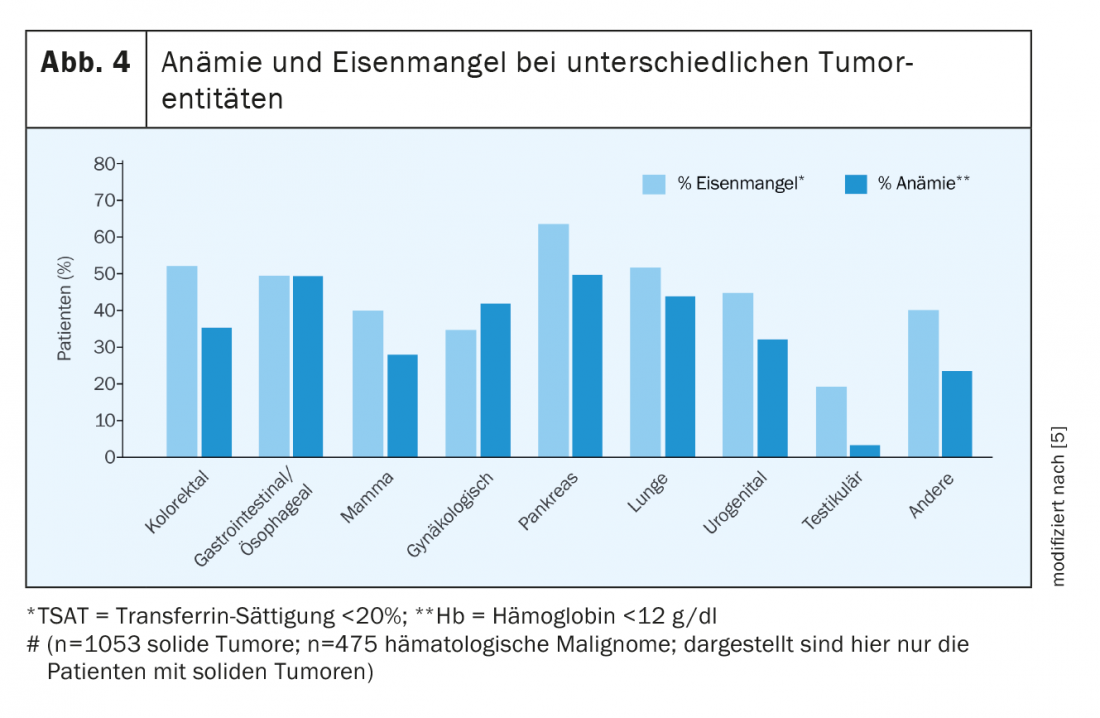
Já no momento do diagnóstico, metade de todos os doentes com tumores têm anemia e deficiência de ferro. Sob terapia, os números aumentam significativamente. Nem todos os tumores causam anemia ou deficiência de ferro com a mesma extensão. Em Figura 4 fornece uma visão geral da prevalência de diferentes doenças tumorais [5,6].
Hemorragia crónica ocorre especialmente em tumores gastrointestinais ou ginecológicos. A perda de sangue estimula a eritropoiese hiperregenerativa através da indução reactiva da eritropoietina e, portanto, requer mais ferro. Se, além disso, uma deficiência funcional de ferro estiver presente na inflamação crónica e a eritropoiese for também inibida pela terapia de tumores baseada em drogas ou radiação, a eritropoietina é frequentemente elevada na função renal normal, mas o aumento não é suficiente para compensar a anemia multicausal.
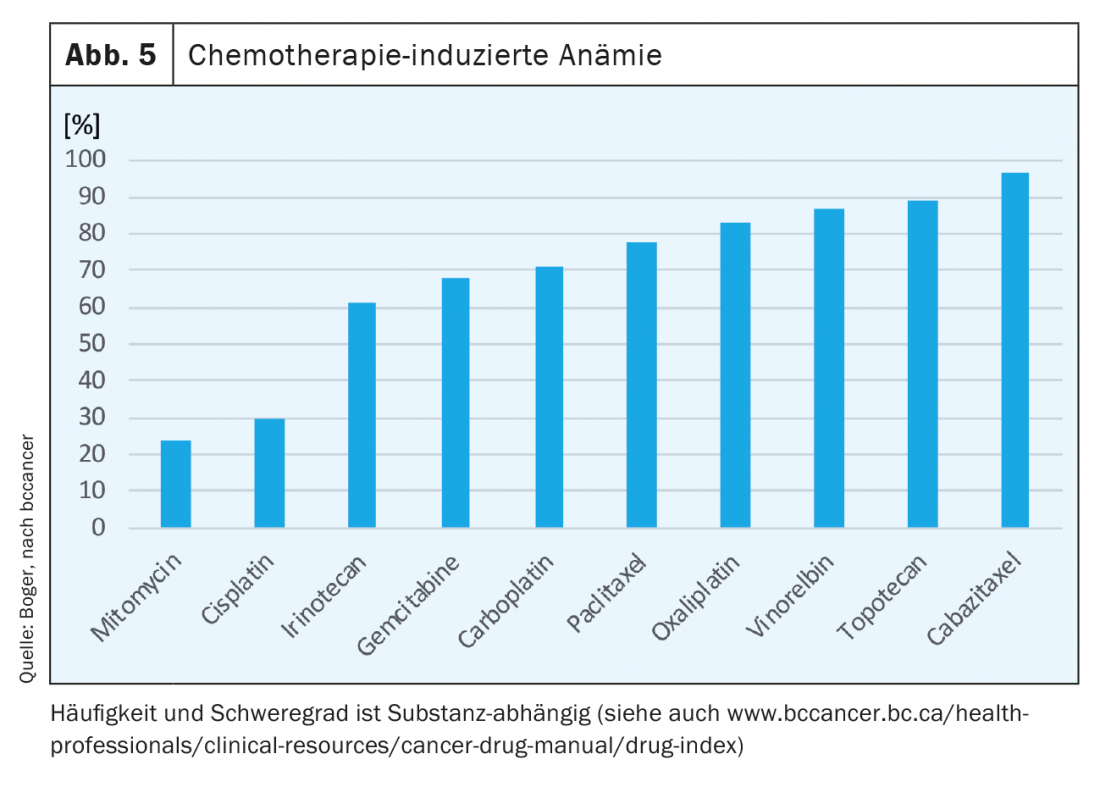
Em até 75% de todos os doentes oncológicos, a anemia ocorre no decurso do tratamento. Apenas com radioterapia, dependendo da entidade tumoral, em até 50% dos pacientes. Os agentes quimioterápicos suprimem a eritropoiese e, dependendo da substância, provocam anemia (Fig. 5). Sob terapias combinadas vemos um efeito aditivo e também com o número de ciclos há frequentemente um aumento da anemia [7].
Terapia da deficiência de ferro e da anemia por deficiência de ferro em doentes com tumores
Substituição do ferro
Uma deficiência absoluta de ferro é uma indicação clara de substituição. Para o cálculo da necessidade de ferro, o cálculo de acordo com Ganzoni tornou-se estabelecido:
|
Défice total de ferro (mg) = [Soll-Hb – Patienten Hb (g/dl)] × peso corporal (kg) × 2,4 + ferro de armazenamento* (mg) * |
Substituição oral
Para substituição oral, estão disponíveis preparações com ferro bivalente bem como ferro trivalente. As dosagens variam até 200 mg diários. Mesmo com muito boa tolerância, o organismo pode tirar o máximo proveito. 10% dos quais são absorvidos. Os doentes oncológicos têm frequentemente uma procura muito elevada e normalmente uma deficiência de ferro funcional, razão pela qual a substituição oral causaefeitos secundários desnecessários (tolerância gastrointestinal)se a absorção for prejudicada, sem reabastecimento eficiente de reservas de ferro. Antes de decidir sobre a terapia de substituição oral, deve ser determinado o estado inflamatório e possíveis contra-indicações adicionais à substituição oral (por exemplo, ressecção gástrica, perturbações de má absorção, obstipação crónica, aderência deficiente à terapia). Prisão de ventre, adesão deficiente à terapia).
As substâncias frequentemente utilizadas na suplementação oral são fumarato de ferro(II), gluconato de ferro(II) e sulfato de ferro(II). Recentemente, surgiram no mercado substâncias alternativas com potencial de absorção melhorado e um perfil de tolerabilidade mais favorável (mas perfil de custos menos favorável): complexos de polissacarídeos de maltol férrico e formulações de lipossomal férrico [8].
Já 14 dias após o início da substituição, deverá haver um aumento da hemoglobina de ≥1 g/dl. Se não for este o caso, a mudança para uma preparação intravenosa deve ser feita [9]. Após a normalização dos níveis de hemoglobina, a substituição oral deve ser continuada durante pelo menos três meses para reabastecer as reservas de ferro.
Substituição intravenosa
A substituição intravenosa deve ser preferida em doentes com tumores com problemas comprovados de utilização de ferro e eritropoiese com deficiência de ferro ou anemia por deficiência de ferro. Especialmente no caso de terapia simultânea com substâncias estimulantes da eritropoiese, é aconselhável o uso preferencial de formulações intravenosas para uma suplementação eficiente [3].
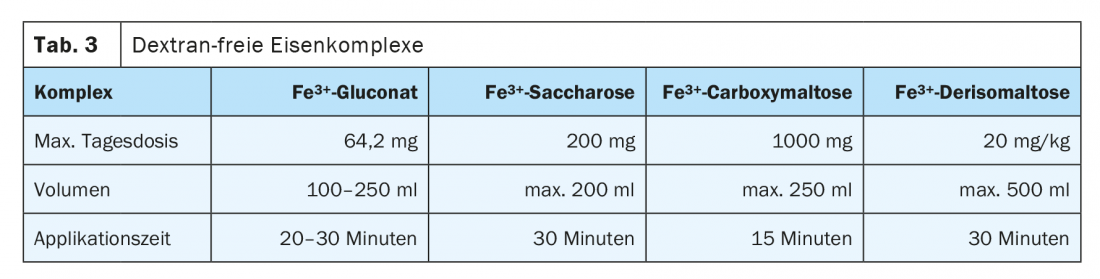
Existe um risco de reacção anafiláctica com todas as preparações de ferro parenteral devido aos parceiros Fe-binding, mas este risco é muito baixo com as substâncias modernas. A Agência Europeia de Medicamentos (EMA) já determinou em 2013, num procedimento de avaliação de riscos, que os benefícios superam os seus possíveis riscos. O risco é maior com preparações contendo dextranos, pelo que as preparações sem dextranos são preferíveis. Existe um perfil de efeito secundário significativamente mais favorável para o gluconato férrico, sacarose de hidróxido férrico, e carboximaltose férrica. Estas são nanopartículas dissolvidas coloidalmente. Estes são tomados e decompostos no fígado e baço pelo sistema reticuloendotelial. O ferro libertado é armazenado ou distribuído no organismo por transferrina. A administração intravenosa deve ser dada de preferência como uma infusão curta. Uma aplicação demasiado rápida pode exceder a capacidade de ligação da transferrina e causar sintomas de rubor. O volume de aplicação, a quantidade de ferro ligado em complexo por infusão e dose única vs. dose múltipla diferem significativamente e determinam a frequência da terapia e os intervalos de controlo. Em O quadro 3 lista várias preparações sem dextrano que podem ser administradas por via intravenosa.
Transfusão de concentrados de eritrócitos
A indicação para transfusão é feita com base na condição clínica, nos factores de risco do doente, na gravidade dos sintomas de anemia, no valor de Hb (ou hematócrito), na natureza aguda da perda de sangue e nas possibilidades de compensação [4]. Em doentes com perda aguda de sangue, tumor sólido ou hemoblastose, a indicação transfusional deve ser verificada a partir de um valor de hemoglobina ≤8 g/dl. Os doentes com anemia crónica têm por vezes valores de Hb entre 6 – 8 g/dl sem quaisquer sintomas e, portanto, sem indicação de transfusão convincente. Em doentes com doença cardíaca ou pulmonar concomitante, o nível de hemoglobina deve ser estabilizado em 10 g/dl.
Terapia com agentes estimulantes da eritropoiese
Para anemia induzida por quimioterapia, agentes estimulantes da eritropoiese (ESA) são aprovados para anemia sintomática com um valor Hb -≤10 g/dl [4]. A combinação da ESA e da suplementação com ferro intravenoso durante a quimioterapia pode reduzir significativamente o número de transfusões de sangue [10]. O momento da suplementação com ferro deve preceder a terapia da ESA. No entanto, deve ser dada especial atenção aos riscos em termos de perfil de risco trombofílico e ao benefício individual da terapia da ESA para o paciente [11].
Outras abordagens terapêuticas para a deficiência de ferro funcional em doentes com tumores, tais como a terapia androgénica ou a utilização de antagonistas da hepcidina e da proteína morfogenética óssea (BMP), são actualmente objecto de investigação clínica [12].
Resumo
A deficiência de ferro e a anemia são difíceis de considerar separadamente nos doentes oncológicos. Tanto a anemia como a deficiência de ferro têm geralmente várias causas subjacentes. Por conseguinte, é sempre importante excluir ou tratar outras causas, não específicas do tumor. A maioria dos pacientes oncológicos correm o risco de desnutrição e um estudo qualificado do estado nutricional e um aconselhamento regular sobre nutrição durante o tratamento oncológico deve ser realizado desde cedo. No entanto, a maioria dos doentes desenvolve deficiência de ferro apesar de uma ingestão oral optimizada. No caso de deficiência de ferro causada por hemorragia crónica e inflamação crónica, a necessidade aumentada do organismo não pode e não deve ser satisfeita por substituição oral.
A quimioterapia suprime a eritropoiese e a secreção de eritropoietina do próprio corpo não é suficiente para satisfazer os requisitos de estimulação em equilíbrio negativo eritropoiético permanente. A terapia transfusional só deve ser utilizada para a correcção imediata da anemia (hemorragia, risco cardiocirculatório) devido aos efeitos tóxicos e ao potencial prognóstico negativo. A suplementação com ferro intravenoso é a terapia preventiva ou correctiva preferida para a anemia.
Mensagens Take-Home
- Se a doença maligna for diagnosticada pela primeira vez, deve ser realizada uma análise do substrato de eritropoiese e o diagnóstico de anemia.
- Hb, estado do ferro (TSAT, ferritina sérica) e CRP devem ser determinados no início e antes de cada ciclo de quimioterapia.
- A deficiência funcional de ferro em doentes com cancro caracteriza-se por uma utilização deficiente das reservas intrínsecas de ferro.
- O ferro oral só deve ser considerado em doentes com deficiência absoluta de ferro (ferritina <30 ng/ml) e condição não-inflamatória (CRP <5 mg/l).
- A suplementação com ferro intravenoso é a terapia com ferro preferida no paciente oncológico.
Literatura:
- Finberg KE: Regulação da homeostase sistémica do ferro. Parecer actual em hematologia 2013; 20(3): 208-214.
- Ludwig HE, et al: Metabolismo do ferro e suplemento de ferro em doentes com cancro. Wien Klin Wochenschr 2015; 127(23-24): 907-919.
- Hastka J, et al: Deficiência de ferro e anemia por deficiência de ferro. Onkopedia Leilinien 2020; www.onkopedia.com/de/onkopedia/guidelines/eisenmangel-und-eisenmangelanaemie/@@guideline/html/index.html, acedido em 29.06.2020.
- Jordan K, et al.: Richtlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Supportive Therapie bei onkologischen PatientenInnen – Langversion 1.3.2020; www.leitlinienprogrammonkologie.de/leitlinien/supportive-therapie, acedido em 29.06.2020.
- Ludwig H, et al: Prevalência de deficiência de ferro através de diferentes tumores e a sua associação com mau estado de desempenho, estado de doença e anemia. Anais de oncologia: revista oficial da Sociedade Europeia de Oncologia Médica/ESMO 2013; 24(7): 1886-1892.
- Ludwig H, et al: The European Cancer Anaemia Survey (ECAS): um grande inquérito prospectivo multinacional que define a prevalência, incidência e tratamento da anemia nos doentes com cancro. Eur J Cancer 2004; 40(15): 2293-2306.
- Xu H, et al: Incidência de anemia em doentes diagnosticados com tumores sólidos que recebem quimioterapia, 2010-2013. Clin Epidemiol 2016; 8: 61-71.
- Farrag K, et al: Novas opções para a substituição oral do ferro. Terapia com medicamentos 2019; 37(4): 105-112.
- Okam MM, et al: Iron Supplementation, Response in Iron-Deficiency Anemia: Analysis of Five Trials. The American journal of medicine 2017; 130(8): 991 e991-991 e998.
- Bastit L, et al: Ensaio aleatório, multicêntrico e controlado comparando a eficácia e segurança da darbepoetina alfa administrada a cada 3 semanas com ou sem ferro intravenoso em doentes com anemia induzida por quimioterapia. Journal of clinical oncology: revista oficial da Sociedade Americana de Oncologia Clínica 2008; 26(10): 1611-1618.
- Aapro M, et al: Management of anemia and iron deficiency in patients with cancer: ESMO Clinical Practice Guidelines. Anais de oncologia: revista oficial da Sociedade Europeia de Oncologia Médica/ESMO 2018; 29(Suplemento 4): iv96-iv110.
- Gilreath JA, Rodgers GM: Como tratar a Anemia Cancro. Sangue 2020; doi: 10.1182/blood.2019004017.
InFo ONCOLOGy & HaEMATOLOGy 2020; 8(6): 10-15