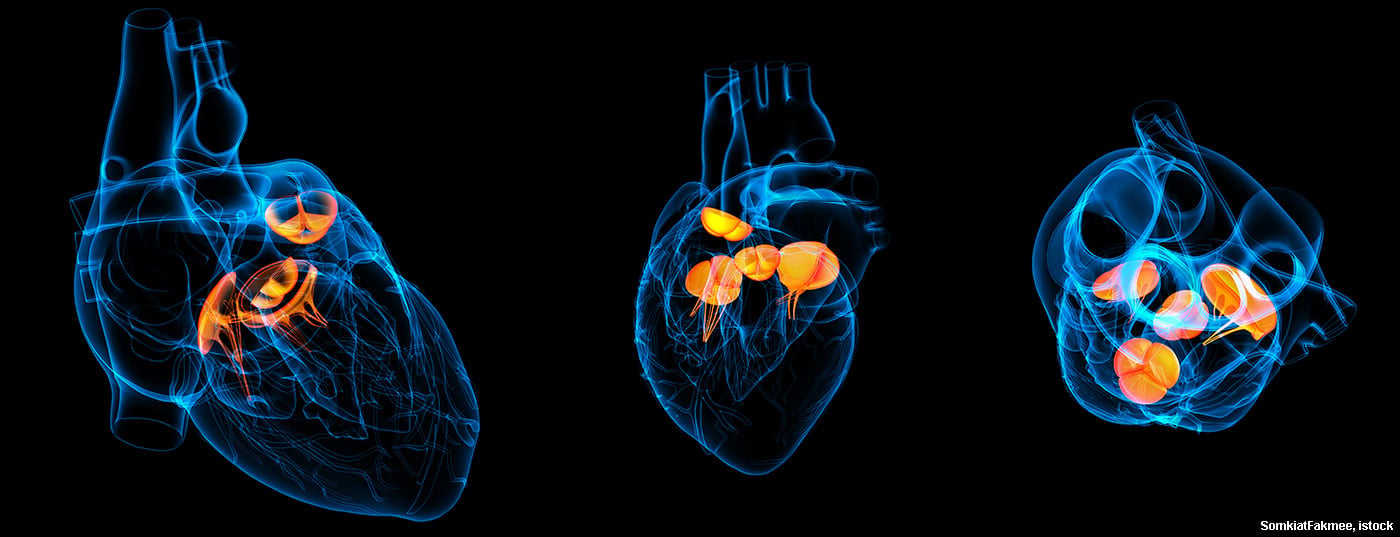
O progresso médico tem também um impacto na epidemiologia da endocardite infecciosa. As implantações de válvulas de cateter (TAVI), em particular, serão um grande desafio no futuro.
Endocardite infecciosa refere-se a uma infecção do endocárdio (especialmente das válvulas cardíacas) ou de implantes intracardíacos (por exemplo, válvulas cardíacas artificiais, próteses aórticas e eléctrodos de pacemakers e desfibriladores) causada por bactérias em mais de 90% dos casos. Na prática clínica diária, são principalmente as válvulas aórticas e mitrais que são afectadas. As válvulas do coração do lado direito só estão envolvidas em cerca de 5-10% de todos os casos, aqui principalmente a válvula tricúspide. Os factores de risco para endocardite do lado direito são principalmente o abuso de drogas intravenosas, bem como dispositivos intracardíacos como cabos de pacemaker e cateteres intravasculares (especialmente cateteres venosos centrais). Os defeitos cardíacos congénitos individuais (especialmente aqueles com patologia valvular e/ou com uma derivação) também representam um risco para a ocorrência de endocardite [1,2]. A endocardite da válvula protética é responsável por cerca de 5% de todas as endocardite infecciosas [1–4].
Profilaxia
A endocardite infecciosa foi descrita pela primeira vez por William Osler [5] em 1885. Na década de 1920, as bactérias que circulavam na corrente sanguínea após procedimentos dentários foram suspeitas pela primeira vez como causa de infecção das válvulas, e consequentemente as primeiras recomendações para a profilaxia antibiótica foram publicadas pela AHA (Associação Americana do Coração) em 1955 [6]. Desde então, as recomendações para a administração profiláctica de antibióticos foram adaptadas várias vezes. A principal questão aqui é pesar os benefícios da profilaxia contra o risco de promover a resistência aos antibióticos. Na última revisão em 2007, as recomendações de profilaxia antibiótica em situações de risco eram muito restritivas (Tab. 1) [7,8].

Acima de tudo, o número e tipo de intervenções e acções para as quais a profilaxia deveria ser administrada foram restringidos. A profilaxia antibiótica ainda é indicada para procedimentos dentários que envolvam manipulação do sulco gengival ou perfuração da mucosa, bem como para procedimentos na região orofaríngea se a mucosa for perfurada. Por outro lado, a recomendação de profilaxia durante procedimentos e manipulações do tracto urogenital, procedimentos ginecológicos e procedimentos gastrointestinais, tais como endoscopias, foi retirada, desde que não haja infecção activa nestes sistemas de órgãos. Caso contrário, a profilaxia e a terapia apropriada são naturalmente necessárias.
Os grupos de risco de pacientes que deveriam continuar a receber profilaxia foram também definidos de forma muito mais restrita. Actualmente, apenas os doentes com maior risco devem receber profilaxia e aqui especialmente os doentes com elevado risco de uma evolução desfavorável quando ocorre uma endocardite infecciosa. Isto inclui todos os pacientes após substituição de válvulas (quer seja cirúrgico com prótese mecânica ou biológica ou intervencionista com válvulas transcatéter). Os grupos de risco incluem também pacientes que já tiveram endocardite, pacientes com vitia congénita (ver as listas separadas nas directrizes [7,8]) e pacientes após transplante cardíaco com novo início de valvulopatia. Em doentes com uma condição após reconstrução da válvula, recomenda-se a profilaxia durante 6 meses até à endotelização. Em contraste, a profilaxia antibiótica já não é indicada em doentes com um defeito na válvula, como estenose aórtica ou regurgitação mitral.
O risco de aumentar a resistência aos antibióticos dos tipos mais comuns de germes foi citado como a razão para a atitude significativamente mais restritiva em relação à administração profiláctica de antibióticos. De facto, há relatórios que mostram uma diminuição dos germes resistentes para cerca de 10% desde a introdução das novas directrizes, embora a causalidade seja difícil de provar [10]. O factor económico e a segurança do doente também não devem ser subestimados, uma vez que podem ocorrer reacções alérgicas graves mesmo durante a profilaxia antibiótica. Como justificação adicional para a postura mais restritiva, são destacados estudos que mostram bacteremia na higiene dentária mesmo durante a escovação dentária normal, que é de magnitude semelhante às intervenções dentárias sem o envolvimento do aparelho gengival. Por conseguinte, a profilaxia não se justifica em situações que não excedam o nível de risco do risco normal do dia-a-dia.
Incidência
A incidência de endocardite infecciosa é de 3-10 por 100.000 pessoas por ano. Quase 40% das infecções das válvulas protéticas estão agora associadas a hospitais. Associado ao hospital significa que uma infecção surge em ligação com uma estadia hospitalar (por exemplo, devido a cateteres venosos, infecções de feridas, pneumonia, infecções do tracto urinário). Além disso, há numerosas publicações que relatam um aumento da incidência nos últimos anos [1,2,9,10]. Podemos confirmar esta observação muito bem com base na nossa própria experiência. Contudo, interpretar o aumento de casos com endocardite protética é difícil, uma vez que muitos factores podem influenciar estes números. Num estudo da Inglaterra, o número de infecções e prescrições de antibióticos foi analisado utilizando um registo nacional após a restrição da profilaxia por endocardite. Foi demonstrada uma diminuição drástica nas prescrições de antibióticos, mas ao mesmo tempo um aumento rápido dos casos de endocardite [9].
Outros estudos noutros países não conseguiram provar um aumento igualmente rápido dos casos de endocardite, razão pela qual os próprios autores do estudo inglês relativizam a referência às directrizes de profilaxia alteradas [6].
A idade crescente dos pacientes, combinada com as correspondentes comorbidades cada vez mais complexas, é provavelmente uma das mudanças mais importantes que explicam o aumento significativo dos casos de endocardite infecciosa. No passado, os doentes mais jovens com doenças reumáticas das válvulas eram predispostos à endocardite, mas actualmente, em regiões com bons cuidados médicos, são sobretudo os doentes mais velhos com doenças degenerativas das válvulas que são afectados. No entanto, devido à migração, observa-se também um aumento renovado da prevalência de doenças reumáticas das válvulas com uma predisposição correspondente nos nossos hospitais. Outros factores de risco importantes incluem a utilização crescente de procedimentos como a diálise e a imunossupressão, bem como o aumento de pacientes que tiveram cateteres intravasculares (cateteres venosos centrais), implantes intracardíacos como pacemakers, outros materiais estranhos como próteses de anca e joelho e, claro, válvulas protéticas instaladas [1,2,6,11,12]. Nos pacientes mais jovens, trata-se principalmente de pessoas com administração de medicamentos por via intravenosa.
Diagnóstico
Ao fazer um diagnóstico, os resultados clínicos, os resultados microbiológicos e os resultados de imagem devem ser combinados. Devem ser utilizados os critérios Dukes (Tab. 2) [1,2,7,13], que pode interpretar diferentes modalidades e estimar a probabilidade de endocardite. Um papel cada vez mais importante é atribuído à imagem, pelo que a ecocardiografia transoesofágica se tornou o padrão ouro; com os avanços técnicos e o aumento qualitativo da resolução da imagem, pode esperar-se uma maior taxa de detecção e, portanto, também um aumento do número de casos. Os diagnósticos PET-CT são cada vez mais utilizados em casos de suspeita de infecção de próteses vasculares, embora ainda seja necessário adquirir muita experiência na avaliação dos resultados destes exames.

Para os exames microbiológicos, é importante tomar 3 conjuntos de culturas de sangue, que devem ser tomados rapidamente à menor suspeita. Com este cultivo triplo, são detectados até 98% dos germes em bacteriemia [7,14].
Microbiologia
O espectro dos agentes patogénicos mudou nos últimos anos, passando dos agentes patogénicos anteriormente mais comuns da zona orofaríngea para os agentes patogénicos associados aos hospitais. O Staphylococcus aureus ultrapassou os estreptococos como o agente patogénico mais comum. Na década de 1960, a proporção de Staphylococcus aureus era de 18%, mas desde então aumentou até 38% (Tab. 3) [1,2,4,15].
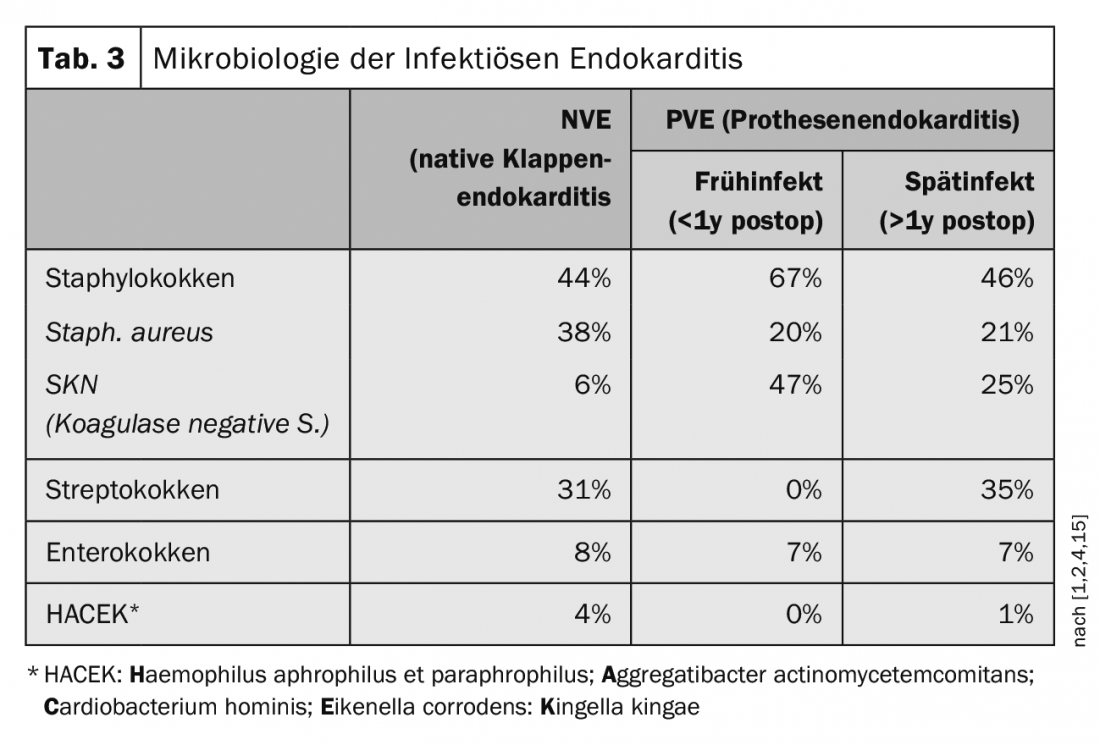
A endocardite infecciosa das válvulas protéticas, a chamada endocardite protética (PVE), é dividida em infecção precoce no prazo de um ano após a implantação e infecção tardia, que ocorre após um ano após a implantação [7,14]. As infecções precoces ocorrem em até 16% das infecções por próteses. As infecções precoces directamente relacionadas com a cirurgia ocorrem geralmente dentro de 2-3 meses e são mais frequentemente causadas por um estafilococo coagulase negativo (SKN) ou por um estafilococo aureus. Nas implantações de válvulas de cateter transfemoral (TAVI), por outro lado, os enterococos são mais frequentemente isolados em infecções precoces, embora a situação dos dados aqui ainda seja relativamente escassa [1,2]. As infecções de próteses que ocorrem após um ano são infecções hematogénicas e correspondem ao espectro germinal da endocardite nativa das válvulas [16]. Após a implantação de uma prótese de válvula transfemoral (TAVI), existe um risco de 5-6% de endocardite dentro de 5 anos. Em comparação, após a implantação de um pacemaker, existe um risco de 2% de desenvolvimento de endocardite no prazo de 5 anos. Para próteses de válvulas cirúrgicas, sejam elas biológicas ou mecânicas, o risco é de cerca de 3-4% dentro de 5 anos.
Apesar de todos os avanços na cirurgia cardíaca, doenças infecciosas e medicina intensiva, a mortalidade não mudou significativamente nas últimas décadas: a endocardite infecciosa continua a ser uma doença sistémica grave com uma morbilidade e mortalidade correspondentemente elevadas. A taxa de mortalidade por endocardite infecciosa é de 20% e aumenta para mais de 50% no caso da endocardite protética.
Quando uma válvula cardíaca nativa é afectada, trata-se geralmente de depósitos, as chamadas vegetações, que, dependendo do seu tamanho, podem embolizar e, no pior dos casos, levar a um insulto cerebrovascular séptico. Além disso, pode ocorrer uma insuficiência aguda da válvula afectada – através da destruição da estrutura -, levando a uma deterioração hemodinâmica aguda. As estenoses são observadas com muito menos frequência, ocasionalmente em ligação com grandes vegetações.
Na endocardite protética, as vegetações podem causar tanto estenose como insuficiência nas válvulas mecânicas ao bloquear um folheto da válvula. As válvulas biológicas levam frequentemente à destruição das bolsas das válvulas e, por conseguinte, a graves insuficiências. Uma complicação temida da endocardite protética é a insuficiência paravalvular devido a abscessos em torno do anel da válvula. Isto pode levar a um completo afrouxamento da válvula com o correspondente fenómeno de “válvula de balanço”. O abscesso é observado principalmente na endocardite com Staphylococcus aureus.
O abscessamento da válvula do lado esquerdo ocorre não raro na junção aortomitral, com correspondente destruição da continuidade ventrículo-aórtica e na região do septo membranoso com correspondente perturbação da condução AV até ao bloqueio AV de terceiro grau, inclusive.
Cirurgia
A terapia cirúrgica para endocardite das válvulas nativas é necessária em 40-50% dos casos; a terapia conservadora com antibiose pode levar à cicatrização da válvula afectada em até 60%. Com as válvulas protéticas, a situação é muito mais perigosa e a reparação cirúrgica é necessária com muito mais frequência. Os sistemas de pacemaker também precisam de ser actualizados em tais pacientes. A reimplantação de um novo sistema de pacemaker depende da respectiva indicação e da corrente e pode ser realizada na mesma operação utilizando eléctrodos epicárdicos. Devido ao curso extravascular, estes últimos são menos susceptíveis à reinfecção.
Para pacientes que necessitam de cuidados intensivos, a transferência para o centro com tratamento e avaliação interdisciplinares apropriados é importante. Além disso, estudos mostram que a indicação mais rápida possível com um desempenho adequado da operação resulta numa sobrevivência perioperatória significativamente melhor, mas também no curso a longo prazo [17,18].
As directrizes europeias fornecem orientações sobre a indicação da terapia cirúrgica (Tab. 4) [7]. A terapia cirúrgica é particularmente indicada nas seguintes situações: [2,3,7]
- Disfunção da válvula com instabilidade hemodinâmica,
- infecção incontrolável apesar da terapia antibiótica adequada,
- aumento do absentismo com insuficiência paravalvular,
- Prevenção da embolização
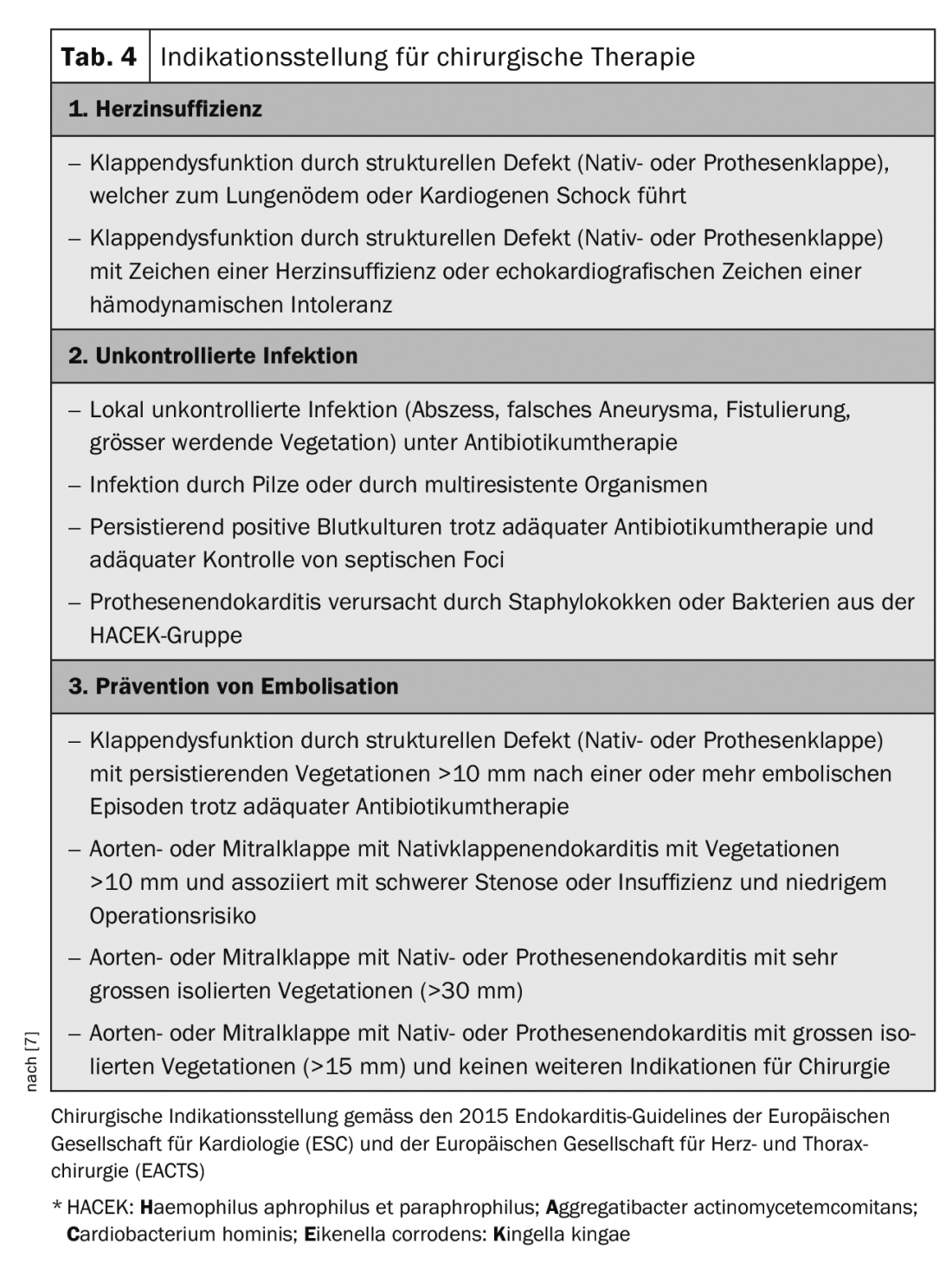
No que diz respeito à prevenção da embolização, existe também potencial para melhorar as directrizes. Para vegetações de lado esquerdo maiores que 10 mm, a cirurgia precoce deve ser indicada mais generosamente [17]. Em pacientes com AVC, a cirurgia é frequentemente atrasada demasiado tempo, aceitando assim uma maior deterioração do paciente com maior risco de embolia. Após acidente vascular cerebral sem hemorragia intracraniana e sem grave deficiência neurológica, a cirurgia deve ser realizada sem demora. Em caso de grande isquemia cerebral ou hemorragia, deve ser considerado se se deve esperar pelo menos 3-4 semanas.
A substituição da válvula é o tratamento de escolha para a endocardite da válvula aórtica nativa. Se a válvula mitral nativa for afectada, a reconstrução pode ser tentada, desde que o tecido não seja completamente amaciado e/ou destruído. As próteses de válvulas infectadas devem ser substituídas em qualquer caso. As cavidades de abscesso são normalmente fechadas com manchas de pericárdio.
No futuro, é provável que a endocardite das válvulas transcatéter se torne um problema crescente. Até recentemente, estas válvulas eram implantadas principalmente em doentes idosos, inoperáveis, que morriam frequentemente antes de desenvolverem endocardite. E se a endocaridite ocorreu, estes pacientes foram tratados de forma conservadora. Com um número esperado de pacientes mais jovens a serem equipados com válvulas de cateter no futuro, o número de endocardite de prótese após TAVI também irá aumentar. De facto, pode assumir-se que a incidência será pelo menos igual à das próteses cirúrgicas convencionais.
Tecnicamente, as intervenções após a implantação de uma prótese TAVI podem ser um desafio, uma vez que estas válvulas contêm muito mais material estranho e, em particular, rede de arame, que frequentemente se estende para dentro ou mesmo para além da raiz da aorta. Estes podem ocasionalmente ser extremamente difíceis de remover. Por outro lado, após a substituição da válvula cirúrgica, o anel da válvula pode normalmente ser retirado e uma nova válvula implantada no mesmo local. Com as válvulas de cateter, o risco de danos na área da raiz da aorta é maior. Além disso, se um enxerto composto tiver de ser eventualmente implantado, o esforço é significativamente maior. A taxa de recorrência após endocardite da válvula protética é de 6-15% [2].
A lição mais importante em pacientes com uma condição de febre pouco clara e uma constelação de risco potencial (portador de prótese valvar, vício valvar) é pensar na possibilidade de endocardite infecciosa, mesmo que os sintomas não sejam muito típicos. Especialmente em pacientes com próteses de válvula, a endocardite deve ser excluída em qualquer caso de febre pouco clara. Se houver sinais de infecção ou redução do estado geral com um novo sopro cardíaco, é também essencial procurar a endocardite. No futuro, o número de pacientes em risco (aqueles com TAVI, próteses vasculares das grandes artérias ou com endovasculares na aorta) é susceptível de aumentar significativamente.
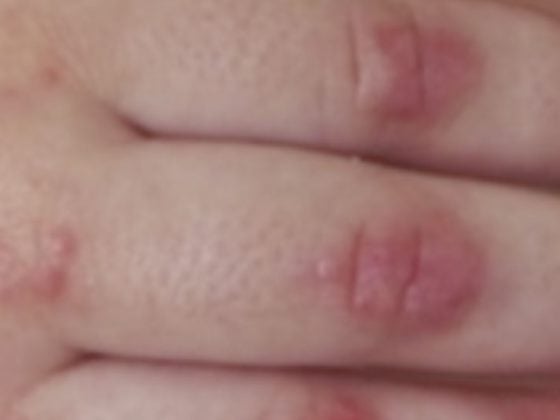
É também importante cuidar dos pacientes com implantes cardiovasculares, no que diz respeito à instrução sobre a profilaxia da endocardite – não só através de antibióticos quando indicados, mas também no que diz respeito a medidas de higiene como a higiene dentária, mas também a prevenção e tratamento de lesões cutâneas recorrentes ou feridas crónicas.
Mensagens Take-Home
- O progresso médico está a mudar a epidemiologia da endocardite infecciosa.
- Globalmente, esperamos um aumento dos casos de endocardite. O diagnóstico continua a ser um desafio.
- As infecções associadas aos hospitais tornaram-se também um problema importante na endocardite infecciosa.
- O tratamento cirúrgico da endocardite infecciosa torna-se cada vez mais complexo quanto mais material estranho já se encontra no paciente.
- A endocardite após a implantação da válvula do cateter (TAVI) será um grande desafio no futuro.
- A indicação para a administração de antibióticos deve ser sempre bem justificada.
- Portanto, a administração de profilaxia de endocardite só é recomendada de forma muito restritiva.
Literatura:
- Cahill TJ, et al: Challenges in Infective Endocarditis. JACC 2017; 69: 325-344.
- Cahill TJ, Prendergast BD: endocardite infecciosa. Lancet 2016; 387: 882-893.
- Wang A, et al: Perfil clínico contemporâneo e resultado da endocardite protética das válvulas. JAMA 2007; 297: 1354-1361.
- Moreillon P, Que YA: endocardite infecciosa. Lancet 2004; 363: 139-149.
- Osler W.: The Gulstonian Lectures, on Malignant Endocarditis. BMJ 1985; 1: 577-579.
- Dayer M, Thornhill M: Antibiotic Prophylaxis Guidelines and Infective Endocarditis: Cause for Concern? JACC 2015; 65: 2077-2078.
- Habib G, et al.: 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endossado por: Associação Europeia de Cirurgia Cardio-Torácica (EACTS), a Associação Europeia de Medicina Nuclear (EANM). Eur Heart J 2015; 36: 3075-3128.
- Flückiger U, Jaussi A: Directrizes suíças revistas para a profilaxia da endocardite. Medicina Cardiovascular 2008; 11: 392-400.
- Dayer MJ, et al: Incidência de endocardite infecciosa em Inglaterra, 2000-13: uma tendência secular, análise de série temporal interrompida. Lancet 2015; 385: 1219-1228.
- Ostovar R, et al: Endocardite: Um problema cada vez maior na Cirurgia Cardíaca. Thorac Cardiovasc Surg 2019; Epub antes da impressão
- Slipczuk L, et al: Infective endocarditis epidemiology over five decades: a systematic review. PLoS One 2013; 8:e82665.
- Fefer P, et al: Changing epidemiology of infective endocarditis: a retrospective survey of 108 cases, 1990-1999. Eur J Microbiol Infect Dis 2002; 21: 432-437.
- Li JS, et al: Proposta de modificações aos critérios do Duque para o diagnóstico de endocardite infecciosa. Clin Infect Dis 2000; 30: 633-638.
- Vongpatanasin W, et al: Válvulas cardíacas protéticas. NEJM 1996; 335: 407-416.
- Murdoch DR, et al: Apresentação clínica, etiologia, e resultado da endocardite infecciosa no século XXI: a Colaboração Internacional sobre Endocardite – Estudo de Coorte Prospectivo. Arch Intern Med 2009; 169: 463-473.
- Butt JH, et al: Risco de Endocardite Infecciosa a Longo Prazo após Substituição da Válvula Aórtica Transcatheter. JACC 2019; 73: 1646-1655.
- Carrel T.: A reparação ou substituição precoce de válvulas não está geralmente contra-indicada em doentes com endocardite infecciosa e AVC com ou sem hemorragia intracraniana. Eur J Cardiothorac Surg 2016; 50: 383-384.
- Carrel T, et al: O que há de novo no tratamento cirúrgico da endocardite infecciosa? Cuidados Intensivos Med 2016; 42: 2052-2054.
CARDIOVASC 2019; 18(4): 9-13