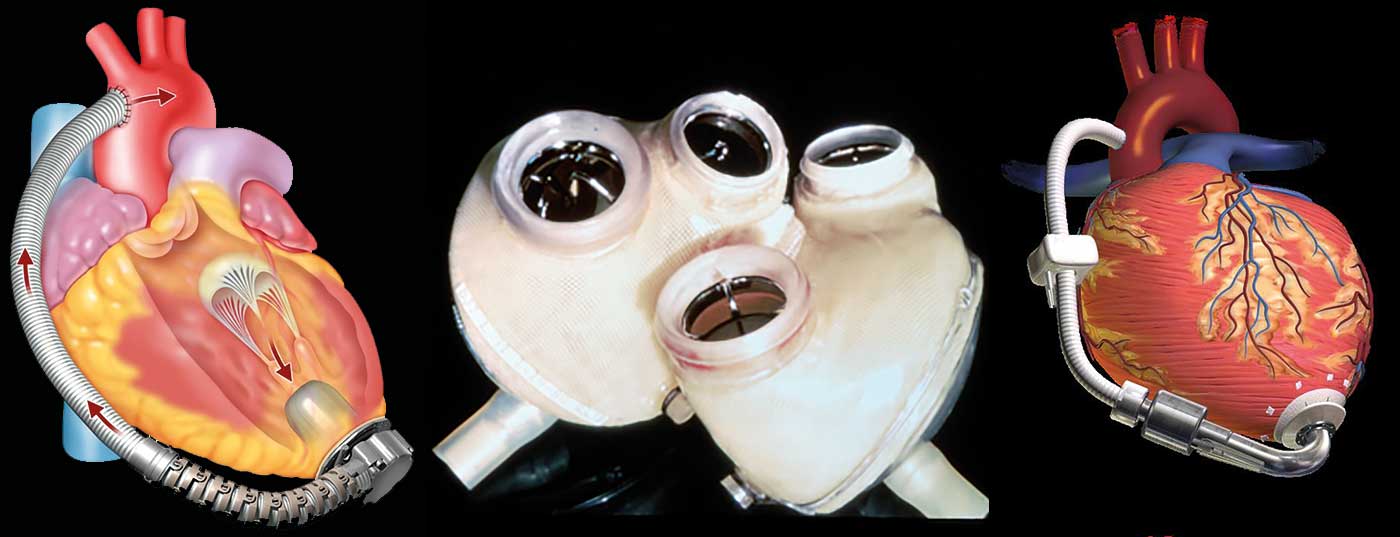
O número de pacientes com problemas cardíacos clinicamente avançadosA insuficiência está a aumentar em todo o mundo. Se as opções terapêuticas convencionais tiverem sido esgotadas, deve ser avaliado se os critérios para o transplante cardíaco estão preenchidos. Os sistemas artificiais de suporte cardíaco (“corações artificiais”) podem fazer a ponte entre o tempo até ao transplante cardíaco, mas são também cada vez mais utilizados como solução definitiva. Corações artificiais totais (“TAH”) substituem o coração que já não funciona; com dispositivos de assistência ventricular (“VAD”), o coração biológico que já não funciona é deixado no lugar e uma bomba normalmente suporta o ventrículo esquerdo. Com a actual geração de dispositivos de assistência cardíaca, mais de 80% dos pacientes sobrevivem no primeiro ano após o implante, e 75% ainda estão vivos após três anos.
Ludwig Rehn (1849-1930) trata uma facada no ventrículo direito com três suturas pela primeira vez a 9 de Setembro de 1896. No 26º Congresso da Sociedade Alemã de Cirurgia, concluiu a sua apresentação do caso com as palavras: “A viabilidade da sutura cardíaca não deve agora provavelmente ser posta em causa”. Ele espera que o seu caso inspire mais trabalho no campo da cirurgia cardíaca. Esta afirmação deve ser vista no contexto de uma citação de Theodor Billroth (1829-1894): “O cirurgião que alguma vez tentaria suturar uma ferida do coração pode ter a certeza de que perderia para sempre o respeito dos seus colegas”. Se Billroth disse realmente esta frase é duvidosa em círculos especializados, mas não pode ser excluída. Para paralelos podem ser encontrados muitas vezes na história médica quando o trabalho pioneiro é feito e os colegas são repreendidos devido a falta de compreensão ou mesmo má vontade.
Reacções muito semelhantes acompanharam o rápido desenvolvimento do suporte circulatório mecânico, que é agora indispensável. Em 21. Março de 1986, o semanário “Die Zeit” publicou o seguinte parágrafo sob o título “Sensação mortal – o jogo macabro com o coração artificial”: “No que diz respeito aos corações artificiais, contudo, o professor tinha de saber quão problemática esta técnica é julgada por especialistas. Apenas dois pacientes sobreviveram com corações artificiais na América. O seu estado é considerado terrível e desumano. Mesmo assumindo que o cirurgião de Berlim tinha escolhido um “caso sem esperança” para a sua estreia, deve ter-lhe passado pela cabeça que a lei protege a dignidade humana mesmo e especialmente na morte”. 20 anos depois, o suporte circulatório mecânico a longo prazo é uma opção terapêutica que é em parte igual ao transplante cardíaco e em algumas situações até superior.
Cada vez mais pacientes com insuficiência cardíaca
Estima-se que cerca de 200.000 pessoas na Suíça vivem com insuficiência cardíaca. 5%, ou seja, cerca de 10.000 pacientes, encontram-se numa fase clinicamente avançada com dispneia correspondente à classe funcional NYHA III a IV. Como expressão do progresso dos cuidados médicos bem sucedidos, a mortalidade das doenças cardiovasculares foi reduzida nas últimas duas décadas, ao mesmo tempo que a incidência e prevalência de insuficiência cardíaca aumentou acentuadamente [1]. O tratamento da insuficiência cardíaca recomendado pelas sociedades profissionais segue um esquema específico passo a passo. Se as opções terapêuticas com fármacos, pacemakers e intervenções cirúrgicas convencionais tiverem sido esgotadas, é necessário avaliar se os critérios para a realização de um transplante cardíaco (HTx) são cumpridos [1].
Coração artificial total e bomba de apoio ao coração
Devido à longa e recentemente crescente discrepância entre o número de órgãos doadores necessários e o número de pacientes nas listas de espera, o trabalho sobre sistemas artificiais de suporte cardíaco (“corações artificiais”) tem vindo a decorrer há várias décadas. Por um lado, estes destinam-se a fazer a ponte entre o tempo até que um transplante de coração possa ser salvo, e por outro lado, com a ajuda de sistemas sofisticados, a dependência dos corações dos doadores tornar-se-á história no futuro. Na verdade, vários corações artificiais já foram desenvolvidos, e outros estão a ser submetidos a ensaios técnicos.

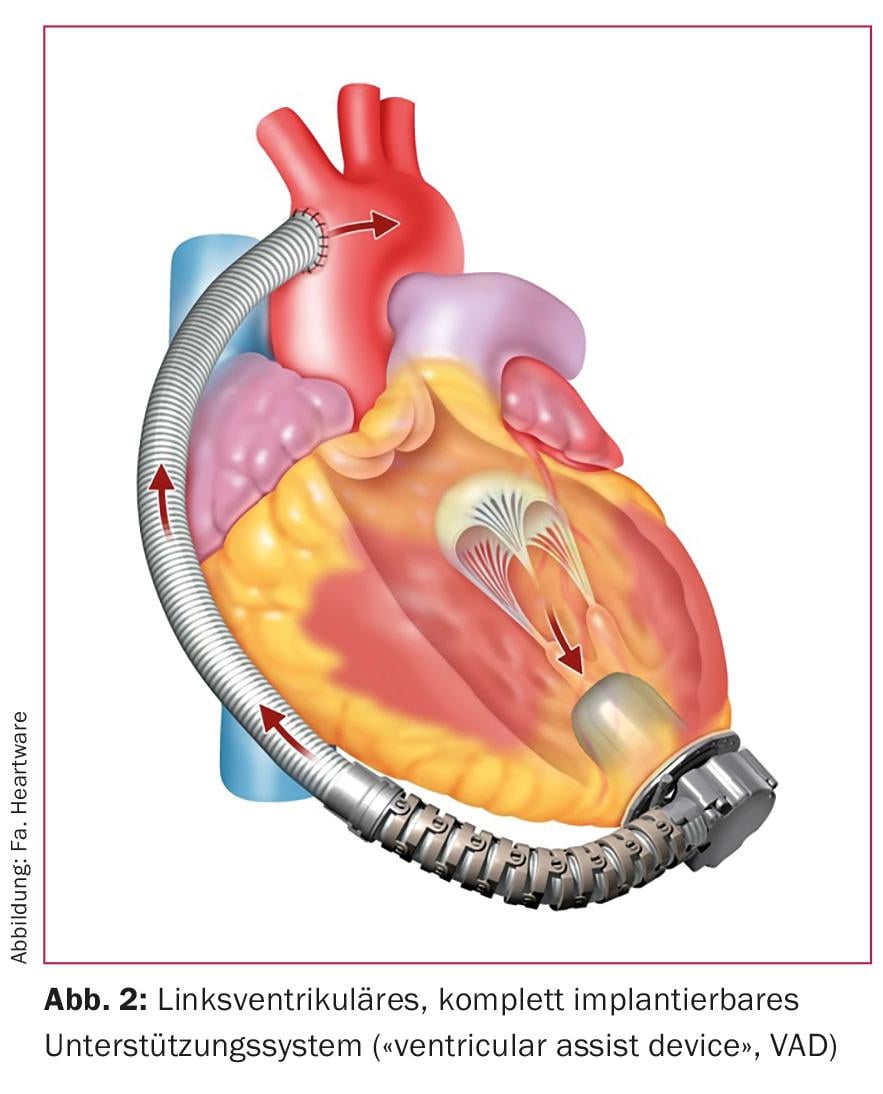
No total dos corações artificiais, o coração que já não funciona é substituído por duas bombas mecânicas interligadas (Fig. 1) . Estes assumem a função do ventrículo esquerdo e direito removido (“coração artificial total”, TAH). Hoje em dia, os corações artificiais totais são raramente utilizados na prática clínica diária. Isto contrasta com o dispositivo de assistência ventricular (DVA) utilizado rotineiramente. Com estes dispositivos, o coração biológico que já não está a funcionar é deixado no lugar (Fig. 2). Uma bomba suporta normalmente o ventrículo esquerdo. No entanto, o ventrículo direito ainda deve ser suficientemente forte para isso. A distinção entre coração artificial total e bomba de assistência cardíaca é importante, ainda que ambos os conceitos sejam popularmente chamados “coração artificial”.
Jarvik-7: o primeiro coração artificial permanente
No início da história está o coração artificial total. Pouco depois do primeiro transplante cardíaco, o primeiro implante cardíaco artificial é realizado pelo cirurgião americano Denton Cooley no Texas Heart Institute em Houston, a 4 de Abril de 1969. O paciente de 47 anos de idade recebeu um coração artificial desenvolvido por Domingo Liotta, que foi substituído por um coração natural após 65 horas. Pouco depois do transplante cardíaco, o paciente morreu em resultado da rejeição do tecido imunológico.

O primeiro implante cardíaco permanente é considerado o Jarvik-7 (Fig. 3) por Robert Jarvik, que foi inserido a 2 de Dezembro de 1982 numa operação de sete horas em Utah por William DeVries no dentista Barney Clark, reformado. Clark sobreviveu 112 dias e sofreu várias tromboses antes de morrer. A 25 de Novembro de 1984, o americano William J. Schroeder foi também implantado com um Jarvik-7. Sobreviveu 620 dias e morreu de um derrame em 6 de Agosto de 1986. Após várias modificações, o coração Jarvik é agora utilizado sob o nome de CardioWest, principalmente nos EUA. Até agora, mais de 1250 corações Cardio-Oeste foram implantados. O sistema é composto por duas câmaras de coração artificial mecânicas de accionamento pneumático e separáveis e duas válvulas mecânicas cada uma. O sistema foi aprovado pela FDA em 2004 como o primeiro e até agora único coração artificial para ponte temporária (até ao transplante) e em 2012 como um coração artificial permanente.
Desde o coração artificial ao DVA
Na Europa, o cirurgião cardíaco Emil Bücherl também trabalhou num coração artificial em Berlim a partir dos anos 60. Após experiências com animais, a primeira implantação deste sistema de Berlim teve lugar em 1986 num paciente que, no entanto, estava extremamente doente – sem sucesso. Apenas um ano mais tarde, o tempo até um transplante de coração poder ser ligado com sucesso a outro paciente.
De um ponto de vista técnico, o “coração artificial Bücherl” foi concebido de forma semelhante ao coração artificial Cardio-Oeste. No entanto, o seu desenvolvimento futuro não foi prosseguido porque o conceito de “coração artificial total” foi abandonado em Berlim a favor do apoio cardíaco por meio do DVA. As bombas de apoio mais flexíveis e mais pequenas proporcionariam as mesmas, se não melhores, taxas de sucesso clínico. De acordo com os responsáveis, a possibilidade de um “apoio biológico” pelo coração permanecer no corpo seria também vantajosa, o que é naturalmente impossível com corações artificiais totais. Uma recuperação do coração ainda seria possível desta forma.
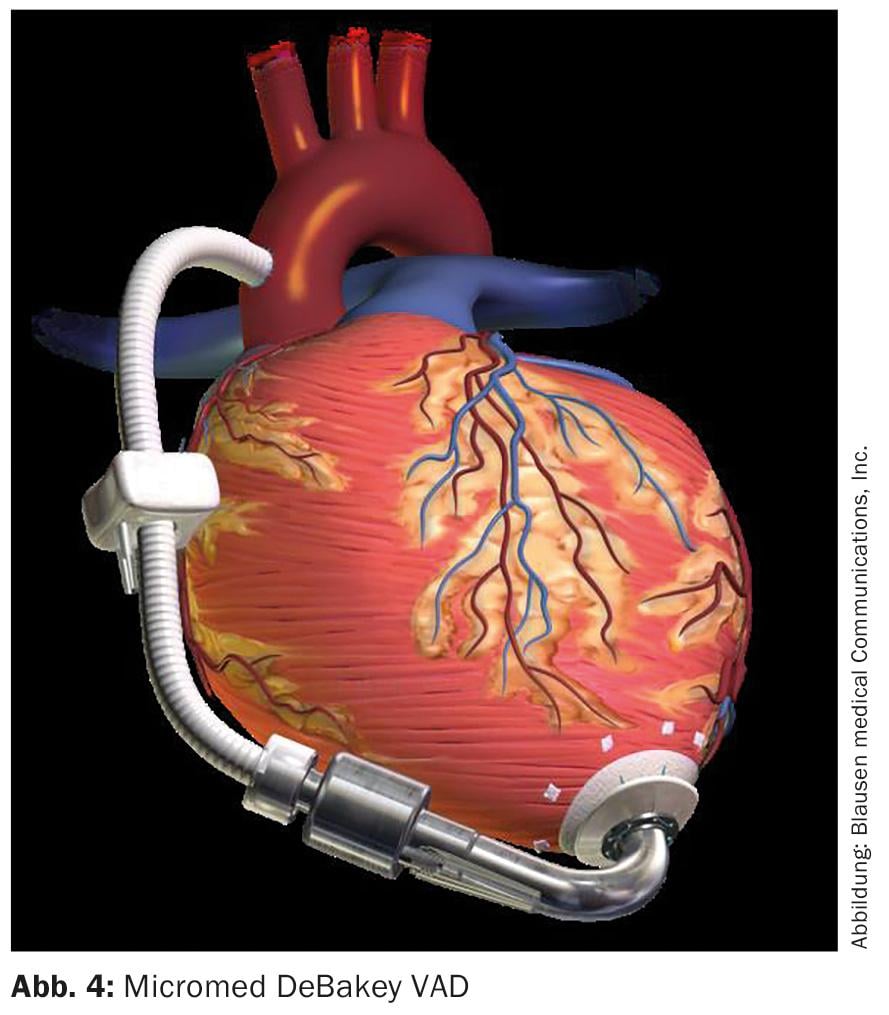
A primeira implantação mundial de um sistema VAD axial não pulsátil no Centro Alemão do Coração em Berlim, a 13 de Novembro de 1998, pode ser vista como um avanço no moderno suporte cardíaco mecânico. O “Micromed DeBakey VAD” (Fig. 4), o resultado de uma colaboração entre Michael DeBakey e a NASA, abriu o caminho para um conceito completamente novo no apoio cardíaco. Tornou possível uma redução da mortalidade e morbilidade que anteriormente parecia impossível, bem como uma miniaturização dos sistemas. Estes poderiam estar ligados directamente ao ápice cardíaco do ventrículo esquerdo e encontrar espaço intratoracicamente no pericárdio. Um cabo transcutaneamente encaminhado permitiu o fornecimento de energia e o controlo através de uma útil unidade de controlo.
O sucesso clínico reflectiu-se principalmente na alta a longo prazo dos pacientes em casa. Vários sistemas VAD foram aprovados para terapia de destino, ou seja, como a solução final para o paciente – isto em contraste com a terapia ponte-transplante como uma medida de ponte até que um órgão adequado seja obtido.
Sistemas VAD modernos: totalmente implantáveis
A substituição completa da função cardíaca foi historicamente no início dos conceitos de substituição de órgãos, mas a TAH não se apercebeu devido a dificuldades técnicas. Os DVA anteriores eram extracorpóreos devido apenas ao seu tamanho e, portanto, tinham uma taxa de complicações aumentada devido às cânulas percutâneas. A terapia VAD da chamada segunda e terceira geração é realizada exclusivamente por meio de agregados que geram um fluxo contínuo (não pulsáteis) e são totalmente implantáveis, excepto no caso do cabo de controlo.
Outro passo foi a miniaturização dos sistemas. As bombas centrífugas actuais são impulsores electromagnéticos e hidrodinâmicos combinados que atingem taxas de fluxo até 8-10 l/min, dependendo das cargas a montante e a jusante. Estas bombas podem também produzir alguma pulsatilidade, que deve proteger contra complicações hemorrágicas e fugas de válvulas, especialmente durante períodos muito longos de apoio. Os principais representantes são o sistema HeartWare® e agora também o Thoratec HeartMate® III (Fig. 5).

Na maioria dos pacientes, o dispositivo de assistência ventricular esquerda (LVAD) sozinho é suficiente. Contudo, devido à miniaturização progressiva do sistema, a implantabilidade completa é agora também possível sem qualquer problema no caso do apoio biventricular.
Resultados do transplante de coração
Se olharmos para a epidemiologia, tempos de espera nas listas de transplantes e fornecimento de órgãos, vemos que no futuro apenas um grupo muito circunscrito de pessoas poderá receber um transplante de coração. Como os resultados dos transplantes sofrerão com a proporção de pacientes em estado de alta urgência, coloca-se a questão de até que ponto nos próximos anos a actual e próxima geração de sistemas de apoio irá competir com os transplantes. Uma sobrevida de 1 ano de mais de 80% dos pacientes após o transplante cardíaco é considerado o objectivo mínimo a alcançar, o que tem sido consistentemente alcançado nas estatísticas internacionais nos últimos anos [2]. Deve salientar-se aqui que as estatísticas dos EUA – com uma grande reserva de doadores e curtos tempos de espera – têm uma influência positiva significativa nos resultados. Olhando para os dados alemães, por outro lado, verifica-se uma deterioração assustadora dos resultados, com menos de 80% a sobreviver no primeiro ano após o transplante. Esta deterioração deve-se, por um lado, ao estado geral mais pobre dos pacientes (proporção desproporcionadamente elevada em estado de alta urgência) e, por outro lado, à percentagem crescente de corações de doadores mais velhos e em parte já não completamente danificados.
Os resultados dos transplantes suíços estão mesmo no limite “mágico” de 80% e, portanto, também começam a ficar atrás da comparação internacional [3]. Temos de nos perguntar como e com o que podemos travar esta tendência. Como é que os pacientes com corações artificiais modernos de terceira geração se comparam com os transplantes cardíacos? Aqui é útil destacar resultados a longo prazo, mas também resultados impressionantes a curto prazo.
VAD: taxa de sobrevivência de mais de 80%
Em pacientes com corações artificiais de primeira e segunda geração, o trauma cirúrgico, incluindo complicações hemorrágicas, resultou numa morbilidade e mortalidade bastante elevadas. Estudos actuais mostram que a implantação está agora livre de problemas, pelo menos com dispositivos de terceira geração. O ensaio de registo do HeartMate® III, recentemente concluído, pode ser citado como exemplo: Dos 50 pacientes que receberam este coração artificial de última geração como terapia de transição ou de destino, 92% sobreviveram aos primeiros seis meses. Isto deve-se em parte às opções de implante minimamente invasivas através de uma toracotomia anterolateral com esternotomia parcial, o que pode reduzir extremamente o trauma cirúrgico.
Os resultados de 1, 3 e 5 anos com sistemas da segunda e terceira geração mais nova são também promissores. Mais de 80% dos doentes estão vivos após um ano, 75% após três anos e 61% após cinco anos. Para poder falar de competitividade real, é sobretudo as actuais gerações de aparelhos que terão de ser medidas em relação à sobrevivência a longo prazo, uma vez que estes pacientes pertencem naturalmente aos mais velhos e doentes já devido à sua exclusão do transplante cardíaco [5,6].
Novos objectivos: melhores baterias, funcionamento sem fios
Com a última geração de corações artificiais, foi atingido um nível de implantabilidade que dificilmente pode ser ultrapassado. Está planeada uma maior miniaturização, mas também é vista de forma crítica. A geração actual (Fig. 6) é certamente pequena e sedutora. No entanto, devido a velocidades de rotação extremamente elevadas e complexidade técnica, estes dispositivos comportam também um risco de maior susceptibilidade a erros na utilização a longo prazo – uma área onde se tornará claro se a terapia cardíaca artificial moderna pode tornar-se uma alternativa ao padrão de ouro do transplante cardíaco. As principais áreas a melhorar são o desenvolvimento das baterias para aumentar a autonomia do paciente e a eliminação do cabo de transmissão como uma fonte significativa de infecção. Aqui, a transmissão de dados e energia sem fios é um objectivo importante.
Literatura:
- McMurray J, et al: ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. Eur Heart J 2012; 33: 1787-1847.
- ISHLT Transplant Registry Quarterly Reports for Heart: Survival Rates for Transplants performed between April 1, 2010 and March 31, 2014, based on UNOS/ISHLT data as of March 27, 2015.
- Relatório Anual do Estudo de Coorte Suíço de Transplantes (Maio 2008- Dez 2012), Agosto 2013.
- Netuka I, et al: Sistema de Assistência Ventricular Esquerda Totalmente Levitado Magneticamente para o Tratamento da IC Avançada: Um Estudo Multicêntrico. Am Coll Cardiol 2015 Dez; 66(23): 2579-2589.
- Takeda K, et al: Resultado a longo prazo de pacientes com suporte de dispositivo de assistência ventricular esquerda de fluxo contínuo. J Thorac Cardiovasc Surg 2014; 148: 1606-1614.
- Sabashnikov A, et al: Resultados após a implantação de 139 dispositivos de assistência ventricular esquerda de fluxo contínuo completo como ponte para o transplante. Eur J Cardiothorac Surg 2014; 46: e59-66.
CARDIOVASC 2016; 15(3): 19-21