A utilização de testes multigene está actualmente limitada à situação adjuvante no carcinoma luminal mamário negativo HER2 e permite previsões reprodutíveis do risco de recorrência. Os testes conduzirão a menos quimioterapias num futuro previsível. No entanto, as quimioterapias adjuvantes desnecessárias já podem ser evitadas com a aplicação consistente dos actuais critérios de St. Gallen ou directrizes da OMPE. Estudos prospectivos envolvendo o OncotypeDX e a MammaPrint estarão disponíveis nos próximos anos, mas não testam estes métodos contra as ferramentas anteriores como desejado. Os métodos de ensaio moleculares devem ser utilizados para a aprovação ou a assunção de custos estar sujeita aos mesmos critérios e reivindicações que os medicamentos. A cobertura de custos pelas seguradoras de saúde obriga a uma aplicação crítica sem extrapolações para situações não testadas: Em mulheres com baixo risco ou contra-indicações claras para quimioterapia, deve ser dispensada.
Uma meta-análise baseada em dados de 6200 doentes com cancro da mama não pôde mostrar qualquer benefício de sobrevivência de quimioterapia adjuvante de alta dose com transplante autólogo de células estaminais [1]. No Inselspital, onze pacientes foram tratados desta forma de 1997 a 1999 como parte do estudo IBCSG-15-95. No editorial da meta-análise, é feita referência às actuais descobertas sobre biologia que levariam a tratamentos eficazes e menos arriscados. A frase final “Recordamos com gratidão as mulheres que voluntariamente se inscreveram nos ensaios clínicos que nos proporcionaram esses ganhos” mostra que a eficácia da quimioterapia foi sobrestimada e que desde então se verificou uma mudança de atitude. Na meta-análise, o ano de publicação é surpreendente: 2011. Isto porque os dados de cerca de 100.000 mulheres com cancro da mama mostram que a quimioterapia adjuvante reduz as recidivas em 8% em dez anos, a mortalidade por cancro da mama em 6,5% e a mortalidade global em 5% [2]. Na comparação directa aqui permitida, o tamoxifen é mais eficaz: o risco de recaída é reduzido em 13,2% durante 15 anos, a mortalidade por cancro da mama em 9,2% e a mortalidade global em 9,5%. Contudo, o maior efeito é reservado aos doentes com tumores sensíveis às hormonas [3].
Tipos de cancro da mama intrínseco e marcadores de substituição
Os perfis de expressão genética identificaram quatro grupos de carcinoma da mama com diferentes cursos clínicos e respostas terapêuticas (“subtipos intrínsecos”) há mais de dez anos:
- Receptor hormonal (HR) – tumores positivos com baixa agressividade (Luminal A)
- Tumores HR-positivos com maior agressividade (Luminal B)
- Tumores HER2-positivos (HER2+)
- Carcinomas HR e HER2-negativos com ou sem características de células basais (basal e normal, tri-negativo) [4].
Análises posteriores mostraram que os quatro grupos simplificam a realidade. O grupo mais heterogéneo é o tipo Luminal A com relativa resistência à quimioterapia [5,6]. É preciso esclarecer imediatamente que estes métodos utilizaram vários milhares de genes e não devem ser confundidos com os testes multigenes aqui discutidos. Uma vez que as primeiras não estão disponíveis em rotina, foram procuradas definições substitutivas (Tab. 1).

Os subtipos de carcinoma mamário intrínseco, baseados na determinação dos receptores de estrogénio (ER) e progesterona (PR), proliferação (Ki67) e HER2 (imunohistoquímica ou FISH), foram incluídos no Consenso de St Gallen a partir de 2011 [7]. Devido ao significado preditivo da resposta às terapias disponíveis (hormonas e quimioterapia, bem como terapias com HER2), estes subtipos formaram desde então a base para as recomendações de terapia adjuvante; anteriormente, estas recomendações tinham sido baseadas principalmente na avaliação do prognóstico com factores não biológicos (tamanho do tumor, número de gânglios linfáticos afectados).
O cerne da definição de substituto: carcinomas Luminal A e luminal B
Uma doente com cancro da mama quer saber se irá beneficiar ou não de uma determinada terapia. Em contraste com os carcinomas tri-negativos e a maior parte dos carcinomas HER2+, a questão em relação à quimioterapia no cancro da mama luminal é como identificar as pessoas afectadas que beneficiarão desta terapia – para além da terapia hormonal. A proliferação é um factor preditivo e é utilizada para distinguir entre carcinomas semelhantes aos luminais A e aos luminais B (Tab. 1) . No entanto, a proliferação é uma variável contínua, que requer um valor limiar para a aplicação clínica. Depois deste valor para definir o tipo Luminal B foi de 14% no Consenso de St Gallen de 2011 (ou seja, Ki67 >14% = Luminal B-like), foi aumentado para 20% em 2013 e para 20-30% em 2015 com 36% dos votos [6]. Na votação de 2015, 20% dos presentes abstiveram-se, e a mesma proporção do painel de peritos negou a Ki67 a justificação para esta distinção [6].
Apesar dos esforços internacionais, a determinação do Ki67 ainda não foi estandardizada. A reprodutibilidade não pôde ser melhorada, mesmo após discussões entre 15 patologistas suíços [8]. No entanto, foi alcançado um acordo muito bom na faixa baixa (<10%) e alta (>30%). Ki67 mancha as células nas fases G1, S, G2 e M do ciclo celular, o que para além dos aspectos técnicos (definição de positividade, selecção das fracções tumorais) pode explicar os resultados discrepantes. Apesar da promoção intensiva de testes comerciais multigenes e do engodo das técnicas modernas, são desejáveis mais estudos neste campo.
Os testes multigénicos não são comparáveis
Vários testes saltaram para esta lacuna com grande potencial de mercado. Têm sido mencionados no Consenso de St. Gallen desde 2011, e já foram incluídos em várias directrizes. Para uma visão geral, consultar o artigo de Patrizia Sager, MD (InFo ONKOLOGIE & HÄMATOLOGIE 2/2015). Em modelos multivariados, os testes quantificam a positividade e proliferação de RH.
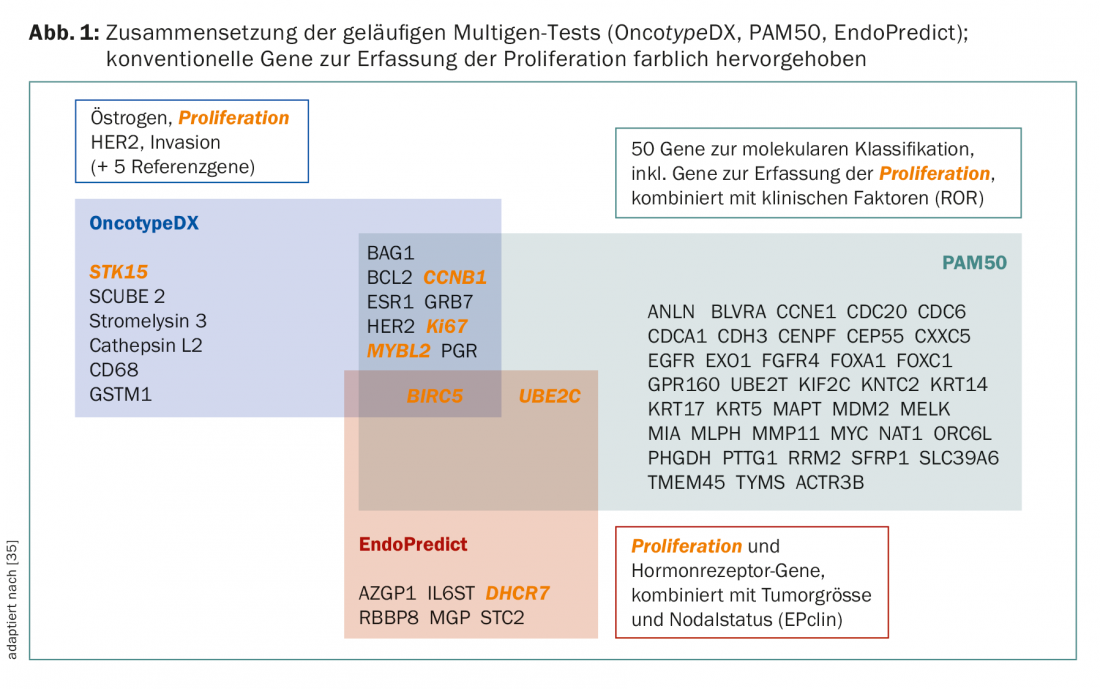
Mesmo que os testes prossigam o mesmo objectivo em princípio, ainda não são conceptualmente comparáveis. Existem diferenças nos conjuntos de genes e casos primários para desenvolvimento e validação (Fig. 1 e Tab. 2) . Por exemplo, o PAM50 inclui genes para os cancros ER+/- e reflecte tipos intrínsecos [9], enquanto o OncotypeDX foi compilado para prever o benefício da quimioterapia em cancros ER+ [10]. MammaPrint mede o risco de recidiva em pacientes não tratados [11,12]. Os factores clínicos influenciam o resultado final de PAM50 (como PAM50 ROR) e EndoPredict (como EPclin), diluindo o valor da “biologia”.
Consequentemente, os diferentes resultados em comparações directas (académicas!) de testes não são inesperados [13–15]. O risco detectado por um teste é também uma variável contínua, que provou ser um obstáculo na imuno-histoquímica.
Testes multigenes: prognóstico e/ou preditivo
Os marcadores prognósticos predizem o curso da doença, independentemente do tratamento. Os marcadores preditivos indicam se um tratamento será ou não bem sucedido. Alguns factores são prognósticos e preditivos; no caso do HER2, a disponibilidade de medicamentos específicos fez posteriormente desaparecer o valor prognóstico [16]. É geralmente aceite que os procedimentos para o carcinoma ER+/HER2- mama utilizam informação adicional como o tamanho do tumor e o grau de diferenciação para obter a probabilidade de recidiva. Os testes da primeira geração (OncotypeDX, Mammaprint, Genomic Grade Index) podem prever recaídas nos primeiros cinco anos. Os métodos mais recentes (PAM50, EndoPredict, Breast Cancer Index) têm melhor desempenho para prever a recorrência após cinco anos, o que é relevante devido às terapias hormonais mais longas [17–19]. Outras aplicações possíveis dos testes, além do tipo intrínseco, são a previsão da taxa de resposta na terapia neoadjuvante [20–22] e, com alternativas limitadas, a avaliação do risco em condições pré-cancerosas [23].
O OncotypeDX leva – na maioria dos estudos não controlados – a menos quimioterapias e faz com que actualmente os médicos assustados se sintam mais confiantes nas suas decisões [24,25]. A “psicologia” da possibilidade de utilizar o OncotypeDX na escolha de terapias adjuvantes fez parte do estudo SAKK 26/10; irá previsivelmente mostrar a grande influência do OncotypeDX nas decisões [25]. Recentemente, foi demonstrado que o teste PAM50 pode identificar pacientes nodal-positivos que não beneficiam de quimioterapia [26].
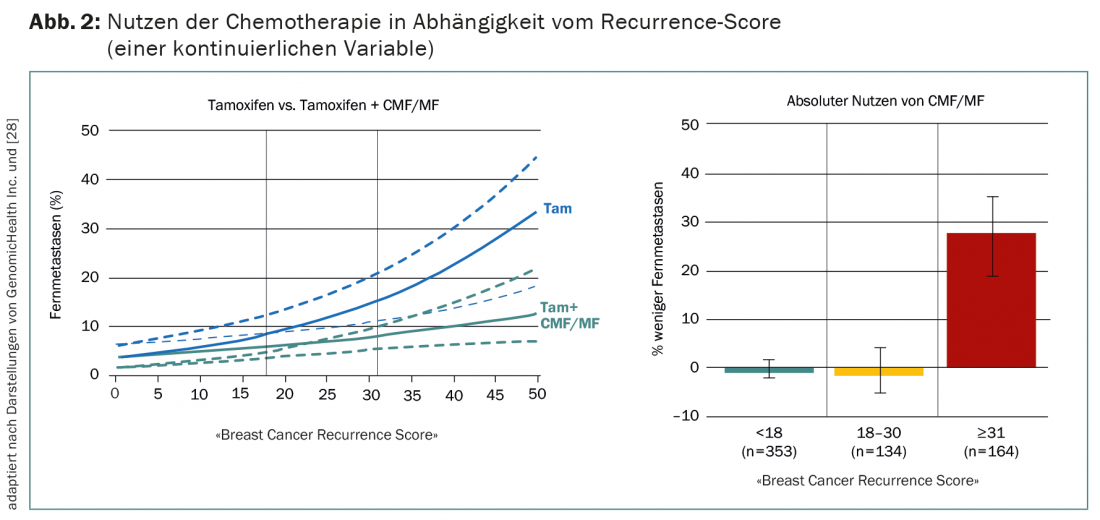
Actualmente, as provas mais convincentes de testes multigenes no cancro da mama provêm de uma análise em doentes com ER+ negativos. No ensaio NSABP B20, foram aleatorizados para receber tamoxifen com ou sem quimioterapia CMF/MF, que hoje em dia é raramente utilizada [27]. O OncotypeDX subsequente em 651 dos 2299 pacientes mostra que a quimioterapia só é benéfica para aqueles com uma elevada probabilidade de recorrência (pontuação de recorrência >30) (Fig. 2) [28]. Sensu stricto, isto não é, portanto, uma validação prospectiva, como é frequentemente afirmado.
Valor acrescentado dos testes multigénicos?
“Preciso de quimioterapia?” Com esta pergunta retórica, os testes comerciais anunciam, por exemplo, o seguinte estudo de caso no website: 1,8 cm de carcinoma ductal invasivo numa mulher pós-menopausa, N0, G2, ER 90%, PR 40%, Ki67 15%. A probabilidade de recaída, expressa como uma pontuação de recorrência, é baixa aos 13, e o benefício adicional da quimioterapia é mínimo [28]. Usando os actuais critérios St. Gallen [6] ou as directrizes da OMPE [29], esta mulher não necessita de quimioterapia adjuvante para além de um inibidor de aromatase.
Estão actualmente em curso três grandes estudos prospectivos (Mindact, TailorX, RxPONDER) que testam aleatoriamente a terapia hormonal versus combinação com quimioterapia, dependendo do resultado do OncotypeDX ou MammaPrint (Fig. 3) .
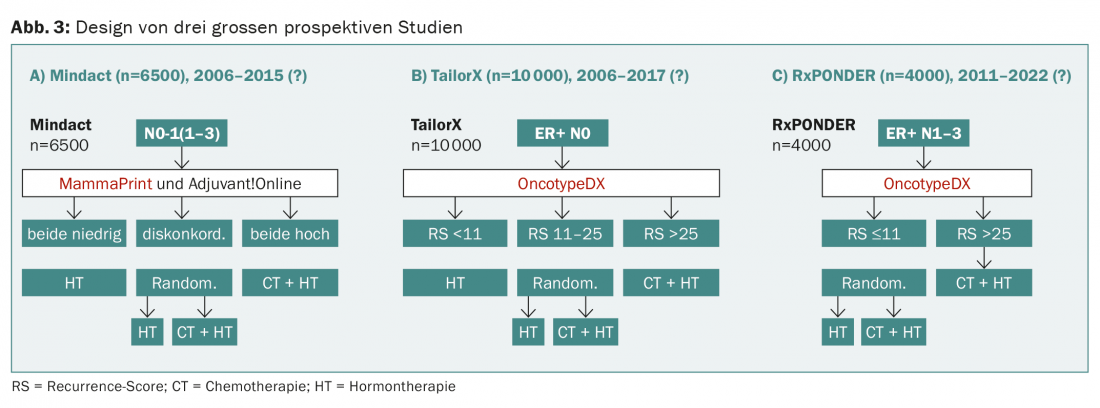
No estudo prospectivo do WSG-planB, são comparadas duas quimioterapias para uma pontuação de recorrência de >11, entre outras. O desenho do WSG-ADAPT é interessante: Postoperativamente, é seguida uma abordagem semelhante à do TailorX, mas a resposta a três semanas de terapia hormonal é também tida em conta. No entanto, em nenhum destes estudos é um dos testes “testados”, como seria exigido pelo desenho de estudo ideal e é habitual para drogas (Fig. 4).
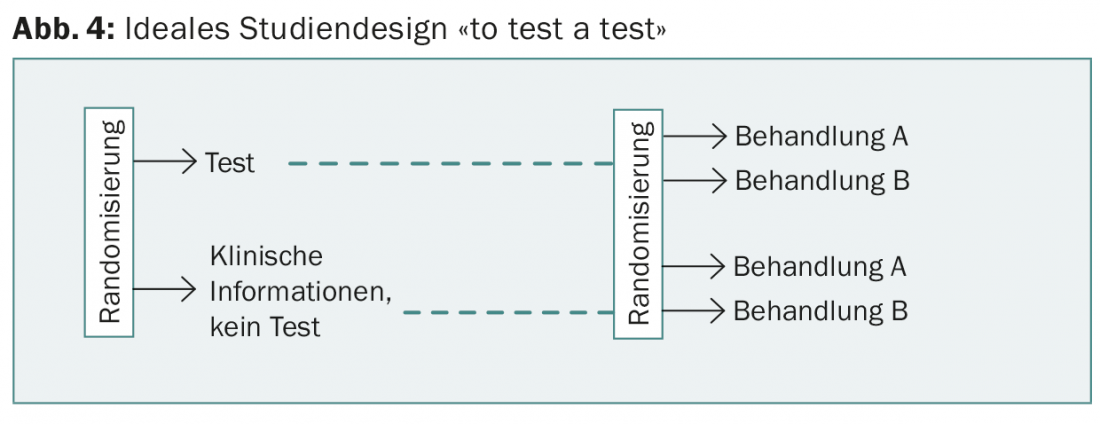
Contudo, isto seria necessário para demonstrar o valor acrescentado dos novos testes em comparação com a informação anterior (incluindo a melhor determinação possível do Ki67) e para justificar os custos adicionais. Estes últimos estão cobertos por seguros de saúde desde o início de 2015 e variam (Tab. 2). Nenhum teste até à data permite uma previsão sobre a escolha de quimioterapia específica.
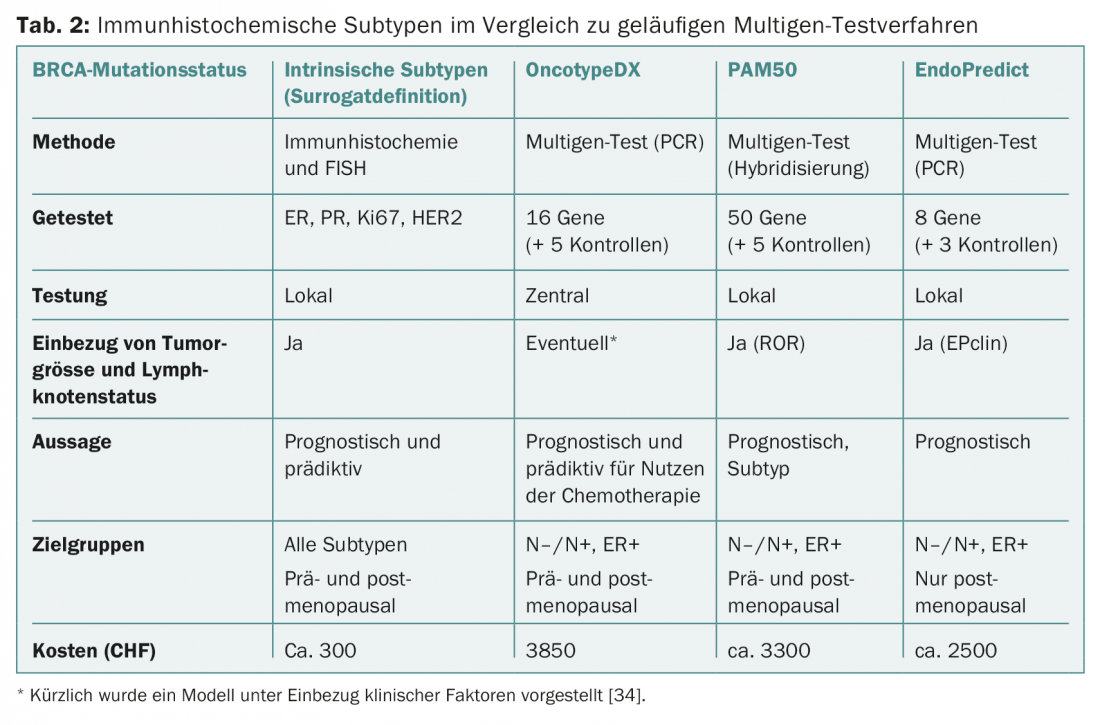
Os fornecedores concorrentes colocam-se, compreensivelmente, sob a melhor luz e lutam arduamente. Embora não confirmado, o website do fabricante do OncotypeDX, por exemplo, afirma que o teste também pode ajudar com o estatuto pouco claro do HER2 [30,31]. Isto explica porque é que os custos do Herceptin® foram incluídos em cálculos que certificam conclusivamente a relação custo-eficácia deste teste [32]. Como mostra a experiência com outros produtos concorrentes em oncologia, sem comparações pioneiras na Suíça, os vários produtos tornar-se-ão estabelecidos na vida quotidiana e conduzirão a um puzzle federal também aqui.
Desde que a reprodutibilidade não seja comprometida, os testes locais são vantajosos porque a consulta entre os clínicos e a patologia é possível. Isto é demonstrado pelo caso de uma paciente com carcinoma mamário multifocal que foi incluída no estudo SAKK 26/10 no Inselspital. A proliferação dos carcinomas de três a 1 cm, determinada com Ki67, foi de 19%, 27% e 53%. A pontuação de recorrência OncotypeDX determinada na longínqua Califórnia foi dada como 13%, o que não podia ser questionado em termos de representatividade. Além disso, no espírito da medicina baseada em provas, não são permitidas extrapolações para populações não testadas, por exemplo, a utilização do EndoPredict em mulheres na pré-menopausa.
Adenda: Os primeiros resultados do estudo TailorX [33], publicado após a apresentação deste manuscrito, permanecem conceptualmente sem influência sobre as declarações feitas.
Literatura:
- Berry DA, et al: Quimioterapia de alta dose com suporte de células estaminais autólogas como terapia adjuvante no cancro da mama: visão geral de 15 ensaios aleatórios. J Clin Oncol 2011; 29: 3214-3223.
- Peto R, et al: Comparações entre diferentes regimes de poliquimioterapia para o cancro da mama precoce: meta-análises de resultados a longo prazo entre 100.000 mulheres em 123 ensaios aleatorizados. Lanceta 2012; 379: 432-444.
- Davies C, et al: Relevância dos receptores hormonais do cancro da mama e outros factores para a eficácia do tamoxifeno adjuvante: meta-análise ao nível do paciente de ensaios aleatorizados. Lancet 2011; 378: 771-784.
- Sotiriou C, et al: Classificação e prognóstico do cancro da mama com base nos perfis de expressão genética de um estudo baseado na população. Proc Natl Acad Sci USA 2003; 100: 10393-10398.
- Ciriello G, et al: A diversidade molecular dos tumores mamários Luminal A. Res Res Res ao Cancro da Mama 2013; 141: 409-420.
- Coates AS, et al: Tailoring therapies-improving the management of early breast cancer: St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. Ann Oncol 2015; 26: 1533-1546.
- Goldhirsch A, et al: Strategies for subtypes – dealing with the diversity of breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Ann Oncol 2011; 22: 1736-1747.
- Varga Z, et al: Quão fiável é a imuno-histoquímica Ki-67 em carcinomas mamários de grau 2? Um estudo de QA do Grupo de Trabalho Suíço de Mama e Ginecopatologistas. PLoS One 2012; 7: e37379.
- Parker JS, et al: Supervisor de previsão de risco de cancro da mama baseado em subtipos intrínsecos. J Clin Oncol 2009; 27: 1160-1167.
- Paik S, et al: Um ensaio multigene para prever a recorrência do cancro da mama tratado com tamoxifeno, node-negativo. N Engl J Med 2004; 351: 2817-2826.
- van de Vijver MJ, et al: Uma assinatura de expressão de género como um preditor de sobrevivência no cancro da mama. N Engl J Med 2002; 347: 1999-2009.
- van ‘t Veer LJ, et al: Gene expression profiling prediz o resultado clínico do cancro da mama. Natureza 2002; 415: 530-536.
- Dowsett M, et al: Comparação da pontuação de risco de recorrência PAM50 com o oncótipo DX e IHC4 para prever o risco de recorrência à distância após terapia endócrina. J Clin Oncol 2013; 31: 2783-2790.
- Fan C, et al: Concordância entre os preditores baseados na expressão genética para o cancro da mama. N Engl J Med 2006; 355: 560-569.
- Varga Z, et al: Comparação dos resultados dos testes EndoPredict e Oncotype DX no receptor hormonal cancro da mama invasivo positivo. PLoS One 2013; 8: e58483.
- Buyse M, et al: Integração de biomarcadores em ensaios clínicos. Perito Rev Mol Diagnóstico 2011; 11: 171-182.
- Goss PE, et al: Um ensaio aleatório de letrozol em mulheres na pós-menopausa após cinco anos de terapia com tamoxifen para o cancro da mama em fase inicial. N Engl J Med 2003; 349: 1793-1802.
- Davies C, et al: Efeitos a longo prazo da continuação do tamoxifeno adjuvante a 10 anos versus paragem aos 5 anos após o diagnóstico de cancro da mama receptor de estrogénio positivo: ATLAS, um ensaio aleatório. Lancet 2013; 381: 805-816.
- Bianchini G, et al: Proliferação e sinalização de estrogénio podem distinguir pacientes em risco de recidiva precoce versus tardia entre os cancros mamários receptores de estrogénio positivos. Breast Cancer Res 2013; 15: R86.
- Pivot X, et al: Na era da genómica, o tamanho do tumor deve ser reconsiderado como critério para a quimioterapia neoadjuvante? Oncologista 2015; 20: 344-350.
- Gluck S, et al: A subtilografia molecular do cancro da mama em fase inicial identifica um grupo de pacientes que não beneficiam de quimioterapia neoadjuvante. Res Res Res ao Cancro da Mama 2013; 139: 759-767.
- Esserman LJ, et al: A resposta da quimioterapia e a sobrevivência sem recorrência no cancro da mama neoadjuvante depende de perfis biomarcadores: resultados do I-SPY 1 TRIAL (CALGB 150007/150012; ACRIN 6657). Tratamento de Res Resistência ao Cancro da Mama 2012; 132: 1049-1062.
- Rakovitch E, et al: Um estudo de validação baseado na população do DCIS Score prevendo o risco de recorrência em indivíduos tratados apenas por cirurgia de conservação dos seios. Tratamento do Res Res do Cancro da Mama 2015; 152: 389-398.
- Eiermann W, et al: O ensaio de pontuação de recorrência de 21 genes tem impacto nas recomendações terapêuticas adjuvantes para o cancro de mama precoce com ER-positivo, nodo-negativo e nodo-positivo, resultando numa mudança adaptada ao risco na utilização da quimioterapia. Ann Oncol 2013; 24: 618-624.
- Augustovski F, et al: Impacto da tomada de decisões sobre a alocação de quimioterapia adjuvante no cancro da mama negativo precoce com um ensaio de 21 genes: revisão sistemática e meta-análise. Tratamento do Res Res do Cancro da Mama 2015; 152: 611-625.
- Gnant M, et al: Identificação de subgrupos prognósticos clinicamente relevantes de mulheres na pós-menopausa com receptor de hormona nodo-positivo cancro da mama em fase inicial tratado com terapia endócrina: uma análise combinada de ABCSG-8 e ATAC usando o escore de risco de recorrência PAM50 e subtipo intrínseco. Ann Oncol 2015; 26: 1685-1691.
- Fisher B, et al: Tamoxifen e quimioterapia para nódulos linfáticos negativos, receptor de estrogénio – cancro da mama positivo. J Natl Cancer Inst 1997; 89: 1673-1682.
- Paik S, et al: Expressão genética e benefício da quimioterapia em mulheres com cancro da mama com receptor estrogénico negativo, estrogénico positivo. J Clin Oncol 2006; 24: 3726-3734.
- Senkus E, et al: Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-updagger. Ann Oncol 2015; 26 Suppl 5: v8-v30.
- Dabbs DJ, et al: Elevada taxa de falsos negativos de HER2 transcrição reversa quantitativa da reacção em cadeia da polimerase de transcrição inversa do teste Oncotype DX: um estudo independente de garantia de qualidade. J Clin Oncol 2011; 29: 4279-4285.
- Bhargava R, Dabbs DJ: Teste Oncotype DX em casos inequivocamente HER2-positivos: potencial de danos. J Clin Oncol 2012; 30: 570-571.
- Holt S, et al: Um impacto de decisão, conflito de decisão e avaliação económica do teste de rotina do Oncótipo DX de 146 mulheres com cancro da mama com aceno negativo ou pNImi, ER-positivo no Reino Unido. Br J Cancer 2013; 108: 2250-2258.
- Sparano JA, et al: Prospective Validation of a 21-Gene Expression Assay in Breast Cancer (Validação Prospectiva de um Ensaio de Expressão de 21 Genes no Cancro da Mama). N Engl J Med 2015 Nov 19; 373(21): 2005-2014.
- Klein ME, et al: Prediction of the Oncotype DX recurrence score: utilização de equações geradas por patologia derivadas pela análise de regressão linear. Mod Pathol 2013; 26: 658-664.
- Denkert C, et al.: [Patologia molecular do cancro da mama: Importância do perfil de expressão do gene]. Patologista 2015; 36: 145-153.
InFo ONCOLOGy & HEMATOLOGy 2016; 4(1): 10-14