As imunoterapias orientadas podem ser utilizadas para a artrite psoriásica (PsA), psoríase (PsO) e dermatite atópica (AD).1-3 Dados actuais sobre estas opções de tratamento de última geração foram apresentados no Congresso anual da Academia Americana de Dermatologia (AAD) 2022 em Boston, Massachusetts, EUA.
As pessoas com doenças inflamatórias crónicas da pele sofrem frequentemente não só dos sintomas físicos e comorbilidades da sua doença, mas também do stress psicológico associado. Em geral, isto vai de mãos dadas com uma qualidade de vida gravemente reduzida.4, 5 As opções de tratamento para dermatoses inflamatórias, que mostram grande heterogeneidade no curso e severidade, têm-se limitado há muito tempo aos corticosteróides tópicos (TCS) e imunossupressão não específica.1 No entanto, os avanços na compreensão da fisiopatologia levaram ao desenvolvimento de inibidores biológicos e de Janus kinase (JAKi) nos últimos anos, que permitem uma imunoterapia orientada.1-3
Risankizumab em PsA: análises dos estudos da fase III do KEEPsAKE
O inibidor selectivo IL-23 risankizumab (RZB; SKYRIZI®) foi aprovado na Suíça desde Março de 2022 como monoterapia ou em combinação com drogas anti-reumáticas modificadoras de doenças não-biológicas (csDMARD) para pacientes adultos com PsA que tiveram uma resposta inadequada ou são intolerantes a um ou mais DMARD.2 Os estudos pivotais aleatórios, duplo-cegos e placebo (PBO)-controlados de fase III KEEPsAKE-1 e KEEPsAKE-2 investigaram a eficácia e tolerabilidade da biologia em doentes adultos com PsA que receberam doses subcutâneas de 150 mg de RZB nas semanas 0, 4 e 16. Enquanto KEEPsAKE-1 incluía apenas pacientes que tinham respondido inadequadamente a ≥ 1 csDMARD, KEEPsAKE-2 incluía também pacientes com uma resposta inadequada a ≤ 2 DMARDs biológicos (bDMARDs).
No KEEPsAKE-1, 57,3% dos pacientes no RZB e 33,5% dos pacientes no PBO (p<0,001) alcançaram o ponto final do estudo primário de pelo menos 20% de melhoria de acordo com os critérios do American College of Rheumatology (ACR 20) às 24 semanas. No KEEPsAKE-2, isto foi alcançado por 51,3% dos pacientes do grupo RZB e 26,5% dos pacientes do braço PBO (p<0,001). Em ambos os estudos, menos de 1% dos pacientes com RZB desenvolveram efeitos secundários que levaram à descontinuação do tratamento.6, 7
No congresso da AAD deste ano, o efeito da terapia RZB em PsA sobre os Resultados de Pacientes Reportados(PROs) foi examinado com mais detalhe. Foram também apresentados inquéritos sobre adiferença mínima clinicamente importante ( MCID) alcançada com o tratamento.
- Melhoria da qualidade de vida, fadiga e produtividade do trabalho sob RZB 8
Os estudos KEEPsAKE-1 e KEEPsAKE-2 mediram PROs relacionados com a qualidade de vida relacionada com a saúde (HRQoL), fadiga e produtividade no trabalho. De acordo com uma análise conjunta, tanto a HRQoL como a fadiga melhoraram significativamente sob RZB em comparação com o grupo PBO nas primeiras 24 semanas de tratamento. Por exemplo, a diferença entre os grupos RZB e PBO em EQ-5D-5L* foi de 5,8 ([95% CI: 3,6-8,0]) e em FACIT-Fatigue a pontuação* foi de 2,5 ([95% KI:1.5-3.4]) (p<0,001 para todas as pontuações). Sob o RZB, os pacientes com WPAI-PsA* também mostraram menos deficiência no trabalho, limitações de actividade e presenteísmo do que sob PBO.8
- Os resultados comunicados pelos doentes também melhoraram nos doentes com envolvimento cutâneo grave 9
Os doentes de KEEPsAKE-1 e KEEPsAKE-2 que tiveram um envolvimento cutâneo grave com ≥ 3% de área de superfície cutânea afectada ou um Índice de Psoríase e Severidade (PASI) > 10 também conseguiram uma melhoria significativa na percepção da actividade da doença e da dor com o tratamento RZB em comparação com o PBO, de acordo com uma análise integrada de subgrupos dos dois ensaios. A melhoria da qualidade de vida após 24 semanas em comparação com a linha de base, medida como SF-36 (PCS* 6.3 [95% KI:4.2-8.4] & MCS* 4,4 [95% CI: 2,3-6,6; p<0,001]), índice EQ-5D-5L (0,1 [95% CI: 0,1-0,2; p<0,001]) e pontuação VAS* (8,2 [95% CI: 2,5-13,9; p<0,01]), foi também significativamente mais elevado sob tratamento RZB do que sob PBO.9
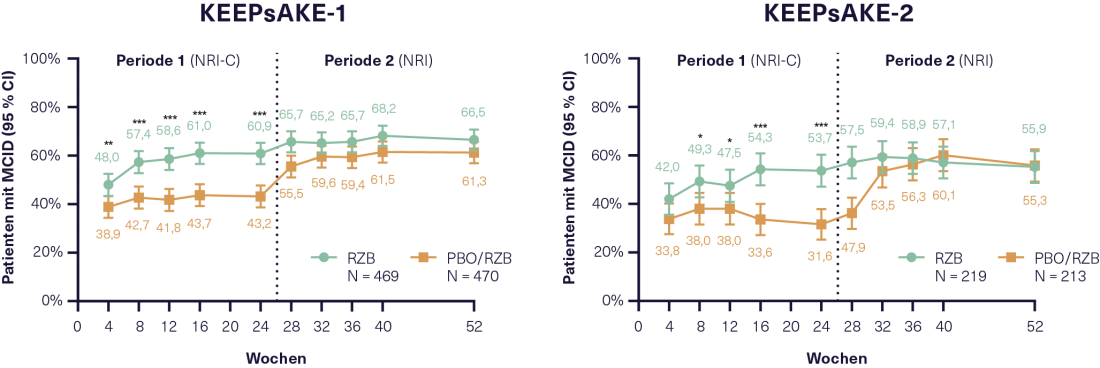
- Alívio da dor e inflamação com RZB 10, 11
A eficácia do RZB na inflamação e dor em PsA foi também um foco no Congresso da AAD. Em 1407 pacientes PsA que completaram 24 semanas de tratamento em KEEPsAKE-1 e KEEPsAKE-2 e participaram no estudo subsequente de extensão do rótulo aberto, foi medida a diminuição da proteína C-reactiva (CRP). Isto sugere uma melhoria na inflamação sob RZB, que também ocorreu em pacientes do grupo PBO, uma vez que mudaram para o tratamento RZB no estudo de extensão do rótulo aberto. A dor nas últimas 24 horas foi medida numa escala horizontal de 100 mm de VAS*. Em ambos os ensaios, o dobro dos pacientes alcançou 30% (“significativo”), 50% (“marcado”) e 70% de alívio da dor a partir da linha de base no RZB como no PBO às 24 semanas. Uma redução da dor de ≥ 10 mm foi classificada como MCID. Isto foi conseguido em KEEPsAKE-1 por 60,9% e em KEEPsAKE-2 por 53,7% dos pacientes sob RZB em comparação com 43,2% e 31,6% dos pacientes sob PBO, respectivamente (p<0,001 em ambos os estudos)(Figura 1).10 Além disso, após 24 semanas, os pacientes em RZB tinham mais probabilidades de alcançar um MCID em termos de actividade da doença (PtGA*), fadiga (FACIT-F*), funcionamento físico (HAQ-DI*) e saúde física e mental (SF-36 PCS e MCS*) do que os pacientes em PBO.
Os dados apresentados no Congresso da AAD sublinham a eficácia clínica do RZB em doentes com PsA e ilustram que os pontos finais alcançados nos ensaios clínicos centrais KEEPsAKE-1 e KEEPsAKE-2 se traduzem directamente numa melhoria tangível na experiência relatada pelos doentes.11
Dados a longo prazo e do mundo real sobre o tratamento de riscoizumab em PsO
O RZB foi aprovado na Suíça desde Abril de 2019 para o tratamento da placa PsO moderada a grave em pacientes adultos que tiveram uma resposta inadequada a outras terapias sistémicas ou que têm uma contra-indicação ou intolerância a tais terapias.2 Nos ensaios aleatórios, duplo-cegos e controlados por placebo fase III UltIMMa-1 e UltIMMa-2, os pacientes que receberam uma injecção subcutânea de 150 mg RZB nas semanas 0, 4, 16, 28 e 40 mostraram uma melhor resposta do que os pacientes dos grupos PBO e ustekinumab. Assim, 74,6% dos pacientes sob RZB obtiveram uma resposta PASI 90. Com ustekinumab, 47,5% e com PBO 2% dos pacientes conseguiram isto (p<0,0001). O perfil de segurança do RZB era comparável aos perfis de segurança do ustekinumab e do PBO.12 Outros estudos frente a frente demonstraram a eficácia superior do RZB sobre o adalimumab (estudo IMMvent), secukinumab (estudo IMMerge) e ésteres do ácido fumárico (NCT03255382) em doentes com PsO moderada a severa.13-15 Dados actuais da extensão aberta destes estudos durante mais de 4,5 anos até à data, bem como resultados do mundo real, foram agora apresentados no Congresso da AAD.
- Estudo de extensão LIMMitless
O estudo de extensão LIMMitless em curso inscreveu 897 dos 955 pacientes que tinham completado um dos cinco estudos de base acima mencionados. Na altura da actual análise de 256 semanas, 707 pacientes ainda continuavam 12 semanas de tratamento com 150 mg de RZB. Isto conseguiu uma eficácia boa e sustentada ao longo de todo o período de observação. Assim, da semana 28 dos estudos de base até à semana 256, 83% dos pacientes no RZB mostraram uma resposta PASI 90 consistente e 52% mostraram uma resposta PASI 100 consistente(Figura 2). A elevada eficácia contínua do RZB reflecte-se também numa melhoria sustentada na HRQoL. Mais de 66% dos pacientes no RZB alcançaram um Índice de Qualidade de Vida em Dermatologia (DLQI) 0/1 logo 16 semanas após o início dos estudos de base, o que significa que tiveram pouca ou nenhuma redução na sua qualidade de vida devido à doença. Esta condição foi mantida por 75% dos pacientes durante o estudo LIMMitless. Não ocorreram novos sinais de segurança ou casos de infecção por Candida, doença inflamatória intestinal ou tuberculose activa sob RZB durante uma duração de exposição de 4453 pacientes-anos durante um período de observação de até 304 semanas. Globalmente, o tratamento provou ser bem tolerado.16
- Boa resposta ao RZB mesmo em condições do mundo real 17, 18
Que o RZB está também associado a uma boa resposta em PsO sob condições reais é evidente pela análise apresentada no Congresso da AAD de dados de 205 pacientes com PsO moderados a graves do Registo de Psoríase CorEvitas dos EUA/Canadianos que tinham recebido 150 mg RZB durante 12 meses (+/-3 meses). Os doentes tinham sofrido de PsO durante uma média de 16,7 anos, estavam na sua maioria muito acima do peso e em 61,0% dos casos tinham sido pré-tratados com biólogos e imunomoduladores. Após 12 meses, o tratamento RZB mostrou boa eficácia contra os objectivos de tratamento orientado para o doente definidos pela National Psoriasis Foundation (NPF)(Treat-to-Target Skin Clearance Goals). 89,2% dos doentes conseguiram uma resposta NPF aceitável, definida como 3% ou menos de superfície corporal afectada (BSA ≤ 3%), ou uma melhoria de BSA de 75% a partir da linha de base. 70,4% dos doentes com tratamento RZB atingiram a resposta ao objectivo da NPF da BSA ≤ 1%. A realização dos objectivos de tratamento definidos pela NPF foi independente do pré-tratamento: 94,8% e 85,5% dos pacientes com tratamento biológico inócuo e tratado biologicamente, respectivamente, alcançaram uma resposta NPF aceitável e 81,8% e 62,4%, respectivamente, alcançaram uma resposta alvo NPF.17
A maioria dos pacientes também conseguiu uma pele sem sintomas ou quase sem sintomas com terapia RZB contínua – PASI, Avaliação Global do Investigador (IGA) e BSA melhoraram 86,4%, 71,9% e 88,0% respectivamente em 12 meses (p<0,001 todos os valores). A melhoria das lesões cutâneas foi acompanhada por melhorias na fadiga, dor, prurido, qualidade de vida e limitação do trabalho/actividade. As pontuações de VAS* para fadiga e dor foram reduzidas em 38,0% e 75,1% respectivamente. A pontuação do EVA para a comichão diminuiu 69,9% (p<0,001 todos os valores). De acordo com o questionário da WPAI, os doentes relataram significativamente menos limitações no trabalho. Além disso, mais de dois terços dos pacientes (66,7%) obtiveram um DLQI 0/1 após 12 meses de terapia RZB.18
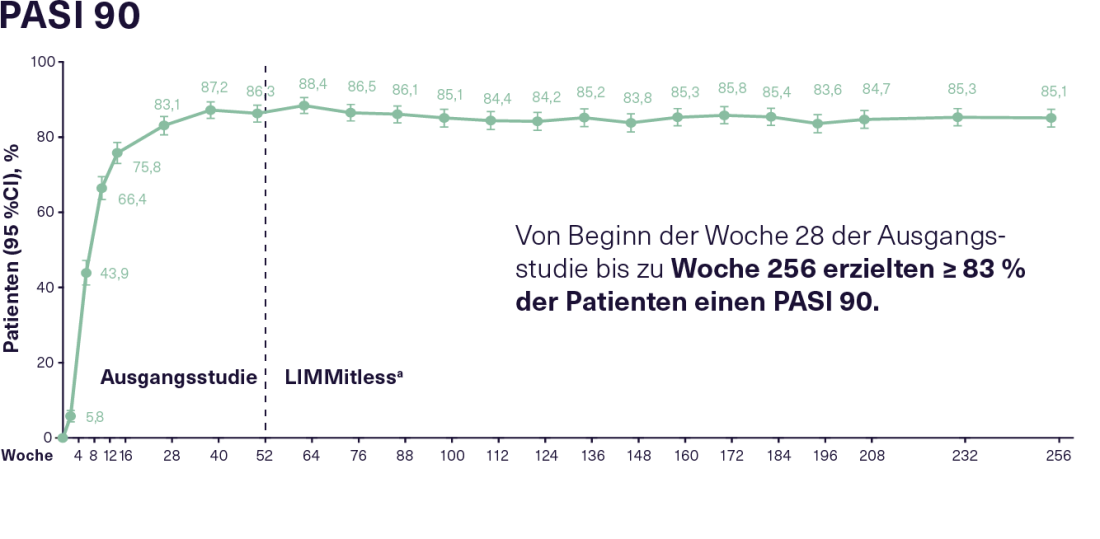
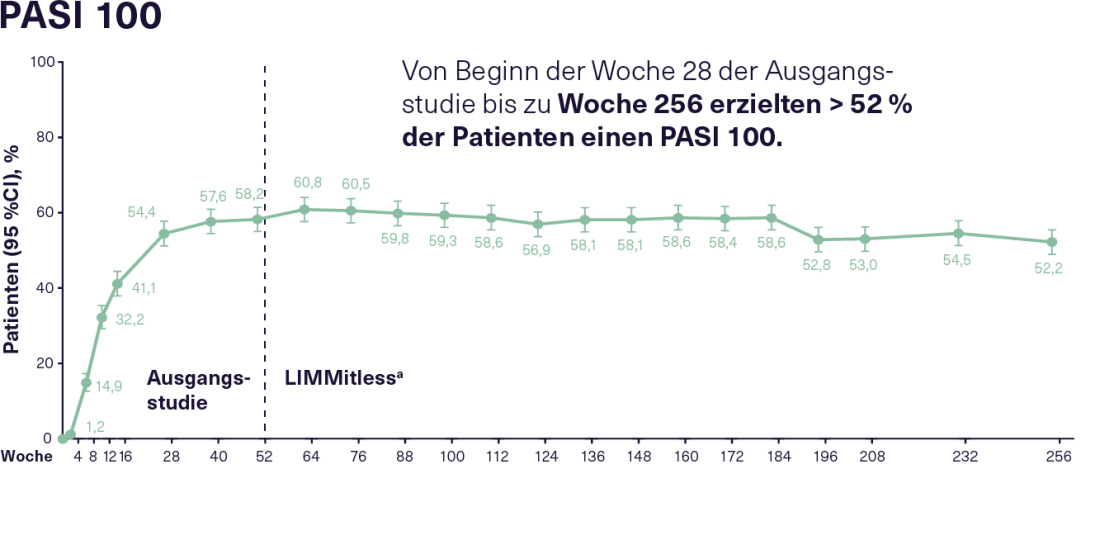 Figura 2: Resposta PASI 90 e PASI 100 em pacientes com PsO moderada a grave recebendo tratamento RZB contínuo durante um total de 256 semanas no estudo de extensão do rótulo aberto LIMMitless. N= 897 da semana 0 à semana 256 (mNRI, imputação de não-resposta modificada). RZB: 150 mg cada 12 semanas; PASI 90/100: 90/100% de melhoria na Área de Psoríase e Índice de Severidade; PsO: Psoríase. a Devido a diferenças na duração dos estudos de base, alguns pacientes passaram para o estudo LIMMitless mais cedo do que após 52 semanas. Adaptado após 16.
Figura 2: Resposta PASI 90 e PASI 100 em pacientes com PsO moderada a grave recebendo tratamento RZB contínuo durante um total de 256 semanas no estudo de extensão do rótulo aberto LIMMitless. N= 897 da semana 0 à semana 256 (mNRI, imputação de não-resposta modificada). RZB: 150 mg cada 12 semanas; PASI 90/100: 90/100% de melhoria na Área de Psoríase e Índice de Severidade; PsO: Psoríase. a Devido a diferenças na duração dos estudos de base, alguns pacientes passaram para o estudo LIMMitless mais cedo do que após 52 semanas. Adaptado após 16. |
Segurança a longo prazo do risankizumab em PsO e PsA19 O maior e mais longo registo de segurança do RZB até à data inclui 3197 pacientes com PsO e 1542 pacientes com PsA, num total de 9982,6 e 1594,9 pacientes-anos (PY), respectivamente. As taxas comparativamente baixas de eventos adversos ocorreram em ambos os grupos de doentes. A frequência dos eventos adversos relacionados com o tratamento foi de 158,3 e 160,8 casos por 100 PY nas populações PsO e PsA, respectivamente. Os acontecimentos adversos graves ocorreram 7,6 e 8,4 vezes em 100 PY, respectivamente, e os acontecimentos adversos que levaram à interrupção do estudo ocorreram 1,9 e 2,3 vezes em 100 PY, respectivamente. As taxas de infecções graves, malignidades e eventos cardiovasculares adversos graves (MACE) em doentes de PsO e PsA estavam dentro das taxas de referência para as respectivas populações. Os eventos adversos mais comuns em ambos os grupos foram infecções, especialmente nasofaringite com 14,5 e 7,9 casos em 100 PY, respectivamente, e infecções das vias respiratórias superiores com 7,8 e 5,6 casos em 100 PY, respectivamente.19 |
Actualizações sobre o upadacitinib em AD
O inibidor oral JAK upadacitinib (UPA; RINVOQ®) actua especificamente sobre JAK1 e muito menos sobre JAK2, JAK3 ou TYK2. O princípio activo foi indicado na dosagem oral 15 mg uma vez por dia desde Novembro de 2021 para o tratamento de adultos com AD moderada a grave quando a terapia com medicamentos tópicos convencionais não proporciona um controlo adequado da doença ou não poderia ser utilizada.3 Os estudos centrais, aleatórios, duplo-cegos e controlados por placebo fase III MEASURE Up-1 e MEASURE Up-2 investigaram a eficácia e tolerabilidade de 15 mg UPA uma vez por dia como monoterapia. Após 52 semanas, numa análise integrada dos dois ensaios, 80,6% dos doentes com 15 mg UPA mostraram uma resposta EASI* 75 e 62,0% mostraram uma resposta EASI 90.20 Além disso, foi observada uma resposta rápida à UPA – após apenas dois dias, um número significativamente maior de doentes relatou um alívio significativo da comichão com UPA do que com PBO.21 No Congresso da AAD, a análise dos dados MEASURE Up-1 e MEASURE Up-2 foi apresentada utilizando o conceito recentemente desenvolvido baseado em provas “treat-to-target”.
- O Conceito “Treat-to-Target 22
Utilizando o conceito treat-to-target, que integra melhorias em vários parâmetros AD relacionados com a aparência da pele, prurido e qualidade de vida23 , foi analisado um total de 1299 pacientes adultos AD de MEASURE Up-1 e MEASURE Up-2, incluindo uma pontuação EASI de > 7, um DLQI > 5 e uma comichão marcada (WP-NRS* > 4) tinha sintomas graves. A resposta inicial aceitável (redução PGIS-5* ≥ 1 em comparação com a resposta de base e uma resposta EASI 50, uma redução de 50% SCORAD* ou reduções na pontuação WP-NRS, DLQI ou POEM* por ≥3, ≥4 e ≥4 em comparação com a linha de base) e 6 meses de resposta óptima (valor absoluto PGIS-5 ≤ 2 e uma resposta EASI 75, uma redução de 75% no valor SCORAD ou valores absolutos WP-NRS, DLQI ou POEM de ≤4, ≤5 e ≤7, respectivamente) foram avaliados. 79,2% e 72,4% dos doentes com 15 mg de UPA atingiram o objectivo inicial de 3 meses de resposta aceitável na 2ª semana e na 16ª semana de tratamento, respectivamente. A resposta mais rigorosa de 6 meses foi também alcançada pela clara maioria dos doentes com UPA a 2 semanas e a taxas semelhantes a 16 semanas(Figura 4). A resposta rápida e sustentada ao tratamento UPA foi demonstrada em pormenor pelo facto de 95% dos doentes já terem atingido o critério ≥ 1 para a resposta-alvo aceitável de 3 meses após 2 semanas e cerca de 80% dos doentes já terem atingido o critério ≥ 1 para a resposta-alvo óptima de 6 meses (p<0,0001 em comparação com a PBO).22
Conclusão
Os pacientes podem beneficiar da boa eficácia e segurança das imunoterapias orientadas utilizadas em PsA, PsO e AD.2, 3 Isto é evidente nos resultados de estudos objectivos, mas também nos resultados de Patient Reported Outcomes e nos dados de análises do mundo real.
*A abreviaturas:
EQ-5D-5L = EuroQoL 5 dimensões medida
FACIT-Fatiga = Avaliação Funcional da Terapia da Doença Crónica – FACIT-Fatiga
WPAI-PsA = Produtividade do trabalho e diminuição da actividade – Questionário PsA
SF-36 = Inquérito de saúde de 36-Item Short-Form Health Survey
PCS/ MCS = Resumo da Componente Física/ Mental
VAS = Escala Analógica Visual
HAQ-DI = Questionário de Avaliação de Saúde – Índice de Deficiência
PtGA = Avaliação Global da Actividade do Doente
EASI = Eczema Area and Severity Index
WP-NRS = Pior Escala de Classificação Numérica de Pruritus
PGIS-5 = A impressão global de gravidade do paciente
SCORAD = Pontuação de Dermatite Atópica
POEM = Medida de Eczema Orientado para o Paciente
Literatura
As referências podem ser solicitadas por profissionais em medinfo.ch@abbvie.com.
Texto: Dr. sc. nat. Katja Becker
Este texto foi produzido com o apoio financeiro da AbbVie AG, Alte Steinhauserstrasse 14, 6330 Cham.
Contribuição online desde 21.07.2022
CH-SKZD-220096_06/2022