A depressão é comum em várias doenças cerebrais e representa um desafio de diagnóstico. Um aumento da prevalência, mecanismos etiopatogenéticos parcialmente específicos e diferentes respostas aos tratamentos antidepressivos são característicos do insulto cerebrovascular (AVC), doença de Parkinson, esclerose múltipla, epilepsia e doença de Alzheimer.
O artigo seguinte discute as várias doenças cerebrais em que a depressão ocorre com mais frequência.
Stroke
Cerca de um terço dos doentes desenvolvem a chamada depressão pós-acidente vascular cerebral (PSD) após um AVC [1, 2]. Afasia, anosognosia, alexitímia e perturbações cognitivas podem dificultar a exploração clínica e a utilização de escalas normalizadas de auto-relatos. Os comportamentos observáveis, tais como expressões faciais, tendência para chorar, pensamentos catastróficos, etc., são úteis para o diagnóstico [1]. O Quadro 1 dá uma visão geral dos factores de risco para PSD, tais como o grau de deficiência física, gravidade do AVC e deficiência cognitiva [1, 3].

Uma causa importante do PSD é o stress psicossocial causado pela perturbação da vida anterior e a deficiência resultante. Estudos sobre a questão de saber se as localizações específicas de enfarte levam a um risco acrescido de PSD são contraditórios [1, 3]. Os efeitos específicos da isquemia também são discutidos, embora os mecanismos subjacentes ainda não estejam claros. É discutida uma redução da monoaminas serotonina, norepinefrina e dopamina devido à isquemia [4]. Uma vez que a presença de depressão também aumenta o risco de um derrame posterior em cerca de 1,5 vezes, existe provavelmente uma relação bidireccional entre as duas doenças [3].
O PSD responde bem aos antidepressivos, embora a evidência actual ainda seja bastante fraca. O tratamento antidepressivo pode mesmo influenciar favoravelmente a reabilitação dos neurónios [4]. Os SSRIs são preferidos devido ao seu perfil de efeito secundário mais favorável. Os melhores dados estão disponíveis para a fluoxetina e o citalopram [3]. A situação actual do estudo fala bastante contra um tratamento preventivo antidepressivo frequentemente discutido após um AVC [3, 5]. Até agora, não foi possível encontrar provas da eficácia das psicoterapias.
Doença de Parkinson
Cerca de 35-40% dos doentes com doença de Parkinson desenvolvem sintomas depressivos no decurso da doença. Estes podem preceder o desenvolvimento de sintomas motores. As perturbações de ansiedade também ocorrem com mais frequência. Devido à sobreposição de sintomas tais como hipomimia, abrandamento motor, fadiga, distúrbios do sono e perda de peso, o diagnóstico é difícil e a utilização de escalas de sintomas clínicos tais como o Beck Depression Inventory (BDI) e a Hamilton Depression Scale (HAMD) é recomendada [6, 7].
As projecções reduzidas noradrenérgicas e serotonérgicas a partir do locus coeruleus e do núcleo do raphe podem desempenhar um papel na patogénese [8].
Existem poucos bons estudos sobre a eficácia dos antidepressivos. A eficácia dos tricíclicos (TCAs) é melhor estabelecida do que a dos SSRIs [6]. Contudo, devido ao aumento do risco de quedas devido à sedação, bem como aos efeitos anticolinérgicos e ao consequente risco de agravamento dos sintomas cognitivos mais tarde durante o tratamento, os IRSS devem ser preferidos e a utilização de TCAs deve ser cuidadosamente considerada [3, 7]. Um novo estudo duplo-cego controlado por placebo mostrou uma boa eficácia e tolerabilidade da paroxetina e da venlafaxina [9]. Embora os sintomas não motores respondam geralmente bastante mal aos agonistas da dopamina [8], o pramipexole mostrou bons efeitos na depressão ligeira a moderada [10]. Não existem dados suficientes sobre a eficácia da psicoterapia, mas existem provas de um efeito antidepressivo da terapia cognitiva comportamental (CBT) [3].
Esclerose Múltipla (EM)
Estima-se que a prevalência de perturbações depressivas ao longo da vida seja de até 50% nas pessoas com EM. Até um quarto das pessoas com EM desenvolvem pensamentos suicidas, sendo a depressão um importante preditor. O diagnóstico de depressão também é difícil na EM devido à sobreposição de sintomas tais como fadiga, distúrbios do sono, perturbações do apetite, e problemas de memória e concentração, e pode ser melhorado através de escalas auto-avaliáveis tais como o BDI [3, 11].
Um factor psicossocial é o stress causado pela doença incapacitante, pelo que não foi possível encontrar uma associação com o grau de incapacidade e a duração da doença. Pelo contrário, as estratégias de enfrentamento desempenham um papel, com um risco acrescido de enfrentamento centrado na emoção versus enfrentamento centrado na acção [11]. Assume-se que o dano cerebral global da doença leva a um aumento geral da vulnerabilidade dos sistemas emocionais. Há também provas de uma desregulação do eixo de stress entre o hipotálamo, a hipófise e o córtex adrenal (eixo HPA). Os estudos sobre a dependência de sintomas depressivos na distribuição das lesões dificilmente têm sido capazes de encontrar padrões consistentes até agora. Em contraste, foram encontradas associações entre depressão e maior volume de lesão frontal esquerda e atrofia cerebral regional temporal esquerda [3, 11].
A depressão pode ocorrer como um efeito secundário do tratamento medicamentoso com interferão beta. O principal factor de risco são os episódios depressivos antes do tratamento. Os sintomas depressivos respondem bem à terapia antidepressiva, pelo que o tratamento normalmente não tem de ser interrompido [12].
Ainda há poucas provas sobre o tratamento farmacológico [13], mas o uso de antidepressivos – mais propriamente SSRIs devido ao seu perfil de efeitos secundários mais favorável – é altamente recomendado [14]. A CBT com enfoque nas estratégias de sobrevivência e na redução do stress de atenção revelaram-se eficazes [11, 14].
Epilepsia
O risco de desenvolver depressão é cerca de 1,4 vezes maior na epilepsia, pelo que a taxa de prevalência é mais elevada em AVC, doença de Parkinson e esclerose múltipla. No entanto, o risco de suicídio é aumentado até 10 vezes na epilepsia, dependendo do estudo, o que significa que o reconhecimento e tratamento da depressão é importante na prevenção do suicídio [15, 16]. Antes ou depois de uma convulsão, pode ocorrer uma deterioração aguda do humor durante horas a dias, que deve ser distinguida da depressão clínica. [15].
Etiopatogenicamente, assume-se um modelo de diástese multifactorial, em que um estado de stress crónico é criado pela epilepsia. O desamparo aprendido e a imprevisibilidade das apreensões desempenham um papel como factores psicológicos [3, 15]. Estudos do eixo HPA mostraram que, tal como na depressão, também está desregulado na epilepsia – especialmente na epilepsia do lóbulo temporal [3, 17]. Além disso, a privação na primeira infância em modelos animais leva tanto a um aumento da prevalência de comportamento depressivo como a um aumento da epileptogénese. Alterações semelhantes podem também ser encontradas no metabolismo do glutamato e GABA em ambas as doenças em modelos animais [17].
Os SSRIs são eficazes, embora também aqui ainda haja muito poucos bons estudos controlados por placebo. Contudo, devido ao risco acrescido de suicídio em epilepsia com depressão comorbida, o uso de SSRIs é altamente recomendado [15]. Os programas de TBC específicos da epilepsia e a Terapia de Aceitação e Compromisso (ACT) também demonstraram ser eficazes, reduzindo mesmo a frequência das convulsões [3, 15].
Os medicamentos anti-epilépticos podem ter um efeito nos sintomas psiquiátricos, especialmente no humor (Tab. 2) . Topiramato, vigabatrina, levetiracetam, tiagabina e zonisamida tendem a ser associados a efeitos negativos, enquanto gabapentina, pregabalina, lacosanida, valproato, carbamazepina e lamotrigina são associados a efeitos positivos [18]. Em casos de depressão comorbida, recomenda-se a mudança para um anticonvulsivo estabilizador do humor com um efeito positivo, se possível [19].

Um aviso anterior da US Food and Drug Administration (FDA) relativamente a um possível aumento do risco de suicídio por terapia antiepiléptica foi entretanto qualificado devido a dados pouco convincentes [20].
Demência, especialmente a doença de Alzheimer
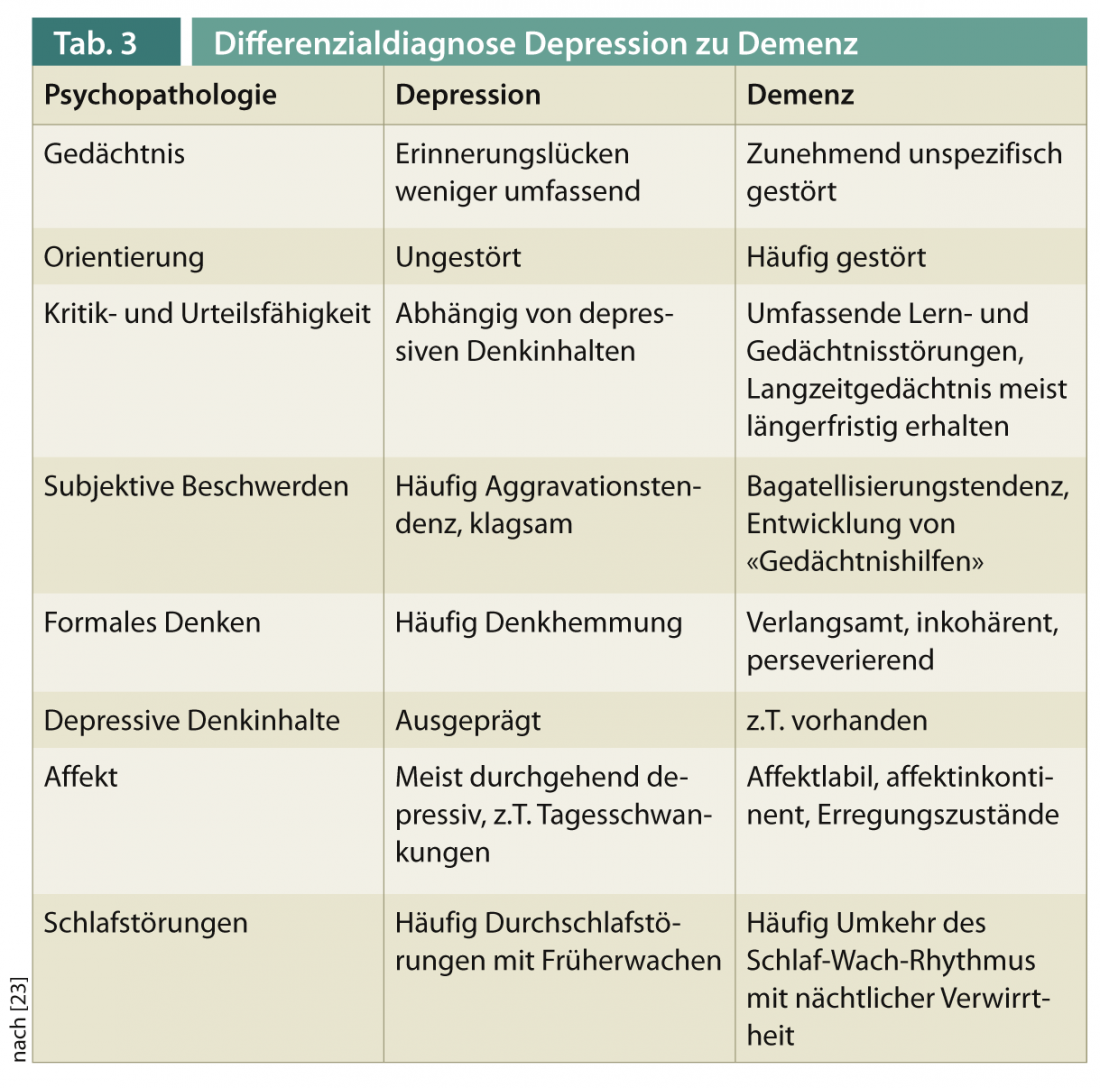
O diagnóstico diferencial entre a demência com sintomas depressivos secundários e a depressão com deficiência cognitiva secundária é um desafio clínico em pacientes de idade avançada. O Quadro 3 fornece uma visão geral das características de diferenciação psicopatológica.
Na doença de Alzheimer, as doenças neuropsiquiátricas (NPS) são frequentemente encontradas, mais frequentemente a apatia e sintomas depressivos. O NPS também desempenha um papel pródigo: os pacientes com uma ligeira deficiência cognitiva e o NPS, por exemplo, têm um risco muito mais elevado de aparecimento posterior do M. Alzheimer do que aqueles sem NPS [21]. As NPS na velhice são frequentemente os primeiros sinais de desenvolvimento da demência, mais pronunciados na demência frontotemporal [22].
Por outro lado, a depressão é um factor de risco para a demência; o número de episódios depressivos está correlacionado, por exemplo, com a ocorrência posterior da doença de Alzheimer [23].
Espera-se que no futuro sejam desenvolvidos conceitos de melhor base fisiopatológica para diferenciação. É concebível uma sobreposição da fisiopatologia dos sistemas noradrenérgicos, mas ainda não claramente definida, por exemplo, na demência de Alzheimer (como na doença de Parkinson) encontra-se uma redução dos neurónios noradrenérgicos no locus coeruleus, que pode também desempenhar um papel no desenvolvimento de sintomas afectivos [23, 24].
Diferenciar a depressão na idade mais avançada dos sintomas depressivos como NPS da AD é particularmente relevante porque há poucas provas da eficácia dos medicamentos antidepressivos na AD [21, 25], enquanto a eficácia dos antidepressivos e do tratamento psicoterapêutico da depressão na idade avançada está bem estabelecida [23]. Os SSRIs são preferidos para sintomas depressivos da doença de Alzheimer porque são mais bem tolerados. O NPS na AD responde moderadamente aos antipsicóticos. Contudo, a sua utilização deve ser cuidadosamente considerada devido a efeitos secundários potencialmente graves [21].
Christian Imboden, MD
Literatura:
- Carota A, Bogousslavsky J: perturbações do humor após acidente vascular cerebral. Frente Neurol Neurosci 2012; 30: 70-74.
- Kouwenhoven SE, Kirkevold M, Engedal K, Kim HS: Depressão em acidente vascular cerebral agudo: prevalência, sintomas dominantes e factores associados. Uma revisão sistemática da literatura. Disabil Rehabil 2011; 33(7): 539-556.
- Piber D, Hinkelmann K, Gold SM, Heesen C, Spitzer C, Endres M, et al: Depressão e doenças neurológicas. Nervenarzt 2012; 83(11): 1423-1433.
- Loubinoux I, Kronenberg G, Endres M, Schumann-Bard P, Freret T, Filipkowski RK, et al: depressão pós-choque: mecanismos, tradução e terapia. J Cell Mol Med 2012; 16(9): 1961-1969.
- Hackett ML, Anderson CS, House AO, Xia J: Intervenções para o Tratamento da Depressão após o AVC. Stroke 2009 14 de Maio.
- Tan LC: perturbações do humor na doença de Parkinson. Parkinsonism Relat Disord 2012; 18 Suppl 1: S74-S76.
- Schwarz J, Odin P, Buhmann C, Csoti I, Jost W, Wullner U, et al: Depressão na doença de Parkinson. J Neurol 2011; 258 (Suppl 2): S336-S338.
- Preacher RD, Matheus FC, Schwarzbold ML, Lima MM, Vital MA: Ansiedade na doença de Parkinson: uma revisão crítica dos estudos experimentais e clínicos. Neurofarmacologia 2012; 62(1): 115-124.
- Richard IH, McDermott MP, Kurlan R, Lyness JM, Como PG, Pearson N, et al: Um ensaio aleatório, duplo-cego e controlado por placebo de antidepressivos na doença de Parkinson. Neurologia 2012; 78(16): 1229-1236.
- Barone P, Poewe W, Albrecht S, Debieuvre C, Massey D, Rascol O, et al: Pramipexole para o tratamento de sintomas depressivos em doentes com doença de Parkinson: um ensaio aleatório, duplo-cego, controlado por placebo. Lancet Neurol 2010; 9(6): 573-580.
- Feinstein A: Esclerose múltipla e depressão. Mult Scler 2011; 17(11): 1276-1281.
- Feinstein A, O’Connor P, Feinstein K: Esclerose múltipla, interferon beta-1b e depressão Uma investigação prospectiva. J Neurol 2002; 249(7): 815-820.
- Koch MW, Glazenborg A, Uyttenboogaart M, Mostert J, De Keyser J: Tratamento farmacológico da depressão na esclerose múltipla. Cochrane Database Syst Rev 2011 Fev 16;(2)(2):CD007295.
- Skokou M, Soubasi E, Gourzis P: Depressão na esclerose múltipla: uma revisão das abordagens de avaliação e tratamento em populações adultas e pediátricas. ISRN Neurol 2012; 2012: 427102.
- Hoppe C, Elger CE: Depressão na epilepsia: uma revisão crítica de uma perspectiva clínica. Nat Rev Neurol 2011; 7(8): 462-472.
- Bagário M: Epilepsia, drogas antiepilépticas e suicídio. Curr Opinião Neurol 2011; 24(2): 177-182.
- Kanner AM: Depressão e epilepsia: Uma relação bidireccional? Epilepsia 2011; 52 Suppl 1: 21-27.
- Piedad J, Rickards H, Besag FM, Cavanna AE: efeitos psicotrópicos benéficos e adversos dos medicamentos antiepilépticos em doentes com epilepsia: um resumo da prevalência, mecanismos subjacentes e limitações de dados. CNS Drugs 2012; 26(4): 319-335.
- Pauli E, Stefan H: Desordens emocionais-afectivas em epilepsia. Neurologista 2009; 80(6): 729-744.
- Fountoulakis KN, Gonda X, Samara M, Siapera M, Karavelas V, Ristic DI, et al: Antiepileptic drugs and suicidality. J Psychopharmacol 2012; 26(11): 1401-1407.
- Lyketsos CG, Carrillo MC, Ryan JM, Khachaturian AS, Trzepacz P, Amatniek J, et al: Sintomas neuropsiquiátricos na doença de Alzheimer. Alzheimers Dement 2011; 7(5): 532-539.
- Taragano FE, Allegri RF, Krupitzki H, Sarasola DR, Serrano CM, Lon L, et al: Mild behavioural impairment and risk of dementia: um estudo de coorte prospectivo de 358 pacientes. J Clin Psychiatry 2009; 70(4): 584-592.
- Hatzinger M: Perturbações afectivas na velhice. Arquivos Suíços de Neurologia e Psiquiatria 2011; 162(5): 179-189.
- Szot P: factores comuns entre a doença de Alzheimer, doença de Parkinson e epilepsia: possível papel do sistema nervoso noradrenérgico. Epilepsia 2012; 53 Suppl 1: 61-66.
- Mesmo C, Weintraub D: Caso a favor e contra a especificidade da depressão na doença de Alzheimer. Psychiatry Clin Neurosci 2010; 64(4): 358-366.
InFo NEUROLOGIA & PSYCHIATRY 2013; 11(1): 9-12