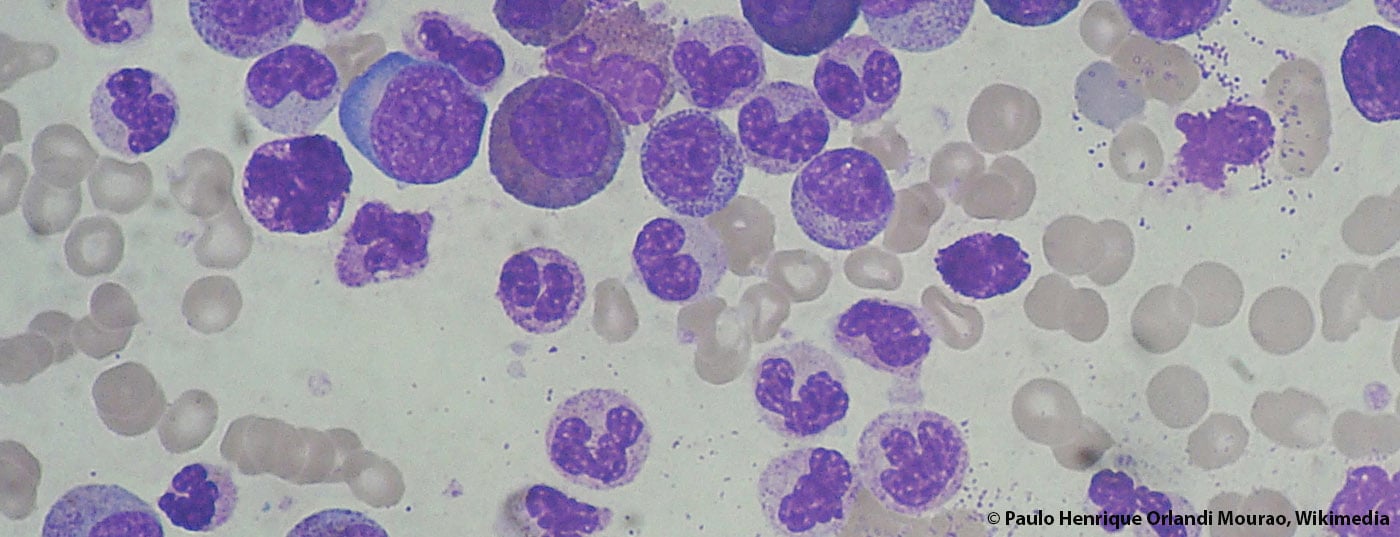
Muito tem acontecido no campo da leucemia mielóide crónica (CML) nos últimos anos. As taxas de resposta e de sobrevivência aumentaram acentuadamente, e alguns pacientes são mesmo considerados como tendo sido curados. Um suplemento recentemente publicado dos Anais de Hematologia sobre o tema da LMC fornece uma ampla panorâmica do estado do diagnóstico e da terapia em 2015.
De acordo com vários registos europeus, a incidência de leucemia mielóide crónica (LMC) tem sido estável nos últimos anos. A taxa anual é de 0,7-1,0/100.000. Em média, a idade no primeiro diagnóstico é de 57-60 anos. Não são conhecidos dados exactos de prevalência – assumem-se números de cerca de 10-12/100.000 habitantes, embora se possa observar aqui um aumento constante devido às taxas de sobrevivência muito melhoradas. Isto coloca grandes desafios aos sistemas de saúde; afinal de contas, os custos da terapia com inibidores de tirosina quinase (TKIs) são elevados. A este respeito, é interessante ver como se irá desenvolver o mercado dos genéricos. A patente do imatinibe expira no próximo ano.
O tratamento melhorou muito
O campo terapêutico na área da LMC está a desenvolver-se rapidamente. As taxas de sobrevivência aumentaram acentuadamente nos últimos anos e o objectivo do tratamento está a passar cada vez mais da paliação para a cura. Os pacientes que respondem às TKIs têm agora uma sobrevivência global quase tão boa como a da população saudável. Em alguns casos, a resposta é tão pronunciada que a terapia pode mesmo ser terminada. Isto torna ainda mais importante o desenvolvimento de conceitos e estudos para uma remissão sem tratamento.
Que escolha tem hoje em dia na primeira, segunda e terceira linhas?
É indiscutível que o imatinibi revolucionou o tratamento do CML. No entanto, está actualmente em discussão se a dose habitual de 400 mg é adequada para todos os doentes para alcançar um resultado óptimo. Vários estudos investigaram portanto o benefício potencial do tratamento imatinibular modificado ou a utilização de um TKI de segunda geração no contexto da primeira linha. Algumas abordagens que ainda podem ser descritas como experimentais com alta dose (800 mg) ou terapia imatinibular adaptada à dose ou também a combinação com interferão mostrou uma melhor resposta citogenética e molecular do que com a variante padrão – no entanto, até agora sem benefício em progressão livre (PFS) ou sobrevivência global (OS). Além disso, o dasatinib e o nilotinib foram aprovados na primeira linha, o que alargou as opções no tratamento de CML recém-diagnosticado. Estes dois agentes induzem uma resposta molecular muito rápida e sustentada.
A segunda geração de TKIs dasatinib, nilotinib e bosutinib são também muito susceptíveis de serem eficazes na segunda linha. A sua eficácia global é comparável, pelo que os médicos devem principalmente ter em conta o perfil de mutação do BCR-ABL1 e o histórico da doença ao tomarem decisões de tratamento: Se não houver uma mutação ou uma mutação que responda bem a estes agentes, deve ser tomada uma decisão com base no historial da doença. Por outro lado, se uma das poucas mutações BCR-ABL1 estiver presente que não responde bem a nenhum dos agentes, o TKI que mostrou actividade clínica contra a mutação específica deve ser seleccionado. Para pacientes com mutações T315I ou após falha do nilotinibe ou dasatinibe, o ponatinibe TKI de terceira geração é uma opção, embora a sua dose óptima ainda esteja a ser estudada.
Globalmente, poderia ser demonstrado que a avaliação da resposta molecular e citogenética já permite uma estratificação do risco prognóstico dos doentes após três meses em tratamento. A resposta precoce às TKIs está, assim, crucialmente relacionada com um resultado a longo prazo. Isto foi demonstrado tanto para o imatinib como para os TKI de segunda geração e também para o tratamento de segunda linha em vários estudos. Se um paciente com uma determinada TKI mostrar uma falha de tratamento precoce, pode assumir-se um resultado desfavorável, o que, por sua vez, torna ainda mais importante uma mudança atempada no tratamento.
Considerar todas as opções de tratamento
As vantagens e desvantagens da terapia TKI a longo prazo devem, em qualquer caso, ser comparadas com as do transplante alogénico de células estaminais (HSCT). Embora esta seja ainda uma opção como terapia de segunda e terceira linha na primeira fase crónica da LMC, a taxa de transplante caiu significativamente desde a introdução das IMC (para a indicação como terapia de salvamento em doenças avançadas, as taxas caíram menos acentuadamente).
Alguns autores neste número de Anais de Hematologia criticam a consideração primária do risco de doença (definido como falha da terapia TKI) na decisão de transplantar: sugerem uma abordagem mais equilibrada que inclui o risco de transplante e aspectos económicos para além do risco de doença. O HSCT deve ser integrado no algoritmo de tratamento desde o momento do diagnóstico inicial. Logo após o primeiro fracasso do tratamento sob TKI, o HSCT deve ser avaliado se os pacientes afectados têm um risco elevado de doença mas um baixo risco de transplante. Pelo contrário, em pacientes com doenças muito avançadas e elevado risco de transplante, o HSCT deve ser utilizado de forma restritiva e possivelmente apenas no ambiente de ensaio.
Efeitos secundários sob TKI
Por um lado, a maioria dos pacientes beneficia consideravelmente dos TKIs; por outro lado, os efeitos secundários tornaram-se mais evidentes precisamente devido à sobrevivência a longo prazo que foi agora alcançada. Aqueles que têm de ser tratados com tais agentes durante uma vida inteira estão interessados não só na eficácia, mas também na tolerância.
Em geral, os TKIs têm um perfil de segurança relativamente bom na prática clínica, uma vez que embora ocorram muitos efeitos secundários leves a moderados, estes limitam-se geralmente ao início da terapia e podem ser bem controlados posteriormente ou mesmo resolvidos espontaneamente. Actualmente, no entanto, ainda estão em aberto questões sobre segurança a longo prazo – especialmente no que diz respeito às gerações mais recentes de TKI. Por exemplo, foi recentemente demonstrado que em alguns casos estes novos agentes exercem efeitos negativos e irreversíveis sobre órgãos como o coração e os pulmões, especialmente na presença de comorbilidades. A selecção da TKI correcta requer, portanto, um exame atento dos parâmetros da doença, do paciente e do medicamento.
Fonte: Annals of Hematology 2015; 94(2).
InFo ONCOLOGy & HaEMATOLOGy 2015; 3(5): 22-24