Os sinais cutâneos patognomónicos da dermatomiosite incluem heliotropo eritema, pápulas de Gottron e sinais de Gottron. A determinação de auto-anticorpos específicos da miosite está a tornar-se cada vez mais importante para o diagnóstico. No que respeita às opções de tratamento, as imunoglobulinas intravenosas foram recentemente aprovadas oficialmente na Suíça. Os corticosteróides e a terapêutica de base convencional ainda são considerados o padrão de cuidados. A biologia e as pequenas moléculas são utilizadas em utilizações não rotuladas.
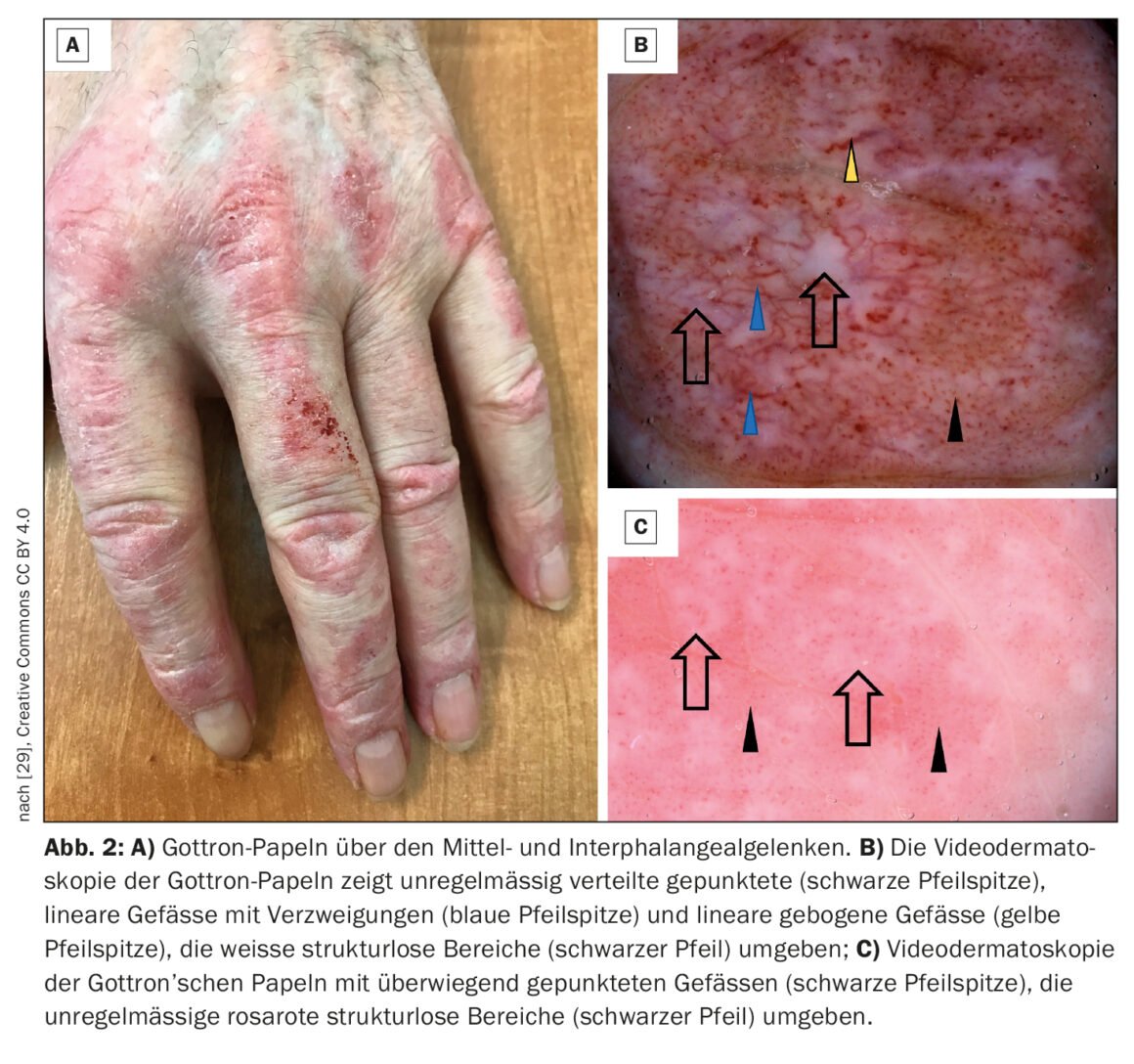
A dermatomiosite (DM) é uma doença auto-imune pertencente ao grupo dos miositides inflamatórias idiopáticas (caixa) , que pode começar logo na infância, mas também pode aparecer na velhice adulta [1–3]. As taxas de incidência mais elevadas são documentadas entre os 5 e 14 anos (DM juvenil) e os 45 e 50. As mulheres são afectadas cerca do dobro da frequência dos homens, não se conhece uma associação familiar [4]. No contexto do envolvimento muscular, há uma destruição muscular inflamatória, que pode levar a vários graus de fraqueza muscular, especialmente nos músculos do ombro e da cintura pélvica junto ao tronco. Os sinais clássicos na pele incluem erupção heliotrópica (Fig. 1), eritema da face, sinal de Gottron (Fig. 2) e alterações no leito das unhas. Para além da fraqueza muscular e das típicas alterações cutâneas, por vezes ocorre o envolvimento do coração e dos pulmões. Prof. Dr. med. Britta Maurer, Directora Clínica e Médica Chefe, Clínica de Reumatologia, Inselspital Bern, deu uma visão actualizada do diagnóstico e tratamento da dermatomiosite [5].
Autoanticorpos específicos de miosite, RM e biopsia, se necessário.
Na patogénese da dermatomiosite, uma microangiopatia mediada por completo com infiltrações linfocitárias perivasculares da pele e dos músculos desempenha um papel decisivo [6]. Numa classificação das sociedades profissionais europeias e americanas (EULAR, ACR), são utilizados parâmetros de exame clínico e laboratorial para calcular a probabilidade de um diagnóstico de DM (caixa) [2,3,7].
www.imm.ki.se/biostatistics/calculators/iim
Os parâmetros de miólise creatina cinase (CK), mioglobina e lactato desidrogenase (LDH) são frequentemente apenas ligeiramente elevados ou mesmo normais em DM [4]. A detecção de certos auto-anticorpos está associada a diferentes manifestações fenotípicas de dermatomiosite (Quadro 1). Contudo, em cerca de 30% de todos os casos de DM, não podem ser detectados autoanticorpos no soro dos doentes [8].
A ressonância magnética (RM) pode ser utilizada para visualizar infiltrações musculares inflamatórias. As biópsias são particularmente úteis em casos pouco claros. Com base numa biopsia muscular, é possível a detecção de infiltrados inflamatórios, perivasculares e/ou perifasciculares. Os achados histopatológicos das lesões cutâneas em DM incluem degeneração vacuolar de queratinócitos basais, infiltrados inflamatórios linfocíticos em torno dos vasos sanguíneos cutâneos e depósitos intersticiais de mucina [9].
Recomenda-se uma pesquisa tumoral para todas as formas de DM, uma vez que existe um risco estatisticamente aumentado (revisão 1) [7]. A maioria das pesquisas tumorais são realizadas no primeiro ano após o diagnóstico de DM e até três anos após o diagnóstico, uma vez que a manifestação tumoral é mais comum durante este período.
Corticosteróides na fase de indução – estratégia de partilha de esteróides no curso
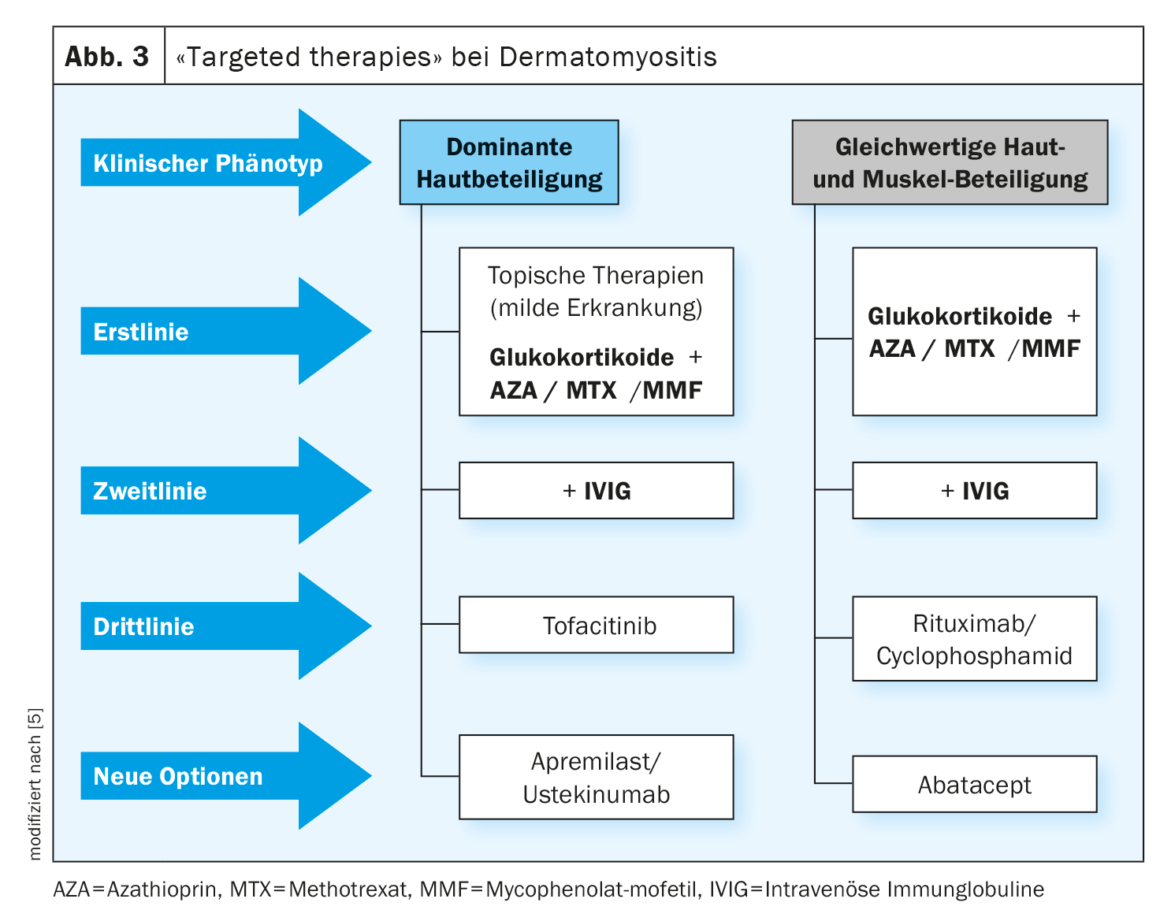
Os glucocorticosteróides são o tratamento de primeira linha para o DM (Fig. 3) [8]. Na fase aguda, começar com 1 mg/kg de peso corporal diário até à melhoria clínica, depois reduzir lentamente a dose. A maioria dos pacientes responde bem no início, mas para poupar esteróides, um imunossupressor adicional deve ser administrado após 6 meses no máximo; uma terapia combinada já pode ser considerada inicialmente, especialmente nas formas graves de progressão (Fig. 3) .
Glucocorticosteróides mais azathrioprine é a combinação mais comum no tratamento do DM [8]. A azatioprina deve ser administrada aditivamente numa dose de 1-3 mg/kg pb, especialmente em cursos severos, por exemplo, fraqueza generalizada, envolvimento muscular respiratório ou de deglutição, mesmo inicialmente, mas tem uma latência conhecida de 3-6 meses até ao início da acção.
O metotrexato (MTX) é pelo menos igual ao AZA em DM com envolvimento cutâneo marcado e é preferido ao AZA em DMJ com função renal normal. O MTX é um antagonista do ácido fólico e funciona mais rapidamente que o AZA com uma dose de 15-25 mg/semana, mas também se encontra numa classe de toxicidade mais elevada. A pneumonia ocorre ocasionalmente como um efeito secundário.
Se a AZA falhar ou se ocorrerem danos hepáticos tóxicos como resultado, o micofenolato mofetil (MMF, 2 g/d) pode ser usado como alternativa. A actual directriz [8] refere-se a vários relatórios de casos que apoiam os benefícios desta opção de tratamento [13–15]. O MMF bloqueia selectivamente a síntese de purina nos linfócitos, inibindo assim a sua proliferação. Os efeitos secundários mais importantes são a diarreia crónica, a anemia hemolítica e o edema.
IVIG agora oficialmente aprovado pelo Swissmedic
Em pacientes que respondem insuficientemente aos glicocorticóides/AZA, é útil um ensaio terapêutico com imunoglobulinas intravenosas (Fig. 3). Existem provas convincentes da eficácia do IVIG (Octagam®), que foi confirmada no ensaio de registo ProDERM [18,19], duplo-cego, controlado por placebo, fase III. Na Suíça, Octagam® recebeu uma extensão de indicação do Swissmedic em Fevereiro de 2023 para o tratamento de DM em adultos [30].
Directriz recomenda rituximab para cursos refractários de doenças
O Rituximab (RTX), um anticorpo anti-CD20 usado fora do rótulo para a DM na Suíça, demonstrou ser prometedor em casos refractários (Fig. 3) [16]. No que respeita à dosagem, a directriz recomenda a utilização do “regime imunológico” com 2× 1000 mg i.v. em intervalos de 14 dias, com administração renovada após aproximadamente 6-9 meses, se tal parecer necessário devido à evolução clínica. Os pacientes do registo GRAID-2 receberam uma média de 3,09 infusões [16,17]. Não surgiram preocupações de segurança particulares nestes pacientes e a maioria deles demonstrou uma boa tolerância. As infecções são os efeitos secundários indesejáveis mais importantes da terapia rituximab [16,17].
Se estas estratégias terapêuticas não forem eficazes: o que mais existe?
Num pequeno estudo, Abatacept, que é biológico, mostrou resultados promissores na redução da actividade da doença em doentes adultos com dermatomiosite refractária [21]. Após seis meses de tratamento com abatacept, as biópsias musculares revelaram um aumento das células reguladoras T (Treg) da caixa de forquilha anti-inflamatória P3 (FoxP3)+, indicando a regeneração muscular e a resposta ao tratamento [21]. Tang et al. investigou os efeitos do abatacept em doentes com miosite utilizando um conjunto de dados do estudo ARTEMIS e descobriu que a relação CD4/CD8 na corrente sanguínea na altura da doença activa poderia ser um preditor da eficácia do tratamento [22]. A investigação da eficácia e segurança do abatacept na dermatomiosite é o tema de vários estudos em curso [16].
Estão disponíveis vários relatos de casos de tratamento com tofacitinibe, um inibidor JAK, incluindo dois doentes com dermatomiosite com calcinose e doença intersticial pulmonar que foram tratados com tofacitinibe durante 28 semanas e mostraram uma resposta muito boa. Não ocorreram novas calcificações em nenhum dos pacientes, o tratamento com tofacitinibe foi bem tolerado e não ocorreram grandes problemas de segurança [23]. Num outro caso, um doente adulto com dermatomiosite hipomiopática anti-MDA-5 e anti-Ro52 com envolvimento pulmonar intersticial mostrou uma resposta significativa ao tofacitinibe, como evidenciado por uma melhor capacidade de exercício, condição cutânea e doença pulmonar intersticial. O tratamento foi bem tolerado [24]. O uso de tofacitinibe também está a ser discutido para o tratamento da dermatomiosite anti-NXP2 e anti-TIF1γ refractária [25].
Há também provas de séries de casos que o apremilast inibidor oral de PDE-4 pode ser útil em doentes com sintomas recorrentes de DM como coadjuvante de outros medicamentos imunomoduladores [26]. Em três pacientes, o apremilast 30 mg (2×/d) como suplemento levou a uma melhoria significativa e a efeitos de partilha de esteróides. O mecanismo exacto de acção do apremilast em DM não é conhecido. Pensa-se que a influência da resposta Th1 e Th2 está envolvida [26].
Para além do abatacept, tofacitinibe e apremilast, ustekinumab e ciclofosfamida estão também entre os agentes que são utilizados fora do rótulo em cursos refractários e que estão a ser investigados em ensaios clínicos em curso.
Congresso: Actualização em Alergia e Imunologia (SGAI)
Literatura:
- Dressler F, Maurer B: Dermatomiosite e dermatomiosite juvenil. Z Rheumatol 2022. https://doi.org/10.1007/s00393-022-01205-5
- Tomaras S, Kekow J, Feist E: Miopatias inflamatórias idiopáticas: actualizações sobre diagnóstico e classificação. Lei Rheumatol 2021; 46: 361-372.
- Bottai M, et al: International Myositis Classification Criteria Project consortium, Euromyositis register and the Juvenile Dermatomyositis Cohort Biomarker Study and Repository (JDRG) (Reino Unido e Irlanda). Critérios de classificação EULAR/ACR para miopatias inflamatórias idiopáticas adultas e juvenis e os seus principais subgrupos: um relatório metodológico. RMD Aberto 2017 Nov 14;3(2): e000507.
- Deutsche Gesellschaft für Muskelkranke e.V.: DGM-Handbuch Myositis, 2020, capítulo 3a. Dermatomiosite (DM), Prof. Dr. Eugen Feist, Prof. Dr. Cord Sunderkötter. myositispatientguidebook2020web.pdf
- “Dermatomiosite – Abordagens Diagnósticas Actuais e Estratégias Terapêuticas”, Prof. Dr. Britta Maurer, Allergy and Immunology-Update (SGAI), 27-29.01.23.
- Stuhlmüller B, et al.: Novos aspectos sobre a patogénese da miosite. Z Rheumatol 2013; 72: 209-219.
- Schlecht N, et al: Actualização sobre dermatomiosite em adultos. J Dtsch Dermatol Ges 2020; 18(9): 995-1013.
- “Myositis syndromes”, s2k guideline, Commission on Guidelines of the German Neurological Society (ed.), Totalmente revista: 28.04.2022.
- Okiyama N, Fujimoto M: manifestações cutâneas de dermatomiosite caracterizadas por auto-anticorpos específicos da miosite. F1000Res 2019 21 de Novembro; 8: F1000 Faculdade Rev-1951. doi: 10.12688/f1000research.20646.1.
- Venda S: Dermatomiosite em comparação multirregional, Dissertação, Faculdade de Medicina da Universidade Friedrich-Alexander, Erlangen-Nuremberga, 2021.
- Hill CL, et al: Frequência de tipos específicos de cancro na dermatomiosite e polimiosite: um estudo baseado na população. Lancet 2001: 357(9250): 96-100.
- Stockton D, Doherty V, Brewster D: Risco de cancro em doentes com dermatomiosite ou polimiosite, e implicações de seguimento: um estudo de coorte com base na população escocesa. Revista britânica do cancro 2001; 85(1): 41-45.
- Majithia V, Harisdangkul V: Micofenolato mofetil (CellCept): uma terapia alternativa para a miopatia inflamatória auto-imune. Reumatologia (Oxford) 2005; 44(3): 386-389.
- Schneider-Gold C HH, Gold R. Mycophenolate mofetil e tacrolimus: novas opções terapêuticas em doenças neuroimunológicas. Nervo Muscular 2006; 34: 284-291.
- Chaudhry V, et al: Mycophenolate mofetil: um imunossupressor seguro e promissor nas doenças neuromusculares. Neurologia 2001; 56(1): 94-96.
- Patil A, et al: Tratamento da dermatomiosite adulta e juvenil. J Cosmet Dermatol 2023; 22(2): 395-401.
- 17 Fiehn C, et al: Rituximab para o tratamento da poli- e dermatomiosite: resultados do registo GRAID-2. Z Rheumatol 2018; 77: 40-45.
- Aggarwal R, et al. Eficácia e Segurança do IVIg (Octagam 10%) em Pacientes com Dermatomiosite Activa. Resultados de um Estudo Randomizado, Duplo-Blind, Fase III Controlado por Placebo (Estudo ProDERM) [abstract]. Artrite Rheumatol 2020; 72.
- Dalakas MC, et al: Um ensaio controlado de infusões de imunoglobulina intravenosa de alta dose como tratamento para a dermatomiosite. N Engl J Med 1993; 329(27): 1993-2000.
- Stringer E, Feldman BM: Avanços no tratamento da dermatomiosite juvenil. Curr Opinião Rheumatol. 2006; 18(5): 503-506.
- Tjarnlund A, et al: Abatacept no tratamento da dermatomiosite e polimiosite adultas: um ensaio aleatório, fase IIb do tratamento retardado de arranque. Ann Rheum Dis 2018; 17: 55-62.
- Tang Q, et al. Efeito do tratamento CTLA4-Ig (abatacept) nas células T e células B do sangue periférico de doentes com polimiosite e dermatomiosite. Scand J Immunol 2019; 89:e12732.
- Wendel S, et al: Tratamento bem sucedido de calcificações extensivas e envolvimento pulmonar agudo na dermatomiosite com o inibidor de Janus-kinase tofacitinib – um relatório de dois casos. J Autoimmun 2019; 100: 131-136.
- Hornig J, et al: Resposta da dermatomiosite com envolvimento pulmonar ao tratamento com inibidor de Janus kinase. Z Rheumatol 2018; 77: 952-957.
- Navarro-Navarro I, et al: Tratamento da dermatomiosite refratária anti-NXP2 e anti-TIF1γ com tofacitinibe. J Dtsch Dermatol Ges 2020; 19: 443-447.
- Bitar C, et al: Apremilast como tratamento potencial para a dermatomiosite moderada a grave: um estudo retrospectivo de 3 pacientes. Rep. Caso JAAD 2019; 5: 191-194.
- Charlton D, et al: Dermatomiosite cutânea refratária com prurido escalpe severo responsivo ao apremilast. J Clin Rheumatol 2019; 27:S561-S562.
- 28 Bobirca A, et al: Anti-MDA5 Amyopathic Dermatomyositis – A Diagnostic and Therapeutic Challenge. Vida 2022; 12(8): 1108. https://doi.org/10.3390/life12081108
- Żychowska M, Reich A: Dermatomioscopia e Trichoscopia em Dermatomiosite-A Estudo Transversal. Journal of Clinical Medicine 2022; 11(2):375. https://doi.org/10.3390/jcm11020375.
- Informação sobre drogas, www.swissmedicinfo.ch/ViewMonographie,(último acesso 03.03.2023).
DERMATOLOGIE PRAXIS 2023; 33(2): 47-49 (publicado 20.4.23, antes da impressão).