Vários estudos demonstraram que a ecografia pode ser utilizada para detectar carcinomas para além da mamografia, especialmente na mama densa. Na detecção precoce do cancro em mulheres assintomáticas, a ultra-sonografia mamária não tem actualmente um estatuto independente reconhecido. Nas mulheres sujeitas a rastreio intensificado, a ecografia é também parte integrante do programa de exame multimodal. Se for indicada uma biópsia, esta é realizada de preferência sob orientação sonográfica.
O ultra-som é conhecido por ser um método de exame prático, facilmente acessível, com boa sensibilidade, embora dependente do examinador. No diagnóstico do carcinoma da mama, deve ser feita uma distinção entre a utilização de ultra-sons no contexto da detecção precoce e a utilização em casos de suspeita de carcinoma da mama ou de carcinoma já confirmado.
Aspectos técnicos
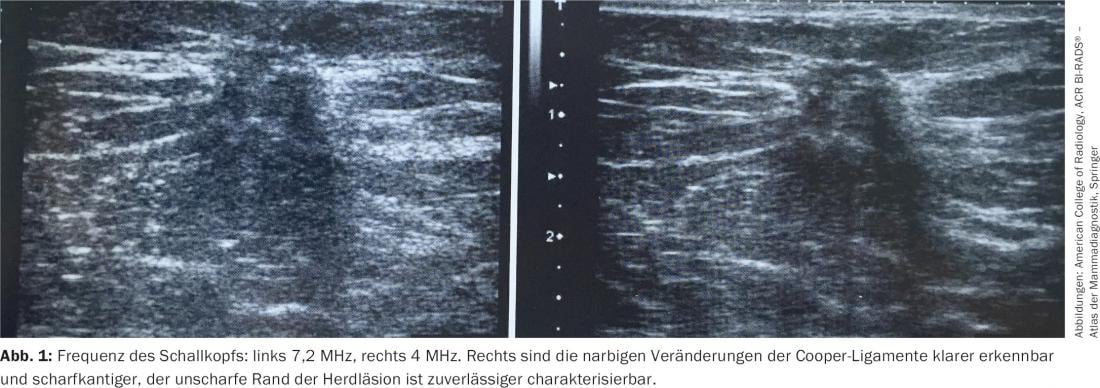
O principal requisito de uma ecografia mamária é fornecer uma imagem de alto contraste e alta resolução com boa representação anatómica. A má qualidade da imagem ultra-sonográfica pode levar a um diagnóstico errado grave, por exemplo, confundir um carcinoma com um cisto. A Directriz prática do ACR para a realização de um exame de ultrassom de mama (2011) recomenda a utilização de um transdutor linear de grande largura de banda com uma frequência central de pelo menos 10 MHz [1]. No extremo superior da escala de alta frequência (entre 12 e 18 MHz), estes transdutores fornecem imagens de alta resolução (Fig. 1) . Na gama de frequências mais baixas, é possível alcançar uma profundidade de penetração no tecido de até 5 cm.
A zona focal deve ser colocada na região de interesse no terço anterior a médio entre a pele e a parede torácica. Ao avaliar uma lesão, a zona focal é colocada de forma óptima no centro da lesão.
A mais antiga técnica de exame sistemático é o traçado transversal e longitudinal do tórax. Com o aumento da resolução espacial nos sonogramas mamários, o sistema de condutas oferece-se agora como uma estrutura guia, de modo que a orientação do transdutor anti-radiográfico em secções transversais e longitudinais segmentares está a tornar-se mais generalizada como alternativa.
Técnicas como o Doppler, análises 3D e 4D e a elastografia aumentam a quantidade de informação de diagnóstico, mas ainda não foram definidas como necessárias para o diagnóstico básico. A mais recente tecnologia neste campo é a ultra-sonografia mamária automatizada, que realiza exames de ultra-sons mamários independentes do utilizador e rápidos em campo completo.
Diagnóstico por ultra-sons para detecção precoce
A mamografia é o único método de rastreio do cancro da mama que tem sido capaz de mostrar um efeito positivo na redução da mortalidade específica do cancro da mama em diferentes estudos baseados na população [2]. Mesmo em tempos de conceitos terapêuticos mais modernos, o tamanho do tumor e especialmente o estado nodal no diagnóstico permanece um parâmetro prognóstico essencial e indiscutível [3]. Isto significa que o papel da imagiologia na detecção precoce do cancro da mama continua a ser central. De onze ensaios aleatórios de mamografia, apenas os que também mostraram uma diminuição dos casos avançados de cancro da mama e um aumento dos cancros mamários negativos mostraram uma redução da mortalidade por cancro da mama [4,5].
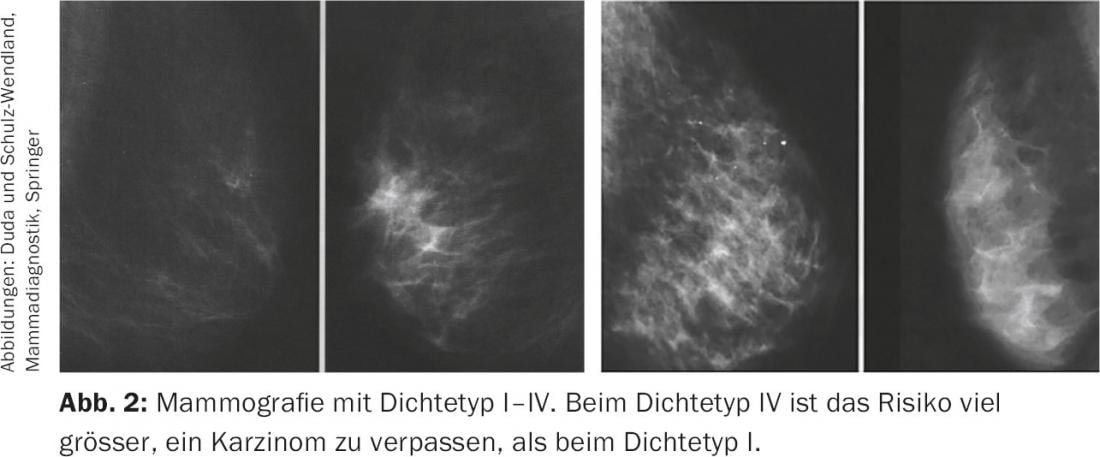
Em mulheres com tecido mamário denso, o carcinoma mamário pode ser mascarado e consequentemente falhado na mamografia; isto leva a um excesso de carcinomas mamários avançados e recém-diagnosticados [6]. Após uma mamografia de rastreio normal, as mulheres com densidade mamária extremamente elevada têm quase 18 vezes mais probabilidades de serem diagnosticadas com cancro da mama devido a sintomas clínicos do que as mulheres com tecido glandular envolvido [7]. Estes carcinomas de intervalo (ou seja, os diagnosticados antes do próximo rastreio) tendem a ser maiores, mais agressivos e têm um prognóstico pior do que os carcinomas detectados no rastreio. Consequentemente, uma baixa taxa de carcinomas de intervalo é uma medida da eficácia do rastreio.
A densidade mamográfica elevada desempenha um papel não só em termos de mascarar o cancro da mama, mas aumenta o risco de cancro da mama per se. As metanálises mostraram um risco quatro a cinco vezes maior de desenvolver cancro da mama quando as mulheres com densidade mamária muito baixa foram comparadas com as mulheres que tinham uma densidade mamária muito alta [8].
Vários estudos demonstraram que a ecografia pode ser utilizada para detectar carcinomas para além da mamografia, especialmente na mama densa. (Fig.2). A directriz S3 para o carcinoma da mama já exige, portanto, a utilização regular de ultra-sons mamográficos em mamas densas (densidade ACR 3.4) na directriz de detecção precoce a partir de 2008 [9]. O ultra-som é também recomendado como medida complementar para seios densos na última recomendação do Grupo de Trabalho sobre Oncologia Ginecológica [10]. Uma vez que a densidade mamária tem um impacto tão significativo na certeza de excluir o cancro da mama, foi mesmo aprovada uma lei nos EUA em 2011 que exige que as instalações que realizam mamografias forneçam por escrito tanto ao médico que faz a referência como à paciente a densidade mamária individual.
Na detecção precoce do cancro em mulheres assintomáticas, a ultra-sonografia mamária não tem actualmente um estatuto independente reconhecido. O seu papel a este respeito é antes o de complementar a mamografia, com a qualidade da mamografia e da sonografia a influenciarem-se mutuamente.
Uma equipa internacional de investigadores queria saber se a sonografia também é adequada para o rastreio do cancro da mama [11]. Para este fim, cerca de 2700 mulheres foram examinadas três vezes, com intervalos de um ano cada, por meio de mamografia e ultra-som. Foi detectado um total de 111 casos confirmados de cancro da mama. As taxas de detecção eram comparáveis para ambos os métodos de exame. Para detectar um caso de cancro da mama, 129 mulheres tiveram de ser sonografadas. Na mamografia, este valor era de 127. Contudo, o sucesso do ultra-som pareceu melhor com o aumento da densidade mamária. Além disso, foram detectados sonograficamente tumores mais invasivos e tumores linfáticos negativos. Os investigadores avaliam a sonografia como uma alternativa em países onde a mamografia estruturada não é oferecida.
Não se deve esquecer que o aumento da taxa de detecção do cancro devido à ultra-sonografia mamária aditiva é compensado por um aumento da taxa de biopsia. Felizmente, a clarificação interventiva de um achado sonográfico pouco claro, que pode ser realizada sem demora, permite um tempo de espera significativamente mais curto em comparação com métodos alternativos (estereotáxica, tomossíntese ou mesmo clarificação guiada por ressonância magnética).
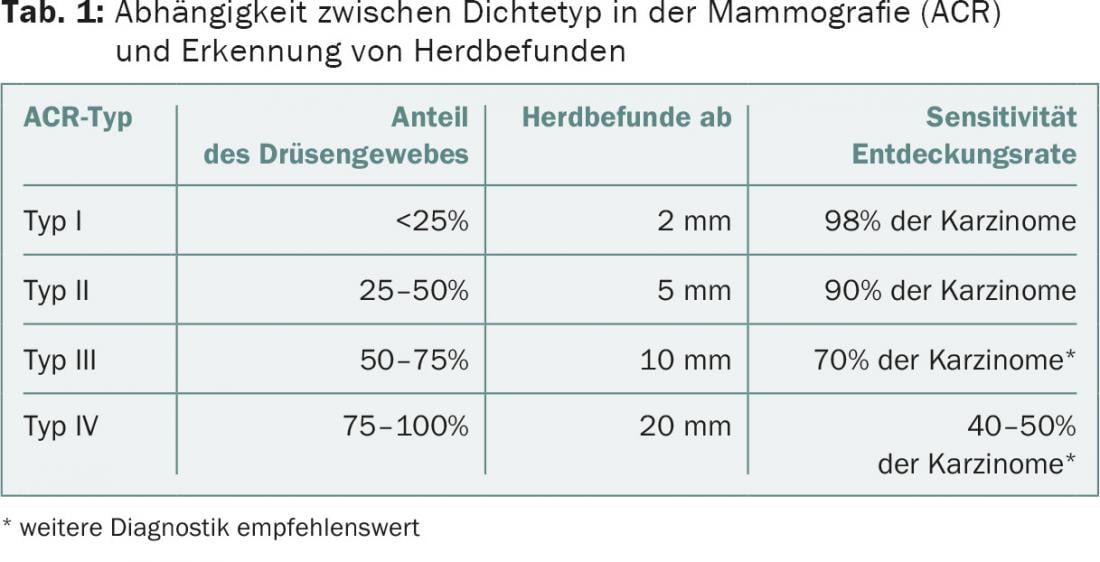
Em resumo, a ecografia mamária é obrigatória na situação de detecção precoce como método aditivo à mamografia em seios densos (densidade ACR 3.4) (Tab. 1) . Isto também significa que a ecografia mamária desempenha um papel mais importante na mulher mais jovem (com tecido glandular fisiologicamente denso) do que na paciente mais velha. Os resultados ultrassonográficos têm um valor mais elevado em mulheres mais jovens do que em mulheres mais velhas e podem mesmo ultrapassar a mamografia em mulheres com menos de 40 anos de idade em termos de diagnósticos positivos de malignidade.
Nas mulheres sujeitas a rastreio intensificado (portadores de mutação genética BRCA1 ou BRCA2, heterozigotos de risco ≥20% ou risco remanescente ao longo da vida ≥30% de acordo com o modelo de previsão normalizado, bem como nas sobreviventes após tumores infantis com radioterapia terapêutica da parede torácica), a ecografia é também parte integrante do programa de exame multimodal (recomendado a cada seis meses a partir dos 25 anos de idade).
Diagnóstico por ultra-sons no doente sintomático
Como a ecografia mamária é um método de exame prático e facilmente acessível, é frequentemente utilizada na paciente sintomática no início do processo de diagnóstico. O ultra-som complementa outras técnicas de imagem, permite a diferenciação entre os resultados císticos e sólidos. Mesmo que o correlato mamográfico de um achado de palpação já seja visível, é importante caracterizar a massa sonográfica, documentar a extensão do tumor e excluir a multifocalidade/centricidade e o envolvimento axilar. Em doentes com resultados anormais na RM mamária e ultra-sons mamários inicialmente não notáveis, deve ser definitivamente realizada uma ultra-sonografia alvo. Se o achado suspeito descrito na ressonância magnética também puder ser representado sonograficamente, uma clarificação bióptica pode ser realizada sonograficamente em vez de guiada por ressonância magnética. A clarificação interventiva de um achado sonográfico pouco claro pode ser realizada sem demora e reduz significativamente o tempo de espera em comparação com os métodos alternativos. Isto significa menos stress psicológico para o doente.
É portanto compreensível que uma clarificação bióptica seja preferencialmente realizada por ultra-sons, desde que os resultados possam ser bem representados na ultra-sonografia. Uma indicação particularmente boa é a presença de múltiplos nós palpáveis com suspeita de carcinoma. O ultra-som também vem em primeiro lugar na cascata de diagnóstico do peito durante a gravidez e amamentação. Em contraste com a estereotaxi, a biopsia guiada por tomografia ou ressonância magnética, a biopsia guiada por sonografia também requer menos pessoal, equipamento e esforço organizacional.
A ultra-sonografia mamária é também utilizada para monitorizar a resposta ao tumor durante a quimioterapia neoadjuvante. Nestes pacientes, é normalmente indicado marcar o tumor com um clip durante a quimioterapia neoadjuvante para que o local a ser operado ainda possa ser rastreado se houver uma resposta tumoral completa no final da quimioterapia. A inserção do clipe pode normalmente ser guiada por sonografia sem qualquer problema. O ultra-som é também utilizado para monitorizar o tamanho do tumor durante a terapia endócrina primária de um carcinoma da mama anteriormente não operado (por exemplo, numa paciente idosa ou se a operação recomendada for rejeitada). Além disso, a ecografia no ambiente pré-operatório ajuda a marcar a incisão exacta e a realizar a marcação do tumor com fio se o carcinoma não for palpável mas puder ser visualizado por ultra-sons.
Literatura:
- American College of Radiology: Directriz prática do ACR para o exame de ultra-som de mama de desempenho.
- Broeders M, et al: The impact of mammographic screening on breast cancer mortality in Europe: a review of abservational studies. J Med Screen 2012; 19: 14-25.
- Saadatmand S, et al: Influência da fase de detecção do cancro da mama na sobrevivência nos tempos modernos: Estudo baseado na população em 173797 pacientes. BMJ 2015; 351: h4901.
- Smith RA, et al: The randomized trials of breast cancer screening: What have we learned? Radiol Clin North Am 2004; 42: 793-806.
- Tabár L, et al.: Insights from the breast cancer screening trials: How screening affects the natural history of breast cancer and implications for evaluating service screening programmes. Breast J 2015; 21:13-20.
- Gierach GL, et al: Relação entre a densidade mamográfica e a morte por cancro da mama no Consórcio de Vigilância do Cancro da Mama. J Natl Cancer Inst 2012; 104: 1218-1227.
- Boyd NF, et al: Mammographic density and breast cancer risk: Current understanding and future prospects. Breast Cancer Res 2011; 13: 223.
- Sickles EA: A utilização da imagiologia mamária para o rastreio de mulheres com elevado risco de cancro. Radiol Clin North Am 2010; 48: 859-878.
- Albert US (editor): Nível 3 Directriz para a detecção precoce do cancro da mama na Alemanha. 1ª actualização 2008. Germering/Munich: W. Zuckschwerdt Verlag GmbH, Industriestrasse 1, D-82110ISBN 978-3-88603-931-9.
- Schreer I, Albert US: Detecção e diagnóstico precoce. In: AGO Breast Committee. Diagnóstico e tratamento de doentes com cancro da mama primário e metástático. Recomendações 2015. www.ago-online.de.
- Berg WA, et al: Situação actual da Rastreio Suplementar em Peitos Densos. JNCI J Natl Cancer Inst 2016; online primeiro.
InFo ONCOLOGy & HaEMATOLOGy 2016; 4(6): 11-15
PRÁTICA DO GP 2017; 12(2): 26-30