Na Suíça, a aprovação da Dupilumab biológica altamente eficaz na área de indicação de dermatite atópica tem sido até agora limitada a pacientes adultos e adolescentes com 12 anos ou mais. O anticorpo monoclonal convence com um alívio rápido e duradouro dos sintomas e aumenta comprovadamente a qualidade de vida dos neurodermatites que sofrem. Na UE, foi concedida uma extensão de indicação para o grupo etário 6-11 anos há alguns meses, com base em estudos correspondentes da fase III. Que o dupilumab é também eficaz e seguro em crianças em idade pré-escolar é demonstrado por dados recentemente publicados do estudo LIBERTY AD-PRESCHOOL.
Os doentes com dermatite atópica sofrem de uma qualidade de vida consideravelmente reduzida, especialmente quando a doença é grave. A comichão excruciante é muito desagradável, pode levar a perturbações do sono e, especialmente em crianças e adolescentes, pode contribuir para a concentração e dificuldades de aprendizagem. Além disso, os pacientes sentem-se muito estigmatizados por alterações visíveis da pele. O principal objectivo da terapia é aliviar a comichão e tratar as alterações inflamatórias da pele. A terapia orientada por directrizes é levada a cabo de uma forma adaptada por etapas. A terapia do sistema é recomendada para eczemas persistentes e graves que não respondem adequadamente aos agentes tópicos.
Para crianças dos 12 aos 17 anos, regime de dosagem adaptado ao peso
O dupilumab de anticorpos monoclonais bloqueia a transdução de sinal das interleucinas 4 e 13, cuja expressão está correlacionada com a actividade da doença em pessoas com dermatite atópica. Dupilumab (Dupixent®) está disponível na dose prescrita como seringa pré-cheia e pode ser administrado subcutaneamente pelos próprios doentes após instrução médica [1]. Para adultos com dermatite atópica moderada a grave, o Dupixent® tem sido aprovado na Suíça desde 2019. Em Novembro de 2020, o Swissmedic concedeu uma extensão de indicação para adolescentes com 12 anos ou mais. Dupixent® é indicado quando a terapia com medicamentos tópicos de prescrição não proporciona um controlo adequado da doença ou não é recomendada [1]. A condição para a cobertura de custos pelo seguro de saúde é a limitação de que um tratamento com pelo menos um imunossupressor convencional não tenha alcançado efeito suficiente. Em adultos, o dupilumab é dado numa dose inicial de 600 mg (2× 300 mg) e depois 300 mg a intervalos de duas semanas. Em doentes com 12 a 17 anos, o intervalo de administração é também de duas semanas, e o regime de dosagem é adaptado ao peso: em adolescentes com um peso corporal <60 kg, a dose inicial é de 400 mg (2× 200 mg), seguida de 200 mg a intervalos de 2 semanas. Em adolescentes com um peso corporal ≥60 kg, recomenda-se uma dose inicial de 600 mg (2× 300 mg), seguida de 300 mg a intervalos de duas semanas [1].
Já aprovado na UE para crianças entre os 6 e os 11 anos de idade e
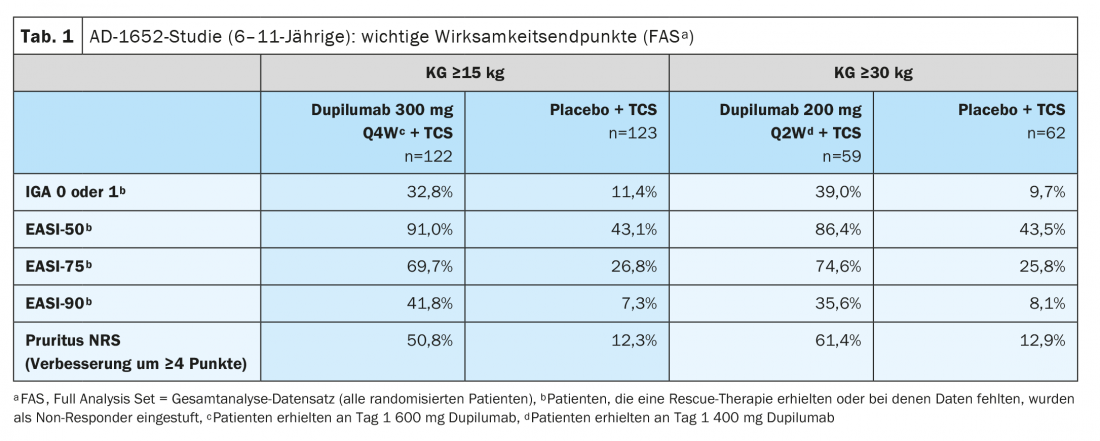
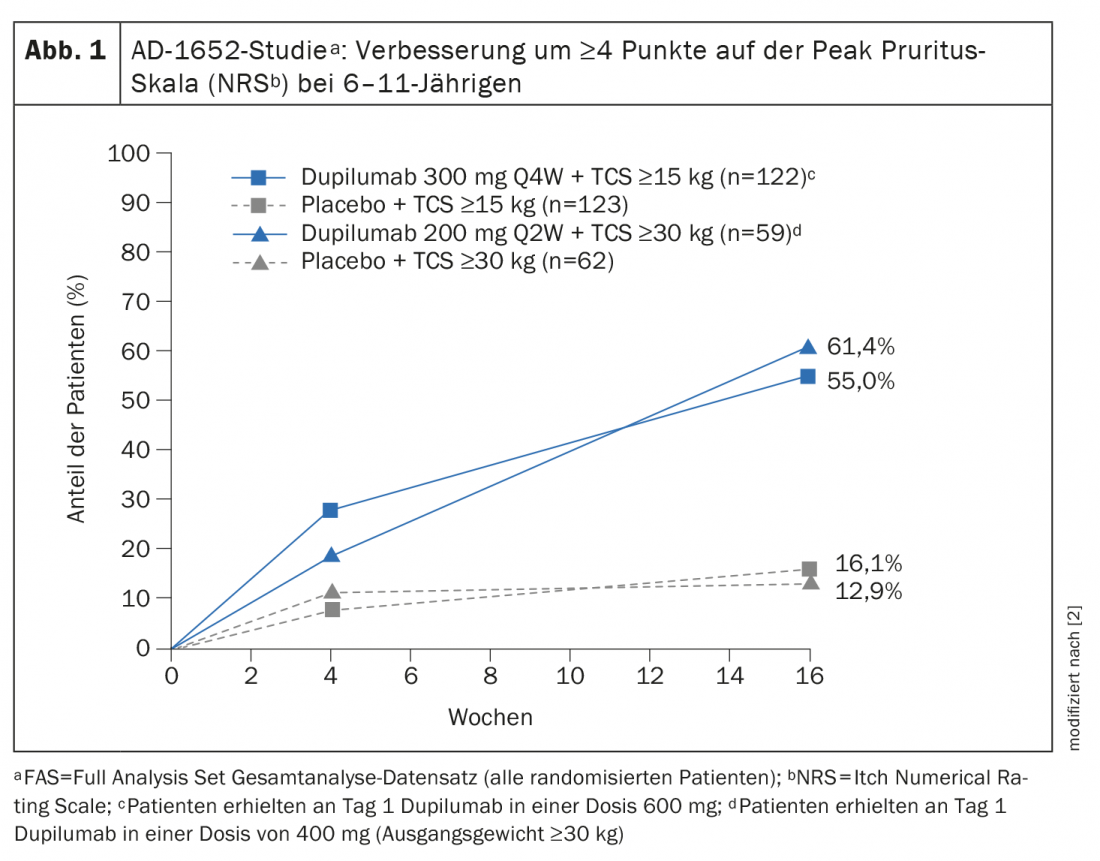
A Comissão Europeia concedeu uma autorização de comercialização ao dupilumab para crianças a partir dos 6 anos de idade em Novembro de 2020 [2,3]. A extensão da indicação baseia-se nos dados do estudo aleatório e duplo-cego AD-1652, que investigou a eficácia e segurança do dupilumab em combinação com TCS em 367 pacientes de 6 a 11 anos de idade. Os resultados de importantes parâmetros de eficácia podem ser vistos no quadro 1 [2]. O parâmetro co-primário foi a proporção de pacientes com IGA* 0 ou 1 (sem aparência ou quase sem aparência) com uma melhoria de pontos ≥2 e a proporção de pacientes com EASI-75 (melhoria EASI de pelo menos 75%) entre a linha de base e a semana 16. Resultados estratificados pelo peso da linha de base mostrados para participantes do estudo com uma KG de 15-29,9 kg tratados com dupilumab 300 mg Q4Wd#+ TCS, 32,8% tinham pele sem aspecto ou quase sem aspecto (IGA 0 ou 1), enquanto que esta proporção era de 11,4% nos participantes no estudo tratados com placebo mais TCS. Nos doentes ≥30 kg que receberam 200 mg de dupilumab a cada quinzena, este valor chegou a 39,0% contra 9,7%. Uma melhoria de 75% na aparência da pele de acordo com a Área de Eczema e o Índice de Gravidade (EASI-75) foi alcançada por 69,7% e 74,6% dos pacientes tratados com dupilumab, respectivamente, em comparação com 26,8% e 25,8% nos grupos de placebo. O Dupilumab+TCS também provou ser claramente superior ao placebo+TCS em termos de redução no SCORAD e melhoria no NRS. Mais de metade dos pacientes dos grupos dupilumab conseguiram uma melhoria de ≥4 pontos no NRS, enquanto nos grupos placebo esta proporção foi de 12,9% ou menos. 16,1% (Fig. 1).
* IGA = Avaliação Global do Investigador
#
Q4Wd = Intervalo de dose de 4 semanas
Pacientes de 6 meses a 5 anos: novos dados promissores
A dermatite atópica começa normalmente entre o 3º e 6º mês de vida, com 60% dos doentes a ficarem doentes no 1º ano de vida. No 5º ano de vida, o aparecimento da doença ocorre em 90% dos doentes [4]. O estudo da fase III LIBERTY AD PRESCHOOL confirmou o perfil bem estabelecido de eficácia e segurança do Dupixent® noutros grupos etários em crianças dos 6 meses aos 5 anos de idade com dermatite atópica moderada a grave. Todos os pontos finais primários e secundários foram cumpridos. Os dados mostram que a adição de dupilumabe ao tratamento padrão com corticosteróides tópicos (TCS) reduziu significativamente a gravidade global da doença e melhorou a depuração da pele, comichão e qualidade de vida relacionada com a saúde após 16 semanas, em comparação com os TCS apenas. Durante o período de tratamento de 16 semanas, a taxa global de eventos adversos (EA) foi de 64% para dupilumabe e 74% para placebo. Os EAU mais comuns incluíam nasofaringite (8% dupilumab, 9% placebo), infecções do tracto respiratório superior (6% dupilumab, 8% placebo) e conjuntivite (5% dupilumab, 0% placebo), infecções do vírus do herpes (6% dupilumab, 5% placebo) e reacções do local de injecção (2% dupilumab, 3% placebo). Em resumo, os resultados de segurança deste estudo foram consistentes com o perfil de segurança conhecido do dupilumabe em dermatite atópica.
Literatura:
- Breve informação técnica: Dupixent®, www.swissmedicinfo.ch (último acesso 19.11.2021)
- Agência Europeia de Avaliação dos Medicamentos (EMA), www.ema.europa.eu/en/documents/product-information/dupixent-epar-product-information_de.pdf (acedido pela última vez em 19.11.2021)
- “Dupixent® (dupilumab) aprovado pela Comissão Europeia como primeira e única medicina biológica para crianças dos 6 aos 11 anos com dermatite atópica grave”, Sanofi, 30.11.2021
- Barbarot S, et al: Epidemiologia da dermatite atópica em adultos: Resultados de um inquérito internacional. Alergia 2018; 73(6): 1284-1293.
PRÁTICA DA DERMATOLOGIA 2021; 31(6): 41-42