O anticorpo monoclonal anti-IL-17A ixekizumab já foi aprovado para o tratamento da psoríase de placa moderada a grave e da artrite psoriásica desde 2016. Em 2020, a espondiloartrite axial (axSpA) foi acrescentada como indicação adicional para a qual o ixekizumab é uma opção terapêutica. Com base no programa de estudo COAST, foi demonstrada a eficácia e tolerabilidade do ixekizumab em pacientes com ou sem pré-tratamento com inibidores de TNF-α.
O anticorpo monoclonal anti-IL-17A ixekizumab já foi aprovado para o tratamento da psoríase de placa moderada a grave e da artrite psoriásica desde 2016. Em 2020, a espondiloartrite axial (axSpA) foi acrescentada como indicação adicional para a qual o ixekizumab é uma opção terapêutica. Com base no programa de ensaios COAST, foi demonstrada a eficácia e tolerabilidade do ixekizumab em pacientes com ou sem pré-tratamento com inibidores de TNF-α [1–4].
Artrite psoriásica
As estratégias terapêuticas aprovadas para a artrite psoriásica (PsA) incluem o uso de AINEs, csDMARD, biólogos (inibidores de TNF, inibidores de IL-12/23 e IL-17, moduladores de células T) e tsDMARDs (inibidores de PDE4, inibidores de JAK). Que agentes são utilizados em que os pacientes são determinados individualmente de acordo com o padrão de manifestação e outros factores (por exemplo, comorbilidades, factores sociais, modo de aplicação e doenças concomitantes).
Com o Colégio Americano de Reumatologia (ACR), a Liga Europeia Contra o Reumatismo (EULAR) e o Grupo de Investigação e Avaliação da Psoríase e Artrite Psoriásica (GRAPPA), estão disponíveis recomendações terapêuticas de três instituições internacionais que fornecem orientações para a prescrição [5]. Como estratégia de primeira linha no tratamento PsA, o uso de anti-inflamatórios não esteróides (AINEs) ainda é aqui recomendado, que pode ser usado no início dos sintomas, mas também antes de o diagnóstico ser confirmado. Nos cuidados diários, deve ser prestada atenção aos riscos gastrointestinais, cardiovasculares e renais específicos da substância. Os glicocorticóides sistémicos (GC), por outro lado, desempenham apenas um papel menor no PsA. No entanto, a injecção intra-articular pode ser considerada para o tratamento de padrões de envolvimento mono ou oligoarticulares ou como um adjunto da terapia existente com terapias anti-reumáticas modificadoras da doença (DMARD). Os DMARD são utilizados após um diagnóstico confirmado e se os sintomas persistirem.
Melhoria significativa já após 6 semanas
O Ixekizumab é indicado no tratamento de PsA em adultos que tiveram uma resposta inadequada ou são intolerantes a um ou mais medicamentos anti-reumáticos modificadores da doença (DMARD), sozinhos ou em combinação com metotrexato. Isto pode levar a uma melhoria significativa das florescências cutâneas com uma quase normalização da estrutura da pele após apenas 6 semanas de terapia. Além disso, foi descrita uma rápida redução da comichão e uma melhoria da qualidade de vida para a substância activa.
Actualmente, tem sido relatada uma melhoria da dor no ixekizumab em pacientes com e sem inflamação mensurável na artrite psoriásica [6]. Tendo previamente demonstrado a eficácia do ixekizumab (IXE) e do adalimumab (ADA) em doentes com psA, com referência às taxas de resposta a ACR50 e PASI(Psoriasis Area and Severity Index)-100 [7,8]O estudo investigou a eficácia da monoterapia IXE ou ADA na redução da dor para além de uma inflamação mensurável em doentes com PsA activa e proteína C reactiva de base baixa (CRP, <5 mg/l).
O estudo SPIRIT-H2H incluiu 95 pacientes de monoterapia. As características de base eram semelhantes entre os dois braços de tratamento. Em pacientes com inflamação persistente baixa (medida pelo CRP), não houve diferença na melhoria da dor articular entre pacientes tratados com IXE e ADA. No entanto, em pacientes com inflamação flutuante, os pacientes tratados com IXE mostraram uma melhoria média numericamente maior na dor articular (EVA) do que os pacientes tratados com ADA na semana 16 (IXE: -31,64, ADA: -25,33). Isto continuou até à semana 52 (IXE: -47,69, ADA: -20,67). A significância a favor da IXE foi medida nas semanas 32 (p=0,0045) e 52 (p=0,0288). Do mesmo modo, os pacientes com melhoria sustentada no inchaço das articulações, bem como melhoria flutuante (avaliada pela SJC) tiveram melhorias médias numericamente maiores nas dores articulares no braço IXE em comparação com os pacientes tratados com ADA a partir da semana 4 e 16, respectivamente, que foram sustentadas até à semana 52.
Esta análise sugere padrões diferenciais de melhoria da dor em pacientes com baixo índice basal de PCR tratados com monoterapia IXE ou ADA, com um resultado mais favorável na redução da dor para pacientes tratados com IXE. Isto é evidente mesmo quando a inflamação, medida pela melhoria do CRP ou SJC, flutua. O estudo apoia assim a hipótese de que a IXE melhora a dor articular em doentes com PsA com e sem inflamação mensurável.
Espondiloartrose axial
A espondiloartrite axial (axSpA) é uma doença inflamatória crónica composta por axSpA não radiológica e axSpA radiológica (r-axSpA). Esta última, também conhecida como espondilite anquilosante (AS), caracteriza-se por dores inflamatórias nas costas e provas radiológicas de danos na articulação sacroilíaca [9]. Estas manifestações, bem como os sinais e sintomas musculoesqueléticos periféricos e extra-articulares, podem contribuir para a limitação da mobilidade, incapacidade progressiva e qualidade de vida reduzida (QoL). Os antirreumáticos modificadores de doenças biológicas (bDMARD), incluindo os inibidores do factor de necrose tumoral (TNFi) e um antagonista da interleucina (IL)-17A, são recomendados para o tratamento de pacientes com axSpA que não respondem ou não podem tolerar medicamentos anti-inflamatórios não esteróides (AINEs). Contudo, até 40% dos pacientes não conseguem um controlo satisfatório da doença com inibidores de TNF [10], e o tratamento com TNFi pode ser contra-indicado em certos pacientes.
A via de sinalização IL-17 desempenha um papel fundamental na patogénese do axSpA. Dois ensaios clínicos aleatórios e controlados de fase 3 (COAST-V e COAST-W) avaliaram a eficácia e segurança do ixekizumab como um anticorpo monoclonal de alta afinidade visando selectivamente a IL-17A durante um período de até 52 semanas em doentes com espondiloartrite axial radiográfica activa (r-axSpA). Os participantes na COAST-V eram bDMARD-naïve, os da COAST-W TNF inibidores-experientes.
No COAST-V, 341 pacientes com r-axSpA activo foram aleatorizados 1:1:1 a 80 mg ixekizumab (IXE) cada 2 ou 4 semanas, placebo ou 40 mg adalimumab (ADA) quinzenalmente. No COAST-W, 316 pacientes receberam 1:1:1 ixekizumab a cada 2 ou 4 semanas ou placebo. Na semana 16, os pacientes que recebiam ixekizumab continuaram o tratamento atribuído, os pacientes em placebo ou ADA foram trocados 1:1 para IXE Q2W ou IXE Q4W até à semana 52.
Boa eficácia e segurança
Ambas as terapias com ixekizumab demonstraram melhorar a actividade da doença, função física, marcadores objectivos de inflamação, qualidade de vida, estado de saúde e função global durante um período de até 52 semanas.
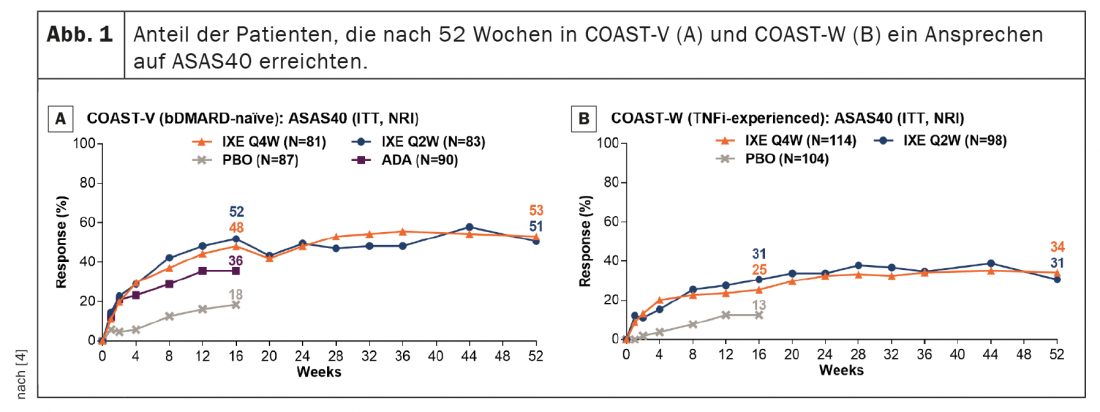
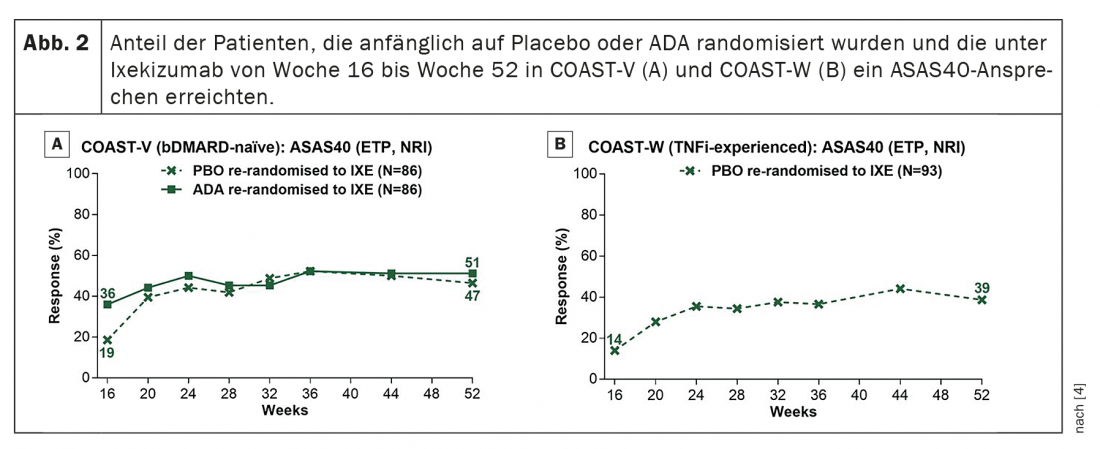
Em pacientes tratados continuamente com ixekizumab, as taxas de resposta ASAS40 persistiram da semana 16 à semana 52 (Fig. 1) . As taxas de resposta ASAS40 na semana 52 foram 53,1% (IXE Q4W) e 50,6% (IXE Q2W) na COAST-V e 34,2% (IXE Q4W) e 30,6% (IXE Q2W) na COAST-W. Os doentes aleatorizados para placebo e aleatorizados para ixekizumab na semana 16 mostraram uma rápida melhoria nas taxas de resposta ASAS40 após a mudança para ixekizumab (Fig. 2); As taxas de resposta na semana 52 (46,5% no COAST-V, 38,7% no COAST-W) foram numericamente semelhantes aos pacientes inicialmente aleatorizados para ixekizumab. No COAST-V, os pacientes aleatorizados para ADA mostraram mais melhorias numéricas nas taxas de resposta ASAS40 (36,0% na semana 16, 51,2% na semana 52) depois de mudarem para ixekizumab (Figura 2A); as taxas de resposta na semana 52 foram numericamente semelhantes aos pacientes inicialmente aleatorizados para ixekizumab.
O EAIR comum para a psoríase foi de 1,0. Um paciente teve um evento cerebrocardiovascular adverso grave (enfarte agudo do miocárdio) e foram relatados dois casos malignos (leucemia promielocítica aguda e cancro da bexiga). Foram comunicadas menos reacções no local de injecção (ISRs) com IXE Q4W (9,2%) do que com IXE Q2W (17,2%). O número de doentes que relatam ISR diminuiu ao longo do tempo. Especificamente, 6,4%, 3,8% e 3,4% dos pacientes em IXE Q4W e 14,3%, 8,6% e 5,2% dos pacientes em IXE Q2W referiram ISR nas semanas 0-12, semanas 12-24 e semanas 24-36, respectivamente. Apenas alguns pacientes (IXE Q4W ≤1%; IXE Q2W aproximadamente 3%) reportaram ISR para além da semana 36.
Em geral, as respostas ao tratamento foram numericamente inferiores em TNFi-experientes em comparação com os pacientes bDMARD-naive, reflectindo uma população mais difícil de tratar, com falha no tratamento anterior e doença mais duradoura [4]. As terapias biológicas actualmente aprovadas para axSpA incluem vários TNFi e um antagonista de IL-17A. Embora apenas estudos comparativos frente a frente possam avaliar completamente a eficácia relativa e segurança de diferentes tratamentos, os resultados do ASAS40 aqui relatados na semana 52 são consistentes com os relatados para TNFi em pacientes que eram bDMARD-naïve e para secukinumab em subgrupos de pacientes que eram bDMARD-naïve ou que tinham anteriormente falhado o tratamento TNFi.
A taxa de descontinuação devido a eventos adversos (EA) foi <4% em ambos os estudos, e os eventos adversos graves (EA) foram notificados por <6% dos pacientes. A maioria das infecções e ISRs eram leves a moderadas. Os ISRs eram mais comuns em IXE Q2W do que em IXE Q4W. Além disso, os ISRs foram mais frequentemente notificados durante as primeiras 4 semanas de tratamento e diminuíram de frequência ao longo do tempo. Durante os períodos de estudo de 52 semanas de COAST-V e COAST-W (n=641), a taxa de incidência conjunta de infecções graves ajustada à exposição por 100 pacientes-ano (EAIR) foi de 2,0 em pacientes tratados com ixekizumab. Os EAIRs agrupados de infecção por Candida e neutropenia de grau 3/4 foram de 1,0 e 0,2, respectivamente. Os EAIRs correspondentes para a doença de Crohn, colite ulcerativa e doença inflamatória intestinal (IBD) (NOS) foram respectivamente 0,8, 0,4 e 0,4 (total IBD EAIR: 1,6). O EAIR para a uveíte anterior (AU) era de 3,9; 15 dos 20 pacientes (75%) tinham um historial de AU e 14 dos 20 pacientes (70%) eram da COAST-W. Foram notificados menos eventos de DEC em IXE Q2W do que em IXE Q4W, e não houve associação aparente entre a duração da exposição a ixekizumab e a DEC. Relatórios anteriores mostraram que o EAIR para AU em pacientes com espondilite anquilosante (AS) varia de 2,6 a 3,5 para pacientes tratados com TNFi [11].
Em resumo, os dados da COAST-V e COAST-W mostram que o ixekizumab alcançou uma melhoria sustentada e clinicamente significativa nos sinais e sintomas de r-axSpA activo durante até 52 semanas. Os resultados de segurança foram consistentes com o perfil de segurança conhecido do ixekizumab. Estes resultados sugerem que o ixekizumab pode ser uma opção de tratamento para o axSpA em pacientes que são bDMARD-naïve ou que tiveram anteriormente uma resposta inadequada ou intolerância aos inibidores de TNF.
Estudo sobre o efeito após a remissão
Os resultados de ensaios aleatórios de descontinuação do inibidor do factor de necrose tumoral (TNF) em doentes com espondiloartrite axial sugerem que a descontinuação do TNFi leva a recaídas na maioria dos doentes e a continuação do tratamento pode ser importante para manter o controlo da doença. No entanto, ainda não foram realizados estudos centrados nos efeitos da continuação versus descontinuação de um antagonista da interleucina (IL)-17A em pacientes com axSpA. COAST-Y é um estudo de acompanhamento de COAST-V e COAST-W. O objectivo deste estudo [12], publicado em 2021, era preencher esta lacuna e investigar a continuação vs. interrupção do tratamento com ixekizumab em doentes com espondiloartrite axial que tinham conseguido a remissão.
No estudo de extensão duplo-cego, controlado por placebo e randomizado da fase 3, os pacientes que tinham completado os ensaios originais de 52 semanas COAST-V, COAST-W ou COAST-X entraram numa fase introdutória de 24 semanas e continuaram ou 80 mg IXE a cada 2 semanas (Q2W) ou 4 semanas (Q4W). Os doentes que obtiveram remissão (ou seja, um Resultado de Actividade de Espondilite Anquilosante (ASDAS) <1,3 pelo menos uma vez na semana 16 ou na semana 20 e <2,1 em ambas as visitas) foram distribuídos aleatoriamente de forma igual na semana 24 para continuar IXE Q4W, IXE Q2W, ou descontinuar no placebo de forma cega. O parâmetro primário foi a proporção de pacientes sem recaída (ASDAS ≥2.1 em duas visitas consecutivas ou ASDAS >3.5 em cada visita) após as 40 semanas de RWRP (período aleatório de retirada-tratamento), sendo o tempo para recaída um parâmetro secundário importante.
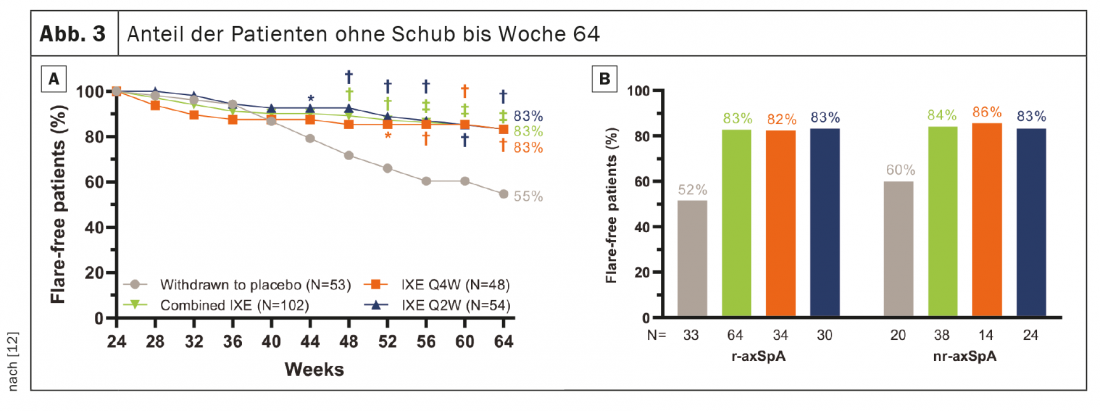
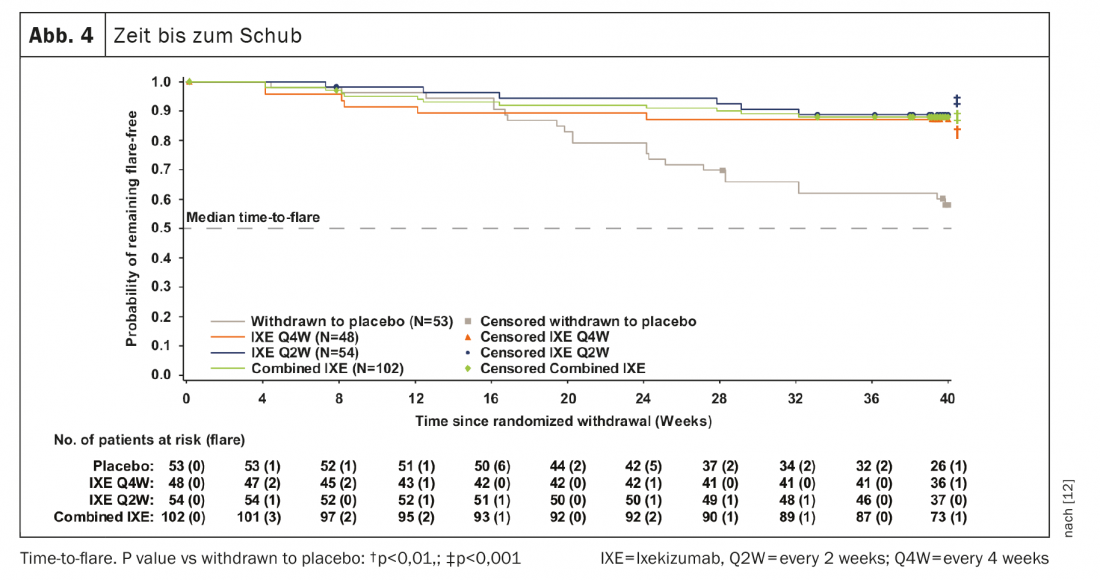
741 pacientes completaram a fase introdutória de 24 semanas e 155 entraram no RWRP. Os objectivos primários e todos os objectivos secundários importantes foram alcançados na semana 64. Quarenta semanas após a retirada aleatória, 83,3% dos pacientes dos grupos combinados permaneceram IXE (85/102, p<0,001), IXE Q4W (40/48, p=0,003) e IXE Q2W (45/54, p=0,001) sem recaídas contra 54,7% no grupo placebo (29/53). (Fig. 3A). A proporção de pacientes sem recaída foi semelhante entre os subgrupos de pacientes com r-axSpA e nr-axSpA (Fig. 3B). A continuação da IXE atrasou significativamente o tempo de recaída em comparação com o placebo, com a maioria dos pacientes a permanecerem livres de recaídas por até 20 semanas após a paragem da IXE (Fig. 4). Que 54,7% dos pacientes que interromperam o placebo permaneceram sem recaídas durante o RWRP foi um valor mais elevado do que em estudos de descontinuação comparáveis de adalimumab (47%) e certolizumab pegol (20,2%). [13–16].
Preditores e segurança
As análises post-hoc identificaram várias características dos doentes associadas à recaída, incluindo a área ASDAS sob a curva, sugerindo que os doentes com doença menos bem controlada tinham mais probabilidades de ter recaído ao longo do tempo do que aqueles cujo controlo da doença era estável. Além disso, a descontinuação da IXE, CRP de base mais elevada e IMC não normal (que era ≥25kg/m2 na maioria dos casos) foram identificados como associados a recidiva. Uma pontuação de dor BASDAI mais elevada na semana 24 foi também associada a recaída em pacientes que continuaram o tratamento com IXE, mas não em pacientes que pararam no placebo.
O RWRP do COAST-Y incluiu pacientes de todo o espectro axSpA com e sem falha TNFi prévia e com duração dos sintomas variando de 1,9 a 44,7 anos (média 12,7 anos) [17]. Não houve preocupações de segurança novas ou inesperadas durante o RWRP. Os eventos adversos emergentes do tratamento (TEAEs) foram notificados em 42,6% (IXE Q4W), 44,4% (IXE Q2W) e 52,8% (desmamados para placebo) dos doentes e foram geralmente de gravidade ligeira a moderada. Dois pacientes (IXE Q2W) interromperam o estudo devido à UE. Foram vistos SUEs em dois (4,3%) pacientes no grupo IXE Q4W (teratoma benigno de células germinativas dos ovários e fractura por compressão), dois (3,7%) pacientes no grupo IXE Q2W (amigdalite crónica e mielopatia num paciente e Clostridium difficile colitis noutro), e um (1,9%) paciente que tinha descontinuado com placebo (inflamação dos tecidos moles). Apenas uma SUE (C. difficile colitis) levou à descontinuação. Não houve mortes nem relatos de reactivação de tuberculose, doença inflamatória intestinal, eventos cardiovasculares adversos graves (MACE) ou malignidade.
Globalmente, estes resultados sugerem que o tratamento contínuo da IXE é importante para a maioria dos pacientes para manter o controlo da doença a longo prazo [12]. Contudo, a longa duração da resposta ao tratamento após a interrupção da IXE sugere que a interrupção temporária do tratamento, por exemplo, durante a infecção ou antes da cirurgia, é pouco provável que conduza a uma recaída na maioria dos pacientes. Estes resultados são importantes para os clínicos quando tomam decisões de tratamento relativas à interrupção do tratamento e à optimização da gestão a longo prazo do axSpA.

Mensagens Take-Home
- O Ixekizumab é aprovado para o tratamento da psoríase em placas moderada a grave, artrite psoriásica e espondiloartrose axial.
- No PsA, o ixekizumab pode levar a uma melhoria significativa das florescências cutâneas após apenas 6 semanas de terapia. Além disso, tem sido relatada uma melhoria da dor em doentes com e sem inflamação mensurável.
- Em pacientes com r-axSpA activo que são bDMARD-naïve ou TNFi-experientes, o ixekizumab é um tratamento eficaz.
- O Ixekizumab pode melhorar a actividade da doença, função física, marcadores objectivos de inflamação, qualidade de vida, estado de saúde e função geral em doentes com r-axSpA durante até 52 semanas.
- Em pacientes com axSpA em remissão, o tratamento contínuo com IXE está associado a uma maior probabilidade de manter um controlo óptimo da doença em comparação com a retirada de IXE.
Literatura:
- Deodhar A, et al: Ixekizumab para pacientes com espondiloartrite axial não radiográfica (COAST-X): um ensaio aleatório, controlado por placebo. Lancet 2020 Jan 4; 395 (10217): 53-64.
- van der Heijde D, et al: Ixekizumab, um antagonista da interleucina-17A no tratamento da espondilite anquilosante ou espondiloartrite axial radiográfica em doentes anteriormente não tratados com drogas anti-reumáticas modificadoras da doença biológica (COAST-V): Resultados de 16 semanas de um ensaio aleatório de fase 3, duplo-cego, controlado activamente e placebo-controlado. Lancet 2018 Dez 8; 392 (10163): 2441-2451.
- Deodhar A, et al: Eficácia e Segurança do Ixekizumab no Tratamento da Espondiloartrose Axial Radiográfica: Resultados de dezasseis semanas de um Ensaio de Fase III Aleatório, Duplo-Blind, Controlado por Placebo em Pacientes com Resposta Prévia Inadequada ou Intolerância aos Inibidores do Factor de Necrose Tumoral. Artrite Rheumatol 2019; 71 (4): 599-611.
- Dougados M, Wei JCC, Landewé R, et al: Eficácia e segurança do ixekizumab durante 52 semanas em duas fases 3, ensaios clínicos aleatórios e controlados em pacientes com espondiloartrite axial radiográfica activa (COAST-V e COAST-W). Ann Rheum Dis 2020; 79: 176-185; doi: 10.1136/annrheumdis-2019-216118.
- Köhm M, Burkhardt H, Behrens F: Estratégias terapêuticas da artrite psoriásica. DMW – Deutsche Medizinische Wochenschrift 2020; 145(11): 773-780; doi: 10.1055/a-0964-0231.
- de Vlam K, Gallo G, Mease P, et al: Ixekizumab mostra um padrão de melhoria da dor em pacientes com e sem inflamação mensurável na artrite psoriásica. Artrite Rheumatol 2021; 73 (suppl 10).
- Mease PJ, Smolen JS, Behrens F, The SPIRIT H2H study group et al: A head-to-head comparison of the efficacy and safety of ixekizumab and adalimumab in biological-naïve patients with active psoriatic artritis: resultados de 24 semanas de um ensaio aleatório, aberto e cego de avaliador. Ann Rheum Dis 2020; 79: 123-131; doi: 10.1136/annrheumdis-2019-215386.
- Smolen JS, Sebba A, Ruderman EM, et al: Eficácia e Segurança do Ixekizumab com ou sem Metotrexato em Pacientes com Artrite Psoriática: Resultados de 52 semanas do Estudo SPIRIT-H2H. Rheumatol Ther 2020; 7: 1021-1035; doi: 10.1007/s40744-020-00250-3.
- Sieper J, Poddubnyy D: Espondiloartrose axial. Lancet 2017; 390: 73-84; doi: 10.1016/S0140-6736(16)31591-4.
- Sepriano A, Regel A, van der Heijde D, et al: Eficácia e segurança dos DMARD biológicos e sintéticos-alvo: uma revisão sistemática da literatura informando a actualização de 2016 das recomendações ASAS/EULAR para a gestão da espondiloartrite axial. RMD Aberto 2017; 3: e000396; doi: 10.1136/rmdopen-2016-000396.
- Deodhar A, Miceli-Richard C, Baraliakos X, et al: Baixa incidência, tanto de recém-nascidos como de crises de uveíte em doentes tratados com espondilite anquilosante com secukinumab: ensaio clínico e análise de segurança pós-comercialização. Ann Rheum Dis 2018; 77(Suppl 2): 999; doi: 10.1136/annrheumdis-2018-eular.4474.
- Landewé RBM, Gensler LS, Poddubnyy D, et al: Continuação versus retirada do tratamento ixekizumab em doentes com espondiloartrite axial que obtiveram remissão: eficácia e resultados de segurança de um estudo de retirada controlado por placebo e aleatorizado (COAST-Y). Ann Rheum Dis 2021; 80: 1022-1030; doi: 10.1136/annrheumdis-2020-219717.
- Landewé RB, van der Heijde D, Dougados M, et al: Manutenção da remissão clínica na espondiloartrite axial precoce após a redução da dose de certolizumab pegol. Ann Rheum Dis 2020; 79: 920-928; doi: 10.1136/annrheumdis-2019-216839.
- Landewé R, Sieper J, Mease P, et al: Eficácia e segurança de continuar versus retirar a terapia adalimumab na manutenção da remissão em doentes com espondiloartrite axial não radiográfica (ABILITY-3): um estudo multicêntrico, aleatório, duplo-cego. Lancet 2018; 392: 134-144; doi: 10.1016/S0140-6736(18)31362-X.
- Haibel H, Heldmann F, Braun J, et al: Eficácia a longo prazo do adalimumabe após a retirada do fármaco e o novo tratamento em pacientes com espondiloartrite axial activa não radiograficamente evidente que experimentam uma erupção. Arthritis Rheum 2013; 65: 2211-2213; doi: 10.1002/art.38014.
- Song IH, Althoff CE, Haibel H, et al: Frequência e duração da remissão sem drogas após 1 ano de tratamento com etanercept versus sulfasalazina na espondiloartrite axial precoce: dados de 2 anos do ensaio ESTHER. Ann Rheum Dis 2012; 71: 1212-1215; doi: 10.1136/annrheumdis-2011-201010.
- Smolen JS, Schöls M, Braun J, et al: Tratamento da espondiloartrite axial e da espondiloartrite periférica, especialmente da artrite psoriásica, para atingir: 2017 actualização das recomendações por uma task force internacional. Ann Rheum Dis 2018; 77: 3-17; doi: 10.1136/annrheumdis-2017-211734.
InFo DOR & GERIATURA 2021; 3(2): 14-18