A terapia de ALK-positivo ou ROS1-positivo NSCLC tem-se desenvolvido consideravelmente nos últimos anos com a disponibilidade de vários inibidores ALK ou ROS1. Nesta CME, as actuais directrizes da OMPE e os dados mais importantes do estudo são resumidos e discutidos.
Com 4300 novos diagnósticos por ano, o carcinoma brônquico é um dos tipos mais comuns de cancro na Suíça [1]. A doença está também associada à maior (21,6%) mortalidade relacionada com o cancro nos homens e a segunda maior (15,7%) nas mulheres após o cancro da mama [1]. O cancro do pulmão de células não pequenas (NSCLC) está presente em 85% dos doentes, mais frequentemente com histologia do adenocarcinoma (40%). Além disso, as fusões de linfoma cinase anaplástica (ALK) podem ser detectadas em cerca de 5% dos tumores e as fusões ROS proto-oncogene 1, receptor de tirosina cinase (ROS1) em cerca de 4,5% [2]. Em comparação com o resto da população, os pacientes com ALK- ou ROS1-positivo NSCLC são mais jovens e mais frequentemente nunca ou poucos fumadores [3,4]. Entretanto, o teste do biomarcador ALK/ROS1 é um componente estabelecido no diagnóstico do NSCLC e constitui uma base necessária para as decisões terapêuticas [5]. Para pacientes com doença metastática (fase IV), o tratamento está no cenário paliativo e visa melhorar os sintomas, pelo menos manter a qualidade de vida e prolongar a sobrevivência global [6]. Com a aprovação dos inibidores ALK da 1. (Crizotinibe), 2. (alectinibe, ceritinibe) e terceira geração (lorlatinibe), a terapia foi revolucionada e personalizada [7]. Nesta CME, as actuais directrizes da OMPE e os dados mais importantes do estudo são resumidos e discutidos. O enfoque aqui é sobre os medicamentos aprovados na Suíça [8].
Terapia de primeira linha
As directrizes da OMPE recomendam o uso de crizotinibe, alectinibe, ceritinibe ou brigatinibe** na primeira linha de terapia (Tab. 1) [5]. No ensaio PROFILE-1014, foi observado um prolongamento significativo da sobrevivência sem progressão mediana (PFS) com crizotinibe em comparação com a quimioterapia com cisplatina ou carboplatina em combinação com pemetrexed (10,9 vs. 7,0 meses, HR 0,45, p>0,001) [13]. As taxas de resposta objectiva (ORR) foram de 74% com crizotinibe e 45% no braço de quimioterapia [13]. Após um período de observação de cerca de 46 meses, o SO mediano no braço do crizotinibe ainda não tinha sido alcançado e era de 47,5 meses com quimioterapia (HR 0,76, p=0,0978). Embora o crizotinibe fosse numericamente superior, não houve diferença estatisticamente significativa no OS entre as armas de tratamento, muito provavelmente devido a efeitos cruzados ou terapias de seguimento muito eficazes após a progressão [14].
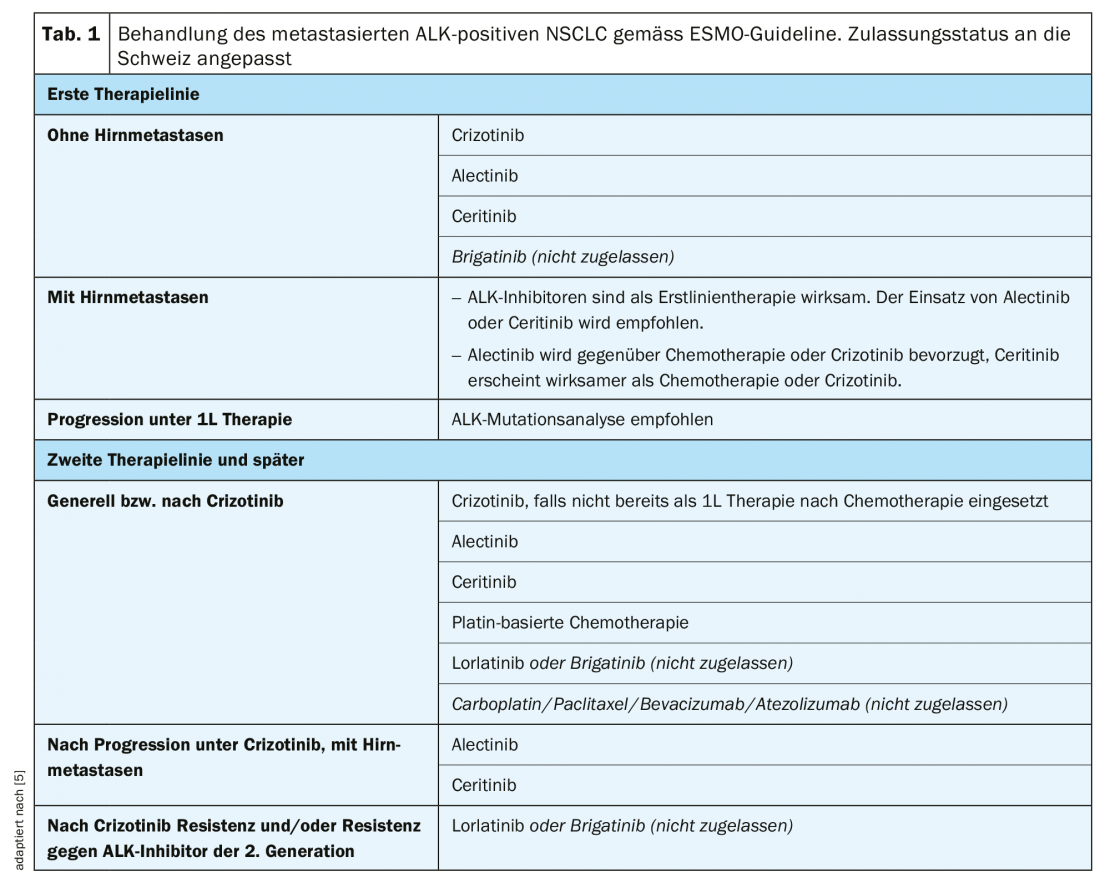
Como outra opção na terapia de primeira linha, o ceritinibe mostrou uma melhoria significativa da mediana PFS (16,6 vs. 8,1 meses, HR 0,55, p<0,00001) em comparação com a quimioterapia à base de platina (cisplatina ou carboplatina mais pemetrexed seguida de terapia de manutenção pemetrexed) no ensaio ASCEND-4 [15]. O SO mediano ainda não tinha sido alcançado com ceritinibe e era de 26,2 meses com quimioterapia (HR 0,73, p=0,056) [15].
O ensaio ALEX comparou a segunda geração do inibidor ALK alectinib com o crizotinibe em pacientes previamente não tratados [16]. O Alectinib mostrou uma mediana PFS significativamente melhorada em comparação com o crizotinibe (não atingido vs 11,1 meses, HR 0,47, p<0,001) [16]. Um resultado semelhante foi também alcançado no ensaio japonês J-ALEX (alectinibe, não alcançado vs crizotinibe, 10,2 meses, HR 0,34, p>0,001) [17]. O Alectinib foi melhor tolerado em ambos os ensaios, com menos interrupções, reduções de dose ou descontinuidades do que o crizotinib [16,17].
Desenvolvimento de mutações de resistência
Praticamente todos os pacientes com ALK-positivo NSCLC experimentam a progressão dentro de um a dois anos de terapia de primeira linha com um inibidor ALK devido a resistência primária ou adquirida [5,18]. Neste contexto, a resistência pode ser devida a alterações específicas de ALK (on-target), tais como mutações ALK ou amplificações de genes ALK, ou a outros mecanismos (off-target), tais como a activação de vias de sinalização alternativas [18].
Cerca de 20% dos pacientes com crizotinibe e mais de metade com um inibidor ALK de segunda geração (alectinibe, ceritinibe) desenvolvem mutações de resistência [18]. O espectro de resistência após a progressão sob crizotinibe difere significativamente daquele sob a segunda geração de inibidores ALK [18] . Por exemplo, a mutação ALK p.G1202R só pode ser detectada em 2% das biópsias resistentes ao crizotinibe, mas ocorre como a mutação de resistência mais comum entre os inibidores ALK de 2ª geração, conferindo assim resistência ao tumor a todos os inibidores ALK de 2ª geração [18]. Cada inibidor ALK também parece estar associado a um espectro específico de mutações de resistência [18]. A 3ª geração de inibidores ALK (lorlatinib e brigatinib) cobre um campo mais vasto de mutações de resistência ALK (incluindo ALK p.G1202R) do que os inibidores ALK mais antigos [18].
Terapia de segunda linha
A escolha da terapia a partir da segunda linha é fortemente influenciada pelas mutações de resistência presentes. Uma análise da mutação do ADN livre e circulante do tumor (ctDNA; a chamada biópsia líquida) ou de uma nova biópsia de tecido deve, portanto, ser utilizada para determinar o mecanismo de resistência em caso de progressão sob um inibidor ALK de 1ª ou 2ª geração [19]. Este procedimento é também sugerido nas directrizes da OMPE como parte do processo de tomada de decisão para a escolha da próxima linha de terapia [5].
Em comparação com a quimioterapia, o crizotinibe melhorou significativamente a mediana PFS (7,7 vs. 3,0 meses, HR 0,49, p<0,001) e ORR (65% vs. 20%) no ensaio PROFILE-1007 em pacientes ingénuos do inibidor ALK, mas pré-tratado com um regime baseado em platina [20]. O Crizotinib é recomendado como a próxima linha de terapia se não tiver sido utilizado antes [5].
Em pacientes pré-tratados com quimioterapia e crizotinibe, foi observada uma melhoria significativa na mediana PFS de 3,8 meses com ceritinibe em comparação com a quimioterapia no ensaio ASCEND-5 (5,4 vs. 1,6 meses, HR 0,49, p<0,0001) [21]. O Alectinib também alcançou uma mediana PFS significativamente prolongada de 9,6 meses em comparação com 1,4 meses com quimioterapia no ensaio ALUR em pacientes após quimioterapia e pré-tratamento do crizotinibe (HR 0,15, p<0,001) [22]. Com base nestes dados, o ceritinibe ou alectinibe são recomendados como terapia de segunda linha após a progressão ou intolerância ao crizotinibe [5].
Terapia em linhas posteriores
Em linhas posteriores de terapia, a escolha dos inibidores ALK disponíveis é normalmente limitada devido às mutações de resistência existentes. Num estudo de fase II, o lorlatinibe inibidor ALK de terceira geração foi testado em pacientes que tinham sido previamente tratados com dois a três inibidores ALK (lorlatinibe de primeira geração). ou 2ª geração , crizotinibe, alectinibe, ceritinibe) com ou sem quimioterapia alcançou um ORR de 38,7% e um PFS mediano de 6,9 meses [23]. Numa análise mais aprofundada, a eficácia do lorlatinib foi investigada no contexto de diferentes mutações de resistência ALK. Após o fracasso do tratamento com crizotinibe, o lorlatinibe demonstrou ser altamente eficaz em pacientes com e sem mutações de resistência ALK [24]. Em contraste, em doentes que tinham recebido anteriormente pelo menos um inibidor ALK, observou-se uma melhoria significativa da eficácia do lorlatinibe na presença de mutações de resistência ALK do que na ausência de mutações de resistência ALK [24]. As mutações de resistência ALK poderiam assim ser utilizadas como biomarcador de resposta à terapia com lorlatinibe após falha sob um inibidor ALK de 2ª geração [24] . Após o desenvolvimento da resistência ao crizotinibe ou aos inibidores ALK de segunda geração, a terapia sequencial com lorlatinibe* ou brigatinibe** é a abordagem preferida de acordo com as directrizes da OMPE [5].
Pacientes com metástases cerebrais
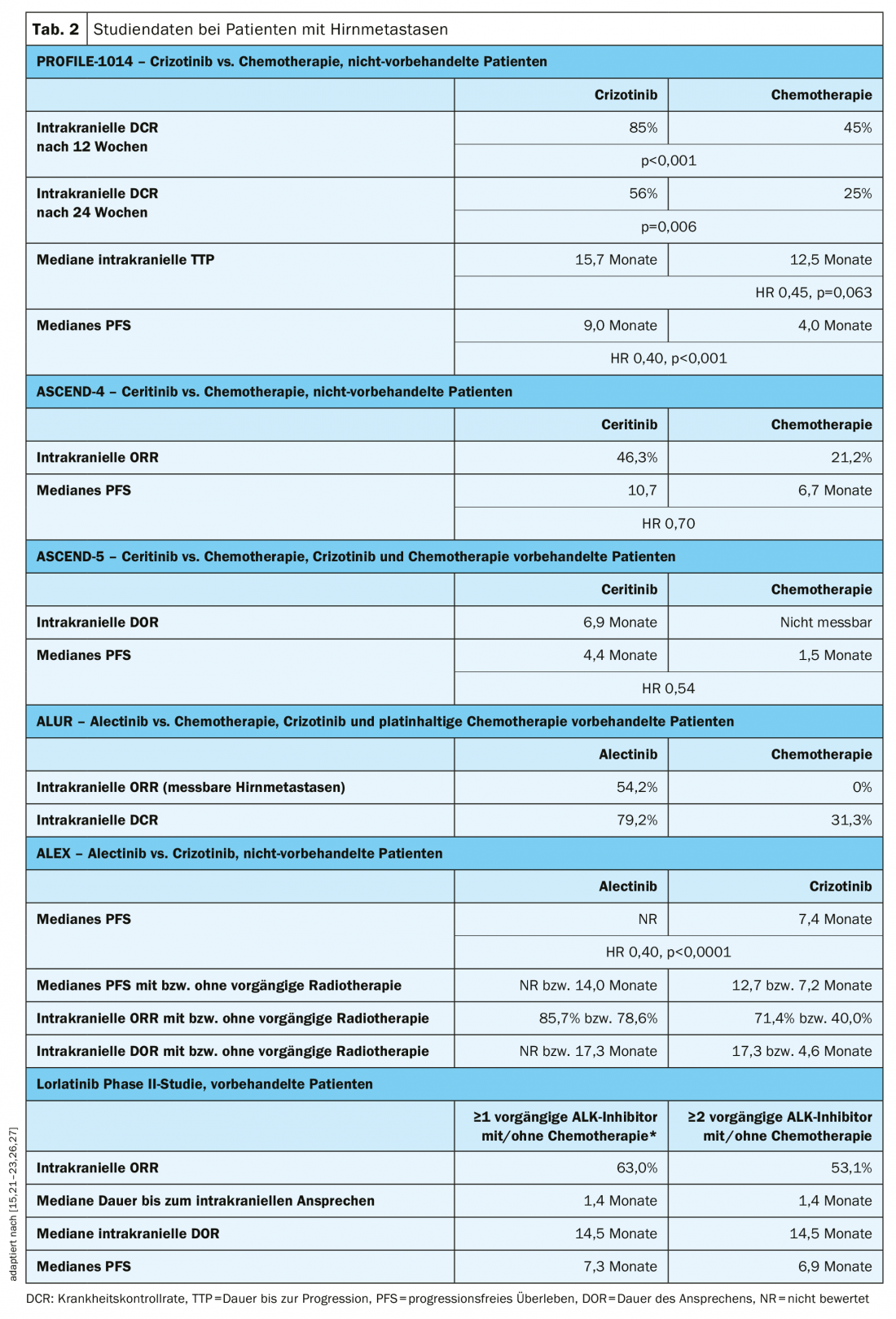
Mais de 20% dos doentes com ALK-positivo NSCLC são diagnosticados com metástases cerebrais no diagnóstico inicial e a incidência aumenta para mais de 50% à medida que a doença progride [25]. Um desafio no tratamento das metástases cerebrais é ultrapassar a barreira hemato-encefálica. Os inibidores ALK da 2ª e 3ª geração mostraram propriedades significativamente melhores a este respeito em comparação com o crizotinib [5,6].
Todos os ensaios com inibidores ALK incluíram pacientes com metástases cerebrais. Uma análise prospectiva dos dados de pacientes com metástases cerebrais no ensaio PROFILE-1014 mostrou que o crizotinib melhorou significativamente as taxas de controlo das doenças intracranianas em comparação com a quimioterapia (Quadro 2) [26]. A duração até à progressão do tumor intracraniano foi prolongada sob crizotinibe, mas a diferença para o braço de quimioterapia não foi estatisticamente significativa (Tab. 2) [26]. Ceritinib melhorou a resposta intracraniana e a PFS mediana em pacientes com metástases cerebrais existentes em comparação com a quimioterapia à base de platina na primeira linha (ensaio ASCEND-4) ou após pré-tratamento com crizotinibe e quimioterapia (ensaio ASCEND-5) (Tabela 2) [15,21]. No estudo ALUR, pacientes com metástases cerebrais mensuráveis após a pré-terapia com crizotinibe conseguiram um ORR intracraniano significativamente mais elevado com alectinibe em comparação com a quimioterapia (tab. 2) [22]. Também como terapia de primeira linha, o alectinibe levou a uma melhoria significativa do PFS mediano em pacientes com metástases cerebrais em comparação com o crizotinibe no estudo ALEX, independentemente de já ter sido administrada radioterapia (separador 2) [27]. No estudo da fase II pivotal, foi observado um ORR intracraniano de 53,1 meses e um PFS mediano de 6,9 meses com lorlatinibe em doentes com metástases cerebrais após pré-tratamento com pelo menos dois inibidores ALK (separador 2) [23].
Perfis de segurança dos inibidores ALK
Embora todos os inibidores ALK possam geralmente ser classificados como seguros, o perfil de segurança dos agentes disponíveis também desempenha um papel importante na escolha da terapia, especialmente se se estiver no ambiente paliativo, como no NSCLC avançado ALK-positivo [28]. O quadro 3 resume os aspectos de segurança mais importantes dos inibidores ALK aprovados na Suíça, de acordo com a informação especializada.
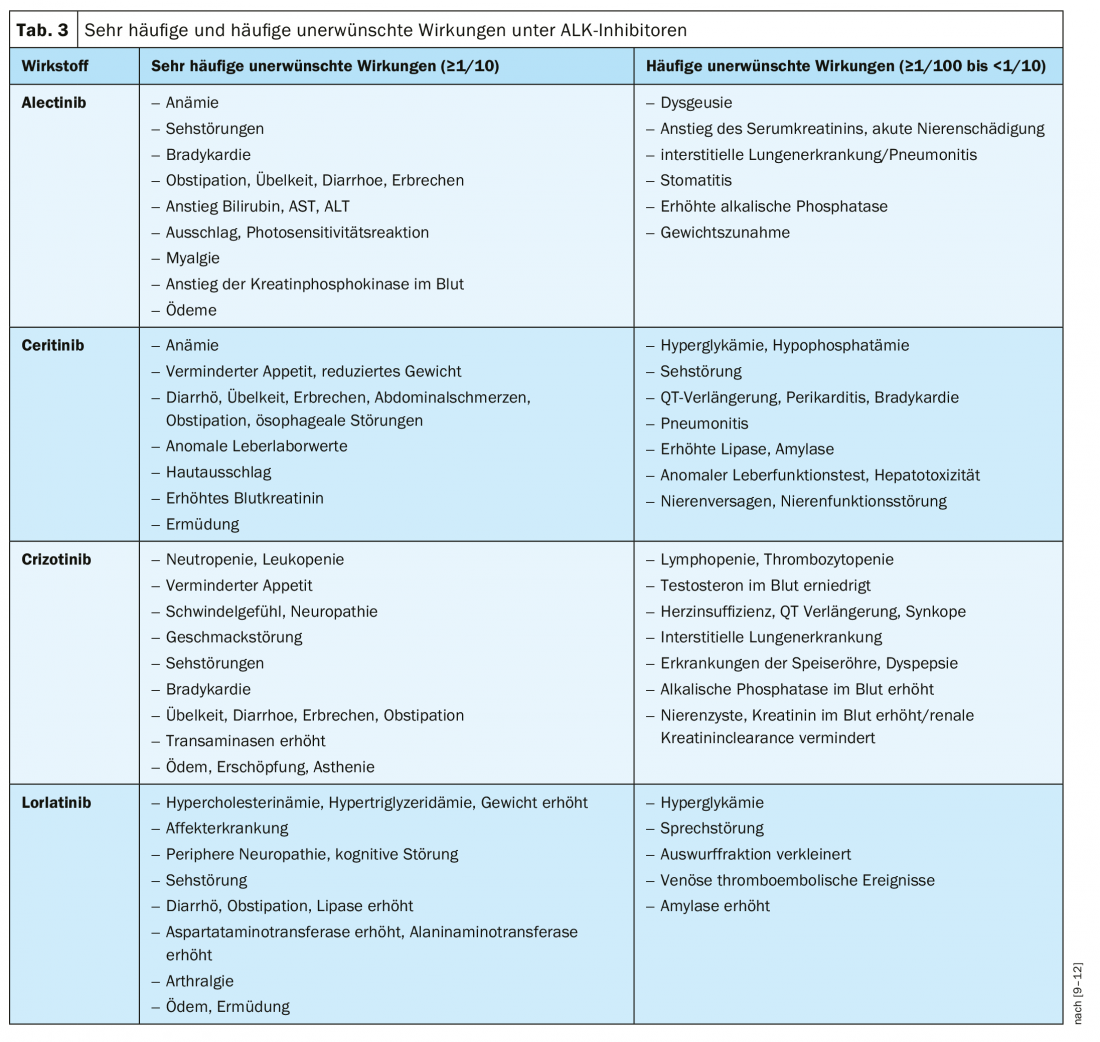
Sequência de inibidores ALK
Com a multiplicidade de inibidores ALK disponíveis, determinar uma sequência terapêutica óptima continua a ser um desafio [29]. Cada inibidor ALK tem características únicas, que incluem penetração do sistema nervoso central, perfil de segurança e espectro de actividade em diferentes mutações de resistência [29].
Para além do estatuto de aprovação dos vários inibidores ALK, os perfis de toxicidade e os factores individuais do paciente também desempenham um papel na escolha da terapia de primeira linha [7]. Uma vez que o crizotinibe foi o primeiro inibidor ALK disponível, a maioria dos dados estão disponíveis para sequências que começam com o crizotinib [29]. Com base nos ensaios clínicos disponíveis, o crizotinibe seguido do alectinib ou ceritinibe pode ter uma PFS mediana de 5,4 a 15,6 meses, uma OS mediana de 14,9 a 26,0 meses e uma ORR de 33,0% a 80,0% [29]. Ainda não estão disponíveis estudos que comparem directamente diferentes sequências de inibidores ALK [29].
O ROS1-positivo NSCLC
ROS1 codifica um receptor de tirosina quinase que é muito semelhante ao ALK [30]. Alguns dos inibidores ALK disponíveis mostram, portanto, uma grande afinidade pela ROS1 e, consequentemente, uma actividade antitumoral em doentes com NSCLC positivo para a ROS1 [31].
O Crizotinib foi o primeiro inibidor ALK também aprovado para o tratamento do NSCLC ROS1-positivo e a sua eficácia neste contexto foi demonstrada em vários estudos prospectivos e retrospectivos [30,32–39]. No estudo da Fase I do PERFILE-1001, foi observado um ORR de 72% com crizotinibe, com 11% dos pacientes a apresentarem uma resposta completa e 60% a apresentarem uma resposta parcial [38]. O PFS mediano era de 19,3 meses e o OS mediano era de 51,4 meses [38]. O perfil de segurança do crizotinib foi comparável ao dos pacientes ALK-positivos do NSCLC [38]. Crizotinib também mostrou uma actividade anti-tumoral significativa no ensaio METROS fase II. O PFS mediano foi de 22,8 meses com um ORR de 65% [32]. Nas directrizes da OMPE, a monoterapia com crizotinibe é recomendada como terapia de primeira ou segunda linha para pacientes com NSCLC de fase IV positivo ROS1 [5]. Depois da terapia de primeira linha com crizotinibe, a quimioterapia à base de platina pode então ser oferecida na segunda linha [5].
Discussão e perspectivas futuras
As opções de tratamento para o NSCLC avançado ALK-positivo estão constantemente a ser expandidas. Os inibidores ALK do Os medicamentos de segunda geração são estabelecidos no ambiente resistente ao crizotinibe e são cada vez mais utilizados na primeira linha de terapia em doentes com doenças avançadas [5]. Com o lorlatinibe como inibidor ALK do A 3ª geração é agora outra opção disponível para pacientes após falha de tratamento com dois inibidores ALK [24]. Além disso, outros inibidores ALK estão em desenvolvimento clínico ou estão prestes a ser aprovados.
Brigatinib ainda não está aprovado na Suíça, mas é mencionado nas directrizes da OMPE como uma opção na primeira linha de terapia. No estudo ALTA-1L, foi observada uma taxa mais elevada de PFS com brigatinibe na primeira linha de terapia (HR 0,49, p<0,001) do que com crizotinib [40]. Os pacientes resistentes a Crizotinib também mostraram um ORR de 45% e 54% e PFS mediano de 9,2 e 12,9 meses, respectivamente, no ensaio ALTA de brigatinibe (90 mg ou 180 mg por dia) [41]. O ORR intracraniano foi de 42% e 67% e o PFS intracraniano mediano foi de 15,6 e 12,8 meses, respectivamente [41].
In vitro, o ensartinibidor inibidor ALK inibiu o crescimento de células NSCLC positivas ALK 10 vezes mais do que o crizotinib [42]. Além disso, num primeiro estudo de detecção da dose, os doentes tratados com uma dose ≥200 mg mostraram uma taxa de resposta (RR) de 60% e uma PFS mediana de 9,2 meses. Em pacientes anteriormente inibidores ALK naïve, foram observados um RR de 80% e um PFS mediano de 26,2 meses [42]. Desde 2016, a eficácia e segurança do ensartinibe em comparação com o crizotinibe tem sido investigada no ensaio eXalt3 de fase aberta (NCT02767804) no inibidor ALK naïve, pacientes com NSCLC positivo para ALK [43].
Para além de várias monoterapias inibidoras de ALK, estão também a ser discutidas opções de combinação com inibidores do ponto de controlo imunitário como opções de tratamento para o NSCLC ALK-positivo. Os dados da fase inicial 1b do ensaio JAVELIN-101 mostraram uma actividade antitumoral promissora (ORR 46,6%) e um perfil de segurança aceitável com o anticorpo monoclonal anti-PD-L1 IgG1 avelumab em combinação com o lorlatinib [44]. A combinação de alectinibe com o anticorpo anti-PD-L1 atezolizumab também alcançou os primeiros resultados positivos num estudo de fase 1b com toxicidade tolerável em doentes previamente não tratados (seguimento mediano de 13 meses, ORR 81%, mediana PFS 21,7 meses). Contudo, no momento da análise, apenas 6 dos 21 pacientes eram progressivos [45].
Outros inibidores ALK/ROS1 também estão actualmente a ser investigados em ensaios clínicos para o NSCLC positivo para ROS1. Num estudo fase I/II, um ORR de 41% (95% CI 29-53) foi alcançado com lorlatinibe em pacientes ROS1-positivos, TKI-naïve ou pré-tratados (n=69) com ou sem metástases do SNC [46]. Foi observada uma resposta objectiva em 62% dos pacientes com TKI-naïve (10% de resposta completa, 52% de resposta parcial), 45% dos pacientes com metástases do SNC e 80% do grupo sem metástases do SNC. O tempo médio de resposta ao primeiro tumor (TTR) foi de 1,4 meses e a duração mediana da resposta (DOR) foi de 25,3 meses (95% CI 7,5-31,9) [46]. O ensaio central de lorlatinibe fase II incluiu uma coorte ROS1-positiva (EXP-6), além de pacientes ALK-positivos (EXP1-5) [23,47]. Com o lorlatinibe, foi observada uma resposta rápida e sustentada neste grupo de doentes, independentemente da pré-terapia com crizotinibe [47]. O ORR global e a PFS mediana foram de 36,2% e 9,9 meses, respectivamente, em pacientes com crizotinibe 61,5% e 21,0 meses, e após a pré-terapia com crizotinibe 26,5% e 8,5 meses, respectivamente [47]. Lorlatinib só é aprovado na Suíça para o tratamento do ALK-positivo NSCLC [9].
Outro composto a ser avaliado é o potente inibidor entrectinibe ROS1 como uma opção de tratamento no NSCLC avançado positivo da ROS1. A análise integrada de três ensaios fase I/II (ALKA-372-001, STARTRK-1, STARTRK-2) mostrou um ORR de 77% e PFS mediano de 26 e 14 meses em pacientes sem e com metástases cerebrais, respectivamente [48]. Entrectinib mostrou uma boa tolerabilidade e um perfil de segurança controlável [48].
Globalmente, a situação do tratamento de pacientes com ALK-positivo ou ROS1-positivo NSCLC melhorou muito nos últimos anos. Contudo, são necessários mais estudos, por exemplo para responder a perguntas sobre a sequência óptima de inibidores ALK. Com as aprovações esperadas de outras substâncias, as opções terapêuticas serão também mais alargadas no futuro.
Mensagens Take-Home
- Na Suíça, os inibidores ALK crizotinib (1ª geração), alectinib e ceritinib (2ª geração) e lorlatinib (3ª geração) são aprovados para o tratamento do NSCLC avançado ALK-positivo.
- O uso de crizotinibe, alectinibe ou ceritinibe é recomendado como terapia de primeira linha para o NSCLC ALK-positivo. Alectinibe ou ceritinibe são preferidos para as metástases cerebrais existentes.
- Aproximadamente 20% dos pacientes com crizotinibe e mais de 50% com alectinibe ou ceritinibe desenvolvem mutações de resistência. O espectro de resistência dos inibidores ALK varia.
- Após o desenvolvimento de resistência sob crizotinibe, o alectinibe ou ceritinibe é recomendado como a próxima linha de terapia.
- Lorlatinib cobre um campo mais vasto de mutações de resistência do que os inibidores ALK do 1. e 2ª geração e é portanto utilizada após a progressão sob alectinibe ou ceritinibe.
- Crizotinib é recomendado como terapia de primeira ou segunda linha para ROS1-positivo NSCLC.
* Lorlatinib é aprovado na Suíça após a progressão sob pelo menos dois inibidores ALK.
** Brigatinib não é aprovado na Suíça.
Literatura:
- Krebsliga Schweiz – O cancro na Suíça: figuras importantes. A partir de Dezembro de 2018.
- Carcinoma Pulmonar de Células Não Pequenas. My Cancer Genome www.mycancer genome.org/content/disease/não-células pequenas-carcinoma pulmonar. Último acesso: 15.10.2019.
- Shaw AT, et al: Características clínicas e resultados de pacientes com cancro do pulmão não pequeno que albergam EML4-ALK. Journal of clinical oncology: revista oficial da Sociedade Americana de Oncologia Clínica, 2009. 27(26): 4247-4253.
- Davare MA, et al: Percepção estrutural dos perfis de selectividade e resistência dos inibidores de tirosina quinase ROS1. Actas da Academia Nacional das Ciências dos Estados Unidos da América, 2015. 112(39): E5381-E5390.
- Planchard D, et al: Metastatic non-small cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol, 2019. 30(5): 863-870.
- Griesinger F, et al.: Metástases cerebrais em ALK-positivo NSCLC – tempo para ajustar algoritmos de tratamento actuais. Oncotarget, 2018. 9(80): 35181-35194.
- Ziogas DC, et al: Tratamento do cancro do pulmão não-positivo ALK-positivo de células pequenas. Annals of translational medicine, 2018. 6(8): 141-141.
- Lista de medicamentos para uso humano autorizados. www.swissmedic.ch/swissmedic/de/home/services/listen_neu.html#-257211596. Último acesso 02.03.2020.
- Informação técnica actual Lorviqua® (lorlatinib). Estado da informação: Janeiro de 2020. www.swissmedicinfo.ch.
- Resumo actual do Xalkori® (crizotinib) das características do produto. Estado da informação: Outubro de 2018. www.swissmedicinfo.ch.
- Informação técnica actual Alecensa® (alectinib). Estado da informação: Abril de 2018. www.swissmedicinfo.ch.
- Informação técnica actual Zykadia® (ceritinib). Estado da informação: Maio de 2019. www.swissmedicinfo.ch.
- Solomon, BJ, et al: Crizotinib de primeira linha versus quimioterapia no cancro do pulmão positivo ALK. New England Journal of Medicine, 2014. 371(23): 2167-2177.
- Solomon BJ, et al: Final Overall Survival Analysis from a Study Comparing First-Line Crizotinib Versus Chemotherapy in ALK-Mutation-Positive Non-Small-Cell Lung Cancer. J Clin Oncol, 2018. 36(22): 2251-2258.
- Soria JC, et al: ceritinibe de primeira linha versus quimioterapia à base de platina em cancro do pulmão avançado não de pequenas células ALK (ASCEND-4): um estudo aleatório, de rótulo aberto, fase 3. Lancet, 2017. 389(10072): 917-929.
- Peters S, et al: Alectinib versus crizotinib em Câncer de Pulmão Não-Positivo de Pequenas-Células ALK não tratado. New England Journal of Medicine, 2017. 377(9): 829-838.
- Hida T, et al: Alectinib versus crizotinibe em doentes com cancro do pulmão não-positivo de pequenas células ALK (J-ALEX): um ensaio de fase 3 aberto e aleatorizado. Lancet, 2017. 390(10089): 29-39.
- Gainor JF, et al: Molecular Mechanisms of Resistance to First- and Second-Generation ALK Inhibitors in ALK-Rearranged Lung Cancer. Cancer discovery, 2016. 6(10): 1118-1133.
- McCusker MG, et al: Como trato o cancro do pulmão não-positivo ALK-positivo de células pequenas. ESMO Open, 2019. 4(Suppl 2): e000524.
- Shaw AT, et al: Crizotinib versus quimioterapia no cancro do pulmão avançado ALK-positivo. N Engl J Med, 2013. 368(25): 2385-2394.
- Shaw, A.T., et al: Ceritinibe versus quimioterapia em doentes com cancro do pulmão de células não pequenas previamente tratados com quimioterapia e crizotinibe ALK (ASCEND-5): um ensaio aleatório, controlado, de rótulo aberto, fase 3. Lancet Oncol, 2017. 18(7): 874-886.
- Novello S, et al: Alectinib versus quimioterapia em linfoma anaplásico pré-tratado com crizotinibe (ALK) – cancro do pulmão não-pulmão de células pequenas positivo: resultados do estudo ALUR fase III. Anais de oncologia : revista oficial da Sociedade Europeia de Oncologia Médica, 2018. 29(6): 1409-1416.
- Solomon BJ, et al: Lorlatinib em doentes com cancro do pulmão não-positivo de pequenas células ALK: resultados de um estudo global da fase 2. Lancet Oncol, 2018.
- Shaw AT, et al: ALK Resistance Mutations and Efficacy of Lorlatinib in Advanced Anaplastic Lymphoma Kinase-Positive Non-Small-Cell Lung Cancer. Journal of Clinical Oncology, 2019. 37(16): 1370-1379.
- Rangachari D, et al.: Metástases cerebrais em doentes com cancros pulmonares de células não pequenas modificados por EGFR ou ALK. Cancro do pulmão (Amsterdão, Países Baixos), 2015. 88(1): 108-111.
- Solomon BJ, et al: Intracranial Efficacy of Crizotinib Versus Chemotherapy in Patients With Advanced ALK-Positive Non-Small-Cell Lung Cancer: Results From PROFILE 1014. J Clin Oncol, 2016. 34(24): 2858-2865.
- Gadgeel S, et al: Alectinib versus crizotinibe em linfoma anaplásico naïfoma kinase-positivo (ALK+) não-pulmonar de pequenas células: resultados da eficácia do CNS do estudo ALEX. Anais de oncologia: revista oficial da Sociedade Europeia de Oncologia Médica, 2018. 29(11): 2214-2222.
- Zhu Q, et al: Análises de segurança combinadas do inibidor ALK-TKI em ALK-positivo NSCLC. Cancro BMC, 2017. 17(1): 412-412.
- Barrows SM, et al: Revisão sistemática da sequência de inibidores ALK no cancro do pulmão não-positivo de pequenas células ALK. Lung Cancer (Auckland, N.Z.), 2019. 10: 11-20.
- Michels S, et al: Segurança e Eficácia do Crizotinib em Pacientes com Cancro Pulmonar ROS1 Avançado ou Metástático (EUCROSS): Um ensaio clínico europeu de Fase II. Journal of Thoracic Oncology, 2019. 14(7): 1266-1276.
- Sehgal K, et al: Atingir rearranjos ROS1 no cancro do pulmão de células não pequenas com crizotinibe e outros inibidores da cinase. Translational cancer research, 2018. 7(Suppl 7): S779-S786.
- Landi L, et al: Crizotinib em MET desregulamentado ou ROS1 rearranjado cancro de pulmão não de pequenas células (METROS) pré-tratado: um ensaio fase II, prospectivo, multicêntrico, de dois braços. Clinical Cancer Research, 2019.
- Liu C, et al: Crizotinib em Pacientes Chineses com Cancro do Pulmão Avançado Não-Pulmonar de Pequenas Células ROS1 na Prática Clínica de Rotina. Targeted oncology, 2019: 1-9.
- Masuda K, et al: Eficácia e segurança do crizotinibe em doentes com cancro do pulmão de células não pequenas ROS1 rearranjado: uma análise retrospectiva. Journal of thoracic disease, 2019. 11(7): 2965.
- Mazières J, et al: Crizotinib therapy for advanced lung lung adenocarcinoma and a ROS1 rearrangement: results from the EUROS1 cohort. Journal of clinical oncology, 2015. 33(9): 992-999.
- Moro-Sibilot D, et al: Crizotinib em c-MET- ou ROS1-positivo NSCLC: resultados do ensaio AcSé fase II. Anais de Oncologia, 2019.
- Park S, et al: Características e resultados dos doentes não-positivos de cancro do pulmão com ROS1 na prática clínica de rotina. Journal of Thoracic Oncology, 2018. 13(9): 1373-1382.
- Shaw A, et al: Crizotinib em ROS1-rearranjado cancro do pulmão avançado não de pequenas células (NSCLC): resultados actualizados, incluindo sobrevivência global, do PERFIL 1001. Annals of Oncology, 2019. 30(7): 1121-1126.
- Wu YL., et al: Estudo de fase II do crizotinib em doentes do Leste Asiático com cancro do pulmão avançado não pequeno de células ROS1-positivo. Journal of Clinical Oncology, 2018. 36(14): 1405-1411.
- Camidge DR, et al: Brigatinib versus crizotinib em ALK-câncer de pulmão não pequeno de células positivas. New England Journal of Medicine, 2018. 379(21): 2027-2039.
- Kim DW, et al: Brigatinib em Pacientes com Linfoma Linfoma Crizotinib-Refractário Anaplásico Kinase-Positivo Não-Celular de Câncer de Pulmão: Um ensaio aleatório, Multicêntrico Fase II. J Clin Oncol, 2017. 35(22): 2490-2498.
- Horn L, et al: Ensartinib (X-396) in ALK-Positive Non-Small Cell Lung Cancer: Results from a First-in-Human Phase I/II, Multicenter Study. Clinical cancer research: an official journal of the American Association for Cancer Research, 2018. 24(12): 2771-2779.
- Horn L, et al: eXalt3: Um estudo fase III do ensartinibe (X-396) no linfoma cinase anaplásico (ALK) – cancro do pulmão não pequeno positivo (NSCLC). Journal of Clinical Oncology, 2017. 35(15_suppl): TPS8578-TPS8578.
- Shaw AT, et al: Avelumab (anti-PD-L1) em combinação com crizotinib ou lorlatinib em pacientes com NSCLC previamente tratado avançado: resultados da fase 1b de JAVELIN Lung 101. Journal of Clinical Oncology, 2018. 36(15_suppl): 9008-9008.
- Kim DW, et al: Segurança e actividade clínica resultam de um estudo fase Ib do alectinib plus atezolizumab em ALK+ NSCLC avançado (aNSCLC). Journal of Clinical Oncology, 2018. 36(15_suppl): 9009-9009.
- Shaw AT, et al: Lorlatinib em cancro de pulmão avançado ROS1-positivo não de pequenas células: um ensaio multicêntrico, de rótulo aberto, de braço único, fase 1-2. Lancet Oncol, 2019. 20(12): 1691-1701.
- Ou S, et al: OA02.03 Clinical Activity of Lorlatinib in Patients with ROS1 Advanced Non-Small Cell Lung Cancer: Phase 2 Study Cohort EXP-6. Journal of Thoracic Oncology, 2018. 13(10): S322-S323.
- Barlesi F, et al: Entrectinib em ROS1 fusion-positive non-small cell lung cancer (NSCLC) localmente avançado ou metastático: análise integrada de ALKA-372-001, STARTRK-1 e STARTRK-2. Ann Oncol., 2019. 30(suppl_2):109O.
InFo ONCOLOGY & HEMATOLOGY 2020; 8(2): 14-20 (publicado 23.4.20, antes da impressão).