Os ensaios clínicos intervencionais podem ser divididos em fases I, II e III. Até agora, tudo bem. Mas o que é que isso significa realmente exactamente? Aqui está uma breve actualização para todos aqueles que não estão directamente envolvidos na investigação clínica e cujo tempo de estudo é um pouco mais longo.
Cada estudo de intervenção – ou seja, qualquer estudo em que os participantes recebem uma forma activa de tratamento – pode ser atribuído a uma fase específica de desenvolvimento da intervenção em teste, por exemplo, o medicamento em teste (Tab.1). Em particular, o objectivo é proteger os participantes no estudo de possíveis efeitos adversos e permitir que a intervenção seja caracterizada com a maior precisão possível em diferentes temas. A propósito, isto não tem nada a ver com aleatorização, nem todos os ensaios da fase III são automaticamente um ensaio aleatorizado controlado.
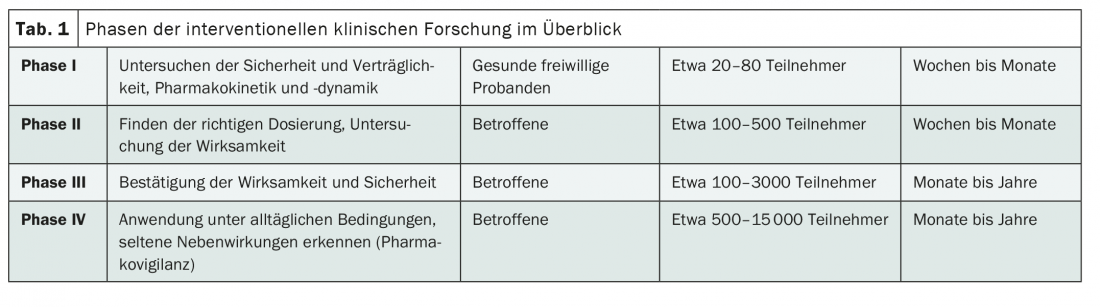
Passo a passo de I a III
Classicamente, o teste pré-clínico de uma intervenção é seguido – como o nome sugere – por um teste de fase I. A intervenção ou droga é testada em humanos pela primeira vez. O foco aqui é testar a compatibilidade [1]. Normalmente, uma fase I do estudo envolve algumas dezenas de voluntários saudáveis. A farmacocinética e a farmacodinâmica em doses diferentes são estudadas em pormenor. Desta forma, os resultados iniciais sobre os efeitos secundários nos seres humanos e as dosagens adequadas devem ser recolhidos [1].
Só na segunda fase é que o foco é a eficácia. Isto envolve pessoas com a doença pela primeira vez, o que torna indispensável a cooperação entre empresas farmacêuticas e organizações de investigação clínica com clínicas. Normalmente estão incluídos cerca de 100 a 500 pacientes – com ou sem um grupo de controlo, com ou sem cegueira [1].
Em ensaios clínicos muito maiores, os ensaios de fase III, a intervenção é então idealmente testada em vários milhares de pacientes. Está a ser testada se a eficácia e a tolerabilidade podem ser reproduzidas numa grande população estudada. As análises de subgrupos também são importantes aqui, pois podem fornecer informações sobre quais os pacientes que beneficiam particularmente – e quais tendem a beneficiar menos – da intervenção. Os ensaios da Fase III são frequentemente estudos comparativos com as terapias existentes e/ou placebo [1]. Estes são também os mais significativos. Quanto mais avançado for o desenvolvimento de uma intervenção e quanto maior for o estudo, mais importante é planear com bastante antecedência. Os pontos finais têm de ser determinados e a avaliação estatística tem de ser tão precisa quanto possível. Isto porque, por exemplo, normalmente não é possível alcançar a recolha de dados de mais de 1000 pacientes.
Dependendo da intervenção e da doença, os ensaios da fase III podem ser difíceis de realizar. Este é o caso de doenças muito raras, entre outras. Há também casos em que os estudos aleatórios controlados de fase III são dificilmente justificáveis do ponto de vista ético – por exemplo, se uma elevada eficácia clínica for já aparente na 2ª fase . Devido a este problema, os fármacos são repetidamente aprovados antes da conclusão dos ensaios correspondentes da fase III, que é actualmente um tema quente em oncologia. Muitas vezes, a inclusão num ensaio clínico é a única forma de obter acesso a um medicamento (não aprovado). Por um lado, isto pode salvar vidas, mas é também uma lotaria – e um motivo para encaminhar tais pacientes para centros especializados que participam em ensaios clínicos. Globalmente, o caminho da fase I do julgamento até à aprovação é longo e tem uma probabilidade de sucesso de pouco menos de 10%. E isto reduz para metade a 5,1% no desenvolvimento de medicamentos contra o cancro. A maioria dos ensaios são interrompidos na fase II [2].
Não deve ser esquecido: Fase 0 e IV
Embora o desenvolvimento clínico se concentre geralmente na fase I-III, os ensaios das fases 0 e IV desempenham também um papel importante na inovação médica. Enquanto os estudos da fase 0 envolvem a investigação de material humano, os estudos da fase IV têm lugar após a aprovação do mercado. Estes últimos estão, por conseguinte, limitados a indicações, dosagens e formas de administração aprovadas. Entre outras coisas, o tamanho da população permite a detecção de efeitos secundários raros [3].
Literatura:
- Fase clínica. www.interpharma.ch/themen/fuhrend-in-forschung-entwicklung/der-weg-eines-medikaments/klinische-phase-phase-i-ii-iii (último acesso 21.11.2021).
- Thomas DW, et al.: Clinical Development Success Rates 2006-2015. www.bio.org/sites/default/files/legacy/bioorg/docs/Clinical%20Development%20Success%20Rates%202006-2015%20-%20BIO,%20Biomedtracker,%20Amplion%202016.pdf (letzter Zugriff am 21.11.2021).
- Fases de estudo. www.dimdi.de/dynamic/de/glossar/glossareintrag/Studienphasen (último acesso 21.11.2021).
- Que tipos de ensaios clínicos existem? www.viomedo.de/posts/welche-arten-von-klinischen-studien-gibt-es (último acesso 21.11.2021).
InFo ONCOLOGy & HEMATOLOGy 2021; 9(6): 42











