“Moldar juntos o futuro” foi o lema do congresso de urologia deste ano. Porque os cuidados de saúde devem continuar a desenvolver-se. Não são apenas os colegas no campo da urologia que são procurados. A gestão interdisciplinar é indicada a fim de desafiar os desafios das doenças e de se concentrar mais na individualização, especialmente no campo da uro-oncologia.
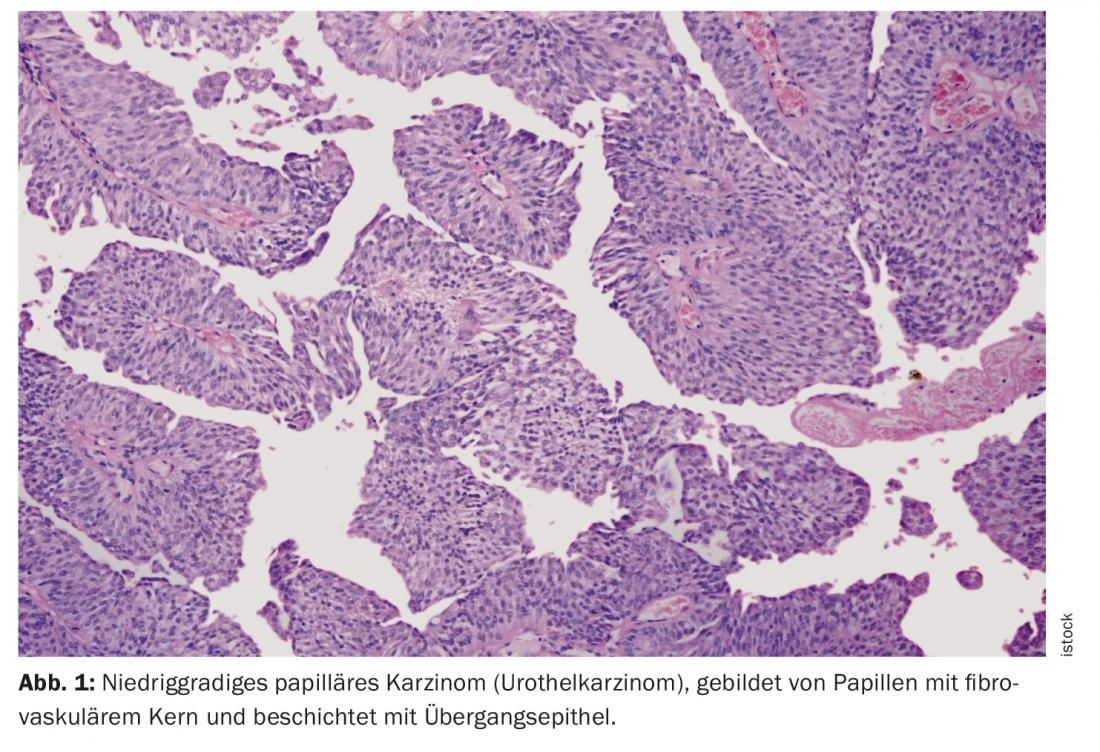
Um tópico da DGU tratava da individualização cada vez maior da terapia do paciente, especialmente no campo da uro-oncologia. Aqui, a acção conjunta de equipas interdisciplinares de urologistas, oncologistas, radioterapeutas, radiologistas, patologistas e, se necessário, de outras disciplinas especializadas é necessária para optimizar os cuidados ao paciente. O carcinoma urotelial avançado (UC) em particular continua a colocar grandes desafios aos profissionais. UC é uma forma de cancro da bexiga. O carcinoma tem origem no urotelium, a camada epitelial que reveste o tracto urinário. Mais de 90% de todos os carcinomas urotélicos afectam a bexiga urinária. Também pode ocorrer na pélvis renal, ureter ou uretra.
O principal factor de risco para o desenvolvimento do cancro da bexiga é o tabagismo activo e passivo [1]. O risco de doença aumenta com a duração e a quantidade de exposição. Além disso, as aminas aromáticas têm um efeito cancerígeno [2]. A exposição profissional costumava desempenhar um papel relevante, especialmente na indústria química, construção e serviços de saúde. Hoje em dia, tais substâncias foram largamente eliminadas da vida profissional quotidiana. No entanto, como o período de latência entre a exposição e o diagnóstico é, em média, de cerca de 38 anos, ainda hoje existem casos com esta etiologia. Além disso, a radioterapia local, a pioglitazona antidiabética e alguns poluentes do ar e da água também podem aumentar o risco de doença [1].
Tratamento do carcinoma urotelial
Os tumores superficiais podem ser ressecados transurecionalmente (TUR), requerendo por vezes uma ressecção para remover todo o tecido tumoral [2]. Dependendo da classificação do tumor e da classificação do risco de crescimento agressivo, são recomendadas instilações adicionais com Bacillus Calmette-Guérin (BCG) ou agentes quimioterápicos para a profilaxia de recorrência. Os tumores de crescimento invasivo devem ser submetidos a cistectomia. Se necessário, é administrada radiação adicional e/ou neoadjuvante ou quimioterapia adjuvante [2]. Na fase de metástase, a cistectomia não é normalmente realizada – o padrão de cuidados na primeira linha de tratamento é depois a quimioterapia contendo cisplatina. Mas as quimioterapias à base de platina atingem frequentemente os seus limites. Por um lado, 30 a 50 por cento dos pacientes não são adequados para tal. Por outro lado, apesar das elevadas taxas de resposta, geralmente só conseguem uma sobrevivência global (OS) limitada. O SO mediano com cisplatina/gemcitabina é de 7,7 meses e com carboplatina/gemcitabina 5,8 meses [3–5]. A opção com inibidores de ponto de controlo também não traz o resultado desejado. O SO mediano após imunoterapia é de 15,9 meses [2,6]. Assim, a imunoterapia não é normalmente eficaz na primeira linha, e é normalmente demasiado tarde para os doentes passarem para uma segunda linha onde a imunoterapia poderia ser utilizada. Apenas cerca de um terço dos doentes recebe tratamento de segunda linha [7–9]. É portanto indicada uma terapia de manutenção eficaz.
Terapia de manutenção de primeira linha com o padrão de cuidados
Se o cancro não tiver progredido após a quimioterapia à base de platina, o inibidor PD-L1 avelumab está disponível para a terapia de manutenção de primeira linha. Em combinação com os melhores cuidados de apoio (BSC), o tratamento leva a uma SO prolongada e à sobrevivência sem progressão (PFS) – mesmo a longo prazo, como demonstram os resultados de um recente seguimento a longo prazo do ensaio de JAVELIN Bladder 100 [10,11]. O estudo multicêntrico, multinacional, randomizado, aberto, fase III incluiu 700 pacientes com carcinoma urotelial localmente avançado ou metastático após quimioterapia contendo platina. Randomizados numa proporção de 1:1, receberam avelumab 10 mg/kg IV a cada quinzena e BSC ou BSC sozinhos. Após dois anos, as taxas de OS eram de 49,8% no grupo combinado contra 38,4% só no grupo do BSC. As taxas PFS a 2 anos foram de 23,4% vs. 7,1%. A resposta dos pacientes à quimioterapia anterior não teve influência sobre o efeito da terapia de manutenção. Os eventos adversos mais comuns relacionados com o tratamento (TEAEs) foram infecções do tracto urinário, diarreia e dores articulares. No entanto, estas só levaram a uma interrupção da terapia num pequeno número das pessoas afectadas. O perfil de segurança aceitável e a eficácia do tratamento com avelumab foram confirmados pelos resultados iniciais da prática diária [12]. Após um período médio de observação de 13,5 meses, os primeiros resultados do estudo AVENANÇA não intervencionista demonstram a actividade clínica e a segurança mesmo numa população de doentes heterogénea. Foram observadas taxas de OS de 66,9% e de PFS de 36,9%.
Carcinoma da próstata – prognóstico e previsão
De acordo com as directrizes clínicas da National Comprehensive Cancer Network (NCCN), os pacientes com cancro da próstata localizado podem ser classificados como de baixo, intermédio e alto risco com base nos seus resultados clínicos. Os doentes intermediários e de alto risco com cancro da próstata localizado são frequentemente tratados com radioterapia de feixe externo definitivo (EBRT) em combinação com terapia de privação de androgénio (ADT). Vários grandes estudos de coorte fase III mostraram que a combinação de ADT e EBRT pode melhorar significativamente a mortalidade específica do cancro da próstata (PCSM), as taxas de metástase distante (DM) e de recorrência bioquímica (BR). A medição dos níveis séricos de antigénio específico da próstata (PSA) é um método bioquímico valioso para a despistagem do cancro da próstata, monitorização da resposta ao tratamento e detecção da recorrência da doença. O nível de nadir do antigénio específico da próstata (nPSA) demonstrou predizer BR, DM, mortalidade por causas específicas (CSM) e mortalidade por todas as causas (OM) após radioterapia (RT). Além disso, há cada vez mais provas de que as medições de PSA limitadas no tempo em pacientes submetidos à EBRT definitiva são preditores precoces independentes de BR e DM. Contudo, o valor prognóstico da nPSA em pacientes com cancro da próstata tratados simultaneamente com ADT e EBRT continua a não ser claro. O objectivo de um estudo era determinar se um limiar de nPSA de 0,06 ng/ml 12 meses após o tratamento pode servir como preditor precoce de sobrevivência sem recorrência bioquímica (BRFS), PCSM e sobrevivência global (SO) em pacientes com cancro da próstata tratados com ADT e EBRT simultâneos.
Retrospectivamente, foram avaliados os dados clínicos de 338 pacientes com cancro de próstata intermédio e de alto risco. A dose mediana de radiação era de 76 Gy, o nível mediano de PSA de base era de 17 ng/ml (intervalo 1-228 ng/ml), e a duração mediana do ADT era de 24 meses (intervalo 6-167 meses). O nível mediano do PSA 1 mês após o EBRT era de 0,06 ng/ml (intervalo 0-25,6 ng/ml). O tempo médio de seguimento foi de 5 anos. A análise multivariada mostrou que o nPSA era um factor independente e significativo associado ao SO, PCSM e BRFS. Além disso, o tempo para nPSA12 foi um preditor independente de PCSM e BRFS. A irradiação pélvica foi também significativamente associada a pior OS e PCSM. Além disso, a idade (≤70 ou >70 anos) e a duração da terapia hormonal (6 meses, 1-3 anos ou >3 anos) foram significativamente associadas ao SO e PCSM, respectivamente. Em alto risco, nPSA e nPSA12 foram preditores independentes do BRFS. Um nível de nPSA12 de >0,06 ng/ml pode prever independentemente pior PCSM e BRFS em pacientes com cancro da próstata de risco intermédio e de alto risco submetidos a EBRT e ADT. Em alto risco, nPSA >0,06 ng/mL e nPSA12 >0,06 ng/mL podem prever de forma independente um BRFS pior [13].
Cancro do rim – benefícios de sobrevivência através da inibição do ponto de controlo imunitário
O cancro do rim é uma malignidade comum com mais de 430.000 novos casos em todo o mundo em 2020 e cerca de 180.000 mortes. O carcinoma de células renais (CCR) é responsável pela maioria dos cancros renais (90-95%), sendo o CCR de células claras o subtipo histológico mais comum. Cerca de 30% dos casos de CCR são diagnosticados numa fase avançada ou metastática e quase 80% destes doentes têm um risco intermédio ou fraco, de acordo com os critérios do International Metastatic renal cell cancerase Database Consortium (IMDC). O carcinoma das células renais caracteriza-se pela inactivação do gene supressor do tumor von Hippel-Lindau, levando a uma alta expressão do factor de crescimento endotelial vascular proangiogénico (VEGF).
Até há pouco tempo, a terapia de primeira linha para o RCC avançado consistia principalmente no uso de inibidores de tirosina quinase (TKIs). Estes visam o receptor do factor de crescimento endotelial vascular (VEGF), entre outros. A exploração de novos regimes terapêuticos focalizou-se na utilização de múltiplas TKIs em combinação com anticorpos monoclonais que inibem directamente VEGF e actuam como inibidores do Alvo Mamífero da Rapamicina. Pensa-se que os inibidores dos receptores VEGF e VEGF têm efeitos imunomoduladores e também promovem a infiltração das células imunitárias devido ao seu efeito nos vasos tumorais. Enquanto que a terapia com um único agente de crescimento endotelial vascular tem sido a base do tratamento, os dados de vários ensaios da fase III que investigaram combinações de inibidores do ponto de controlo imunitário (ICIs) como tratamento de primeira linha mostraram um benefício de sobrevivência significativo. Numa revisão, seis ensaios da fase III mostraram benefícios significativos para as combinações ICI em comparação com o sunitinibe. Nivolumab mais ipilimumab melhoraram significativamente a sobrevivência global (mediana 47,0 versus 26,6 meses) e a sobrevivência sem progressão (mediana 11,6 versus 8,3 meses) em doentes do Consórcio Internacional de Carcinoma Metástático de Células Renais de Risco Intermédio e de baixo risco. A sobrevivência global foi também significativamente melhorada com combinações de inibidores de ICI e tirosina quinase, independentemente do risco, incluindo pembrolizumabe mais axitinibe ou lenvatinibe e nivolumabe mais cabozantinibe. Não foram detectados novos sinais de segurança [14].
Congresso: 74º Congresso da Sociedade Alemã de Urologia (DGU)
Literatura:
- Instituto Robert Koch, Cancro na Alemanha para 2017/2018. 13ª edição, capítulo 3.25 Bexiga urinária.
- S3 Guideline Early Detection, Diagnosis, Therapy and Follow-up of Urinary Bladder Cancer 2020. Disponível em linha em www.awmf.org/leitlinien/detail/ll/032-038OL.html.
- Von der Maasse H, et al: J Clin Oncol 2000; 18(17): 3068-3077.
- Von der Maasse H, et al: J Clin Oncol 2005; 23(21): 4502-4608.
- De Santis M et al. J Clin Oncol 2012; 30(2): 191-199.
- Carcinoma da Bexiga (Carcinoma Urotelial) da Directriz DGHO. Disponível online em www.onkopedia.com/de/onkopedia/guidelines/blasenkarzinom-urothelkarzinom/@@guideline/html/index.html.
- Aly A, et al: J Med Econ 2019; 22(7): 662-670.
- Cheeseman S, et al: Front Oncol 2020; 10: 167.
- Niegisch G, et al: J Cancer 2018; 9(8): 1337-1348.
- Powles T, et al: Abstract 487. Apresentado em ASCO GU 2022
- Powels T, et al: N Engl J Med 2020; 383: 1218-1230.
- Barthělěmy P, et al: Poster 1757P. Apresentado no Congresso da ESMO de 2022.
- Cetin IA, Akay SU, Sengoz M: O antigénio específico da próstata nadir no prazo de 1 ano de radioterapia combinado com terapia hormonal prevê mortalidade específica do cancro e sobrevivência sem recorrência bioquímica em doentes com cancro da próstata. BMC Urol 2022; 22(1): 182.
- Lalani AKA, Heng DYC, Basappa NS, et al: Paisagem em evolução da terapia combinada de primeira linha no cancro renal avançado: uma revisão sistemática. Ther Adv Med Oncol 2022; 14: 17588359221108685.