A doença cardiovascular (DVC) continua a ser a principal causa de morte a nível mundial. Directrizes recentes sobre a prevenção de HKE destacam a medida em que o colesterol lipoproteico de baixa densidade (LDL-C) é um dos mais importantes contribuintes para o HKE aterosclerótico. Por conseguinte, é indicada uma redução eficaz do LDL-C.
A doença cardiovascular (DVC) continua a ser a principal causa de morte a nível mundial [1]. As últimas estatísticas da Organização Mundial de Saúde (OMS) mostram que 17,9 milhões de pessoas morrem anualmente de HKE em todo o mundo, o que corresponde a uma estimativa de 32% de todas as mortes. Destes, cerca de 85% são devidos a enfartes do miocárdio (ataques cardíacos) e acidentes vasculares cerebrais.
Directrizes recentes sobre a prevenção de HKE destacam a medida em que o colesterol lipoproteico de baixa densidade (LDL-C) é um dos mais importantes contribuintes para a aterosclerose HKE [2]. Como os níveis elevados de CLDL respondem à diminuição farmacológica, as directrizes europeias e norte-americanas relevantes para a dislipidemia apresentaram objectivos de tratamento em diferentes categorias de doentes para enfatizar a necessidade de uma diminuição benéfica do CLDL em doentes com alto risco de HKE ou doentes com HKE existente. As estatinas foram estabelecidas como o padrão de ouro para o tratamento do colesterol na prevenção primária e secundária durante quase duas décadas. Nos últimos anos, o ezetimibe tem sido o segundo medicamento adicionado ao tratamento com estatina. O Ezetimibe inibe a absorção do colesterol do intestino e, assim, proporciona uma redução adicional do colesterol LDL.
Apesar do sucesso das estatinas, os dados do registo mostram que as terapias actualmente disponíveis são subutilizadas. O estudo NOR-COR (NORwegian CORonary) publicado em 2017 mostrou que em doentes que sobreviveram a um enfarte agudo do miocárdio (ataque cardíaco), 57% tinham níveis de colesterol LDL acima de 1,8 mmol/l; 22% acima de 2,5 mmol/l; e 10% acima de 3,0 mmol/l, num momento entre 2 e 36 meses após o ataque cardíaco [3]. No estudo POLASPIRE, realizado em 2017-2018 como parte do ensaio EUROASPIRE V, os valores-alvo para o LDL-C foram alcançados por apenas 20% das mulheres e 25% dos homens [4]. De acordo com as directrizes actuais, estes doentes devem visar um nível de LDL-C de 1,4 mmol/l ou inferior [2]. Atingir as recomendações actuais para concentrações ainda mais baixas de LDL-C é um grande desafio na prática clínica.
Os grupos particulares de doentes de alto risco incluem aqueles com hipercolisão familiar-te-rin-emia (FH). Devido aos níveis elevados de colesterol desde o nascimento, os doentes com FH têm um risco muito mais elevado de HKE do que aqueles com hipercolesterolemia tardia [5]. A maioria dos doentes com FH não atingem os seus objectivos de tratamento com o LDL-C. Num grupo norueguês de pessoas, 25% dos pacientes em prevenção primária e apenas 8% dos pacientes em prevenção secundária atingiram objectivos de CLDL inferiores a 2,5 mmol/l e inferiores a 1,8 mmol/l, respectivamente, em tratamento principalmente com estatinas e ezetimibe [6]. Tal como na prevenção secundária, as directrizes conjuntas da Sociedade Europeia de Cardiologia (ESC) e da Sociedade Europeia de Aterosclerose (EAS) de 2019 para a gestão da dislipidemia baixaram significativamente os objectivos de tratamento da FH para LDL-C <1,8 mmol/l na prevenção primária e <1,4 mmol/l na prevenção secundária, salientando a necessidade de novas opções de tratamento [7].
Outro problema na cardio-logia preventiva é o risco residual de eventos recorrentes em pacientes com HKE estabelecido, apesar das terapias preventivas actuais. Recentemente, foi reconhecido o papel das lipoproteínas ricas em triglicéridos no desenvolvimento da aterosclerose e da HKE [7]. Estas partículas podem mediar a acumulação de colesterol dentro da íntima arterial e desencadear processos pró-inflamatórios. Embora os fibratos tenham propriedades significativas de redução dos triglicéridos, o seu sucesso na redução dos eventos cardiovasculares é limitado, levando ao interesse em medicamentos que modificam ou reduzem os riscos cardiovasculares associados a estas lipoproteínas. Outro factor que aumenta o risco residual é o aumento da concentração de lipoproteína(a) [Lp(a)]. Lp(a) é uma partícula genética do tipo LDL caracterizada pela adição de apolipoproteína(a) [apo(a)] a uma partícula à base de apolipoproteína B100. Até 20% da população tem níveis que podem aumentar o seu risco de HKE. As grandes terapias de redução de lípidos têm pouco efeito nas concentrações de Lp(a), mas estão a ser desenvolvidas novas terapias baseadas no género que visam especificamente o apo(a).
No artigo seguinte, iremos rever as provas para os principais agentes lipídicos que foram recentemente introduzidos ou estão ainda em desenvolvimento, na sequência da introdução de estatinas e ezetimibe.
Inibidor da subtilisina/kexina tipo 9 (PCSK9) da proproteína convertase
O PCSK9 é uma enzima que se expressa em muitos tecidos e células. Liga-se ao receptor LDL nas membranas hepatócitas, que visa o receptor para a degradação intracelular nos lisossomas. Os receptores LDL que não estão ligados ao PCSK9 podem ser recirculados mais de 100 vezes. O bloqueio do PCSK9 leva a um aumento dos receptores LDL funcionais, ao aumento do transporte de partículas LDL do espaço extracelular para o espaço intracelular e, portanto, a uma diminuição da concentração de LDL-C no sangue (Fig. 1). Os dois primeiros inibidores PCSK9, alirocumab e evolocumab, foram aprovados pela Agência Europeia de Medicamentos (EMA) e pela Food and Drug Administration (FDA) em 2015 como injecções uma vez em cada quinzena ou uma vez por mês. Uma meta-análise recente em pacientes com HKE aterosclerótico mas não FH, envolvendo 66 478 pacientes em 39 ensaios controlados aleatorizados, concluiu que os inibidores PCSK9 conseguiram uma redução do LDL-C de cerca de 60%. Esta redução foi associada a um menor risco de enfarte do miocárdio (risco relativo [RR], 0,80; intervalo de confiança de 95% [KI], 0,74-0,86; p<0,0001), AVC isquémico (RR, 0,78; 95% CI, 0,67-0,89; p=0,0005), e revascularização coronária (RR, 0,83; 95% CI, 0,78-0,89; p<0,0001), em comparação com os valores de controlo. Contudo, os efeitos da inibição do PCSK9 na mortalidade por todas as causas e morte cardiovascular não foram estatisticamente significativos durante o período de observação mediano de 2,3 anos; um período de tempo que pode ter sido demasiado curto para demonstrar efeitos na mortalidade. O estudo mais recente PCSK9, um seguimento de um dos maiores ensaios da fase III, teve um período de observação de 8,4 anos e mostrou uma redução significativa de 23% da mortalidade cardiovascular em comparação com o placebo [8]. A utilização destes inibidores PCSK9 não foi associada a um aumento do risco de eventos adversos neurocognitivos, aumento dos níveis de enzimas hepáticas, rabdomiólise ou diabetes mellitus new-onset [8].
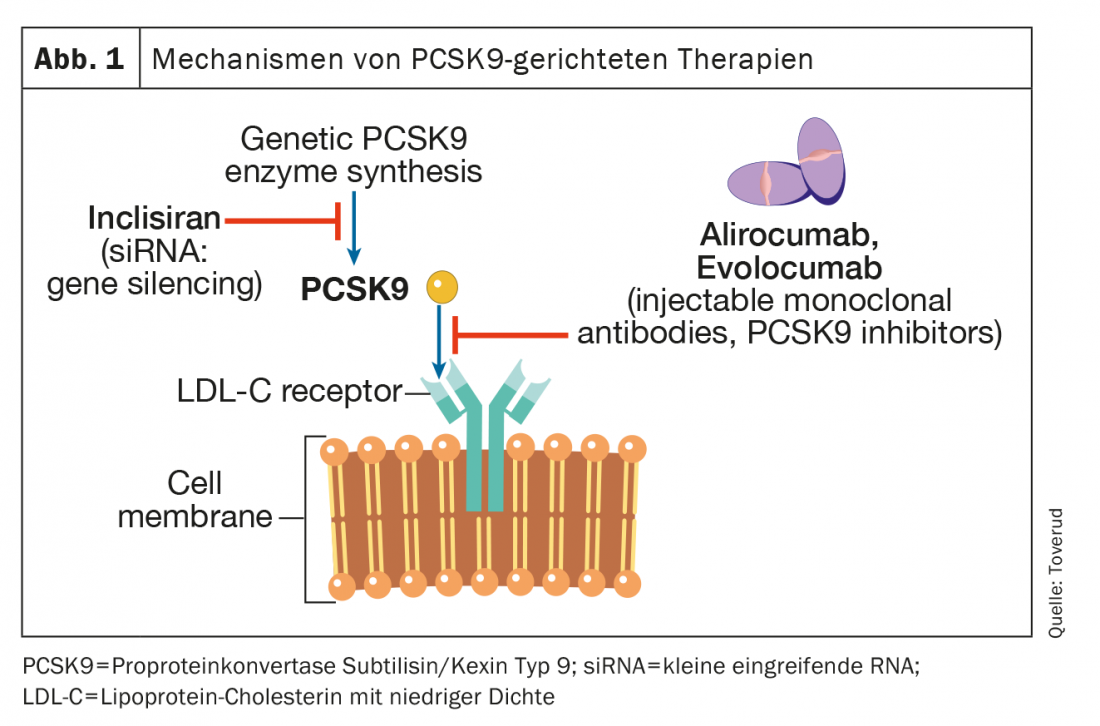
Em ensaios aleatórios e duplo-cegos de alirocumab e evolocumab em doentes com FH heterozigótico em terapia de redução de lípidos estáveis, principalmente com estatinas e ezetimibe, as concentrações de LDL-C foram reduzidas em 50-60 para cerca de 1,8 mmol/l [9,10]. Cerca de 60% dos doentes podem atingir objectivos de tratamento com LDL-C abaixo de 1,8 mmol/l [8,9]. Os resultados dos ensaios de tratamento a longo prazo com alirozumabe e evolocumabe com rótulo aberto têm sido encorajadores, com níveis sustentados de CLDL mais baixos, baixas taxas de descontinuação devido a efeitos secundários e baixa prevalência de anticorpos antidroga [11,12]. Na rara condição de FH homozigotos (ou seja, mutações causadoras de FH herdadas de ambos os pais), pouca ou nenhuma actividade residual do receptor LDL permanece. Portanto, os medicamentos que actuam através da upregulação de receptores LDL, incluindo estatinas e ezetimibe, têm um efeito limitado. Os inibidores PCSK9 também upregulam os receptores LDL, mas em pacientes homozigotos de FH que têm alguma função residual do receptor LDL, os inibidores PCSK9 podem ser eficazes em diferentes graus [13,14].
Inclisiran
Inclisiran (Leqvio®) é um pequeno RNA interferente (siRNA) que inibe a tradução da proteína PCSK9 (Fig. 1) . Três ensaios que registaram doentes com FH heterozigótico ou HKE existente investigaram a eficácia deste fármaco, para além das estatinas [15]. O principal desfecho nestes ensaios foi a redução dos níveis de LDL-C, e o medicamento ou placebo foi administrado subcutaneamente na linha de base e nos meses 3, 9 e 15. Globalmente, a redução dos níveis de LDL-C foi de cerca de 45%. Até agora, nenhum estudo documentou um benefício para a morbidade ou mortalidade, mas estes estão em curso. A Inclisiran foi aprovada para comercialização pela EMA em 2020 e pela FDA em 2021. Curiosamente, o National Institute for Health and Care Excellence (NICE) no Reino Unido endossou a sua utilização na prática geral no Reino Unido, mesmo antes da publicação de quaisquer estudos de resultados. Uma das vantagens do Inclisiran é a sua farmacocinética, que leva a uma redução permanente das concentrações de LDL-C. O Inclisiran é administrado a 0 e três meses e depois duas vezes por ano, o que garante um melhor cumprimento (aderência à terapia). Por outro lado, os possíveis acontecimentos adversos podem persistir, mas o seu perfil de segurança permanece excelente até à data. Em todos os estudos, o Inclisiran foi utilizado juntamente com um tratamento comprovado de redução de lípidos.
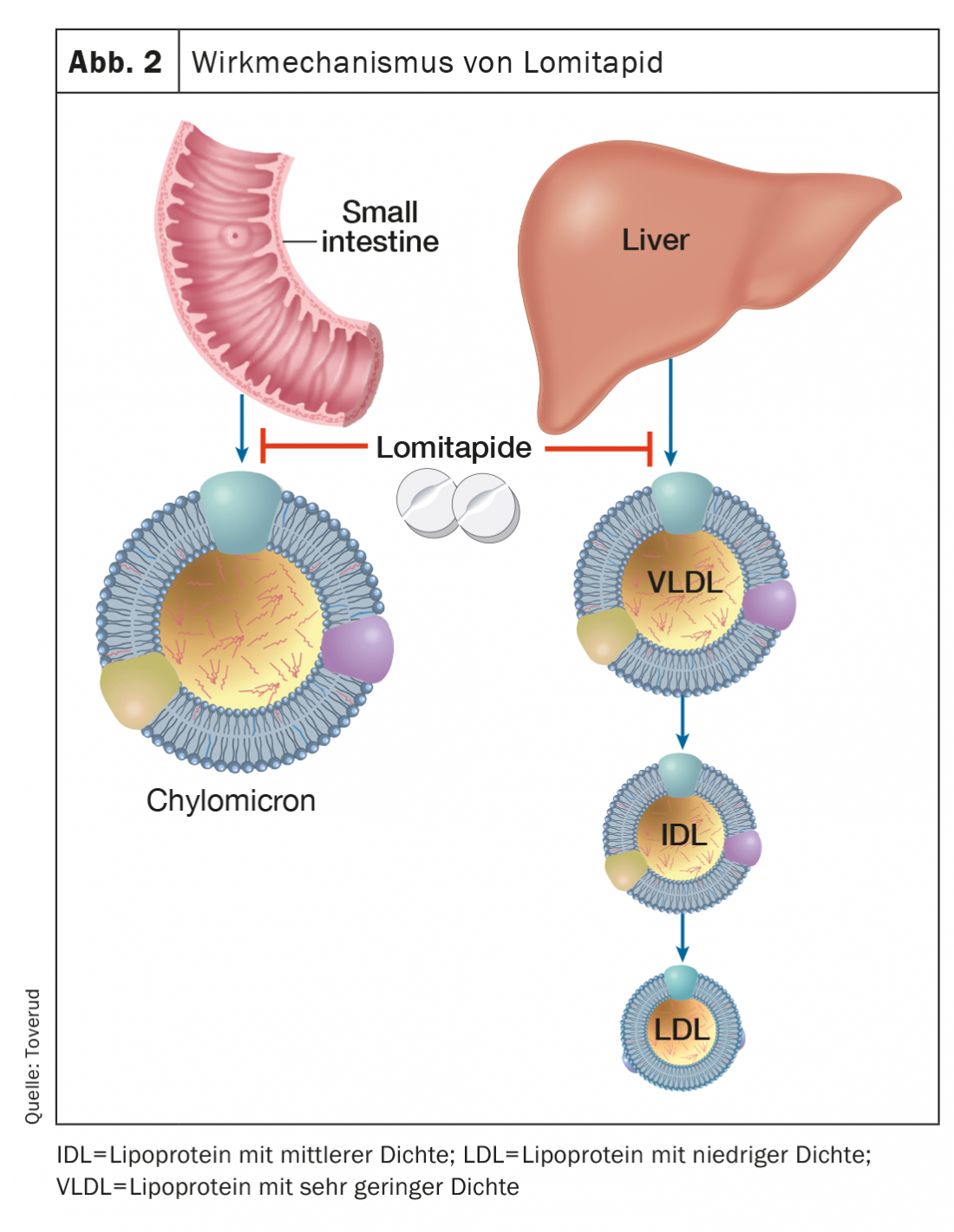
Lomitapide
A lomitapida, um inibidor da proteína de transferência dos triglicéridos microssomais, inibe a formação da apolipoproteína B, que contém lipoproteínas no intestino e no fígado, e assim baixa o LDL-C sérico, independentemente dos receptores LDL (Fig. 2). As concentrações de LDL-C dependentes da dose podem ser reduzidas em cerca de 50% [16]. O tratamento adicional com lomitapida pode prolongar os intervalos entre a aférese LDL em pacientes seleccionados e motivados com FH homozigotos. Os efeitos secundários incluem distúrbios gastrointestinais, aumento das enzimas hepáticas e aumento da gordura hepática. Lomitapide (Lojuxta®) foi aprovado em 2013 para o tratamento de FH homozigotos em adultos. Por outro lado, os custos são muito elevados, o que limita a disponibilidade.
Ácido bempedóico
O ácido bempedóico é aprovado na União Europeia (Nilemdo®) e nos Estados Unidos (Nexletol®) para o tratamento da hipercolesterolemia. Como pró-fármaco, o ácido bempedóico requer activação por uma cadeia muito longa acyl- CoA synthetase-1, que se expressa principalmente no fígado (mas não no músculo esquelético). O metabolito activo inibe a adenosina trifosfato citrato lisase, uma enzima essencial na via de síntese do colesterol a montante da 3-hidroxi-3-metilglutaril-CoA reductase (Fig. 3) . Tal como as estatinas, a inibição da síntese do colesterol leva à upregulação dos receptores LDL e, portanto, à eliminação de partículas LDL. Com uma meia-vida de 15-24 horas, o ácido bempedóico pode ser administrado oralmente uma vez por dia. Como monoterapia, o ácido bempedóico reduziu as concentrações de LDL-C até 25% (subtraído por placebo) em doentes com valores de base de 3,4-5,7 mmol/l [17].
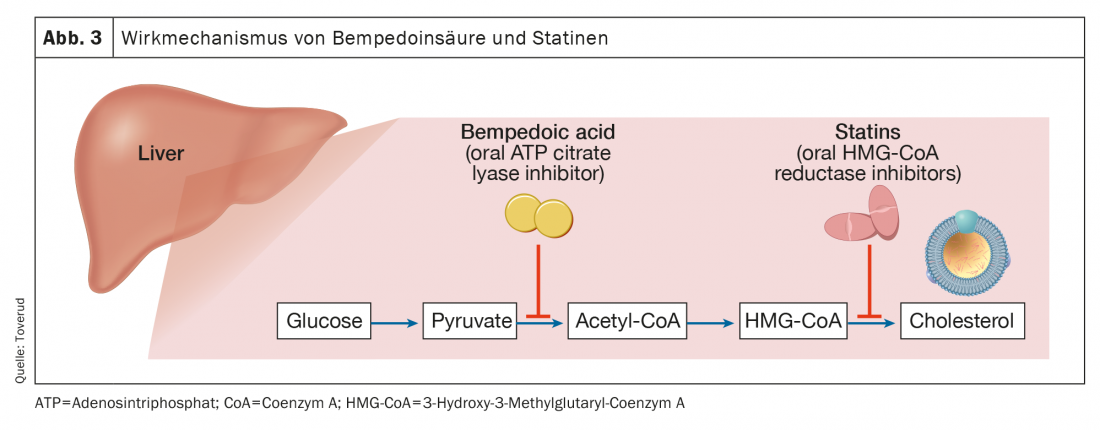
Como mencionado anteriormente, surgiu a necessidade de alcançar maiores reduções no LDL-C do que as alcançadas apenas com estatinas, e o ácido bempedóico pode desempenhar um papel. Nos doentes que recebem terapia com estatinas de fundo, cujos níveis de colesterol LDL se mantiveram entre 3,0 e 5,7 mmol/l, o ácido bempedóico 180 mg diários reduziu ainda mais o colesterol LDL em ~20%, apesar de visar a mesma via de biossíntese de colesterol que as estatinas, mas através de diferentes enzimas [18]. As taxas de eventos adversos, incluindo sintomas relacionados com os músculos, foram semelhantes às do placebo [19]. Do mesmo modo, em doentes com doença cardiovascular aterosclerótica ou FH ou ambos cujos níveis de colesterol LDL permaneceram >1,8 mmol/l com terapia lipídica maximamente tolerada (incluindo estatina), foram observadas reduções no colesterol LDL de 17-18 [20]. Num estudo paralelo de doentes semelhantes com níveis de colesterol LDL >2,6 mmol/l no seu primeiro exame, observou-se uma redução correspondente em que os doentes não precisavam de tomar uma estatina para participar no estudo [21]. Os efeitos secundários comuns do ácido bempedóico são o aumento do ácido úrico [20,21] e um aumento da gota [21,22]. Numa recente meta-análise [21] foi indicada uma tendência para o agravamento da função renal.
Nos últimos anos, surgiu a necessidade de gerir os lípidos em doentes que não podem tolerar estatinas. Enquanto os ensaios controlados aleatórios mostram baixas taxas de sintomas musculares, os dados observacionais sugerem que até um terço dos doentes tratados com estatina relatam uma intolerância absoluta ou incapacidade de tomar doses adequadas para cumprir os objectivos do LDL-C [22]. Num número considerável de pacientes, os sintomas que são considerados efeitos secundários das estatinas são provavelmente efeitos nocebo. Estudos em doentes com sintomas relacionados com os músculos durante a terapia com estatina mostram que a maioria das pessoas é incapaz de distinguir as fases da terapia com placebo das fases da terapia com estatina [23,24]. Os estudos foram orientados para a utilização de ácido bempedóico em doentes com intolerância às estatinas [25] e como terapia complementar ao ezetimibe [26]. Em doentes com intolerância à estatina, os níveis de LDL-C de 4,1 mmol/l, dos quais 21% foram observados [25]. Num estudo de doentes intolerantes à estatina que tomavam ezetimibe, um terço dos quais estava a tomar uma dose baixa de estatina, as concentrações de LDL-C foram reduzidas em >28% [27]. O ácido bempedóico foi bem tolerado por estes grupos de doentes, sem aumento dos sintomas musculares.
Dado o custo dos inibidores PCSK9, os estudos de acompanhamento procuraram atingir níveis de LDL-C tão baixos como os fornecidos pelos inibidores PCSK9. Num estudo de ácido bempedóico em dose fixa mais ezetimibe, em doentes de alto risco cardiovascular com um CLDL de base média de 3,9 mmol/l apesar da terapia com estatina máxima, as reduções nos níveis de CLDL foram substanciais (>38%), embora inferiores às esperadas com um inibidor PCSK9 [28]. A terapia tripla com ácido bempedóico, ezetimibe e atorvastatina (20 mg/dia) resultou numa redução equivalente de >64% do LDL-C, como seria de esperar com um inibidor PCSK9 [29], embora não tenham sido publicados estudos frente-a-frente. A adição de ácido bempedóico juntamente com a terapia de fundo com evolocumab 420 mg uma vez por mês reduziu significativamente o LDL-C em quase 30% [29].
Em geral, as reduções nos níveis de LDL-C com ácido bempedóico parecem ser um pouco maiores nos grupos de doentes que não tomam uma estatina [18–20]. Em relação a outras fracções lipídicas, o ácido bempedóico reduz a apolipoproteína B, triglicéridos e concentrações de colesterol lipoproteico de densidade não-alta (não-HDL-C). As reduções nos níveis de PRC observadas em vários estudos podem ser promissoras, mas requerem uma maior compreensão do mecanismo [21,22,26].
O papel do ácido bempedóico no futuro parece ser em (1) pacientes que são intolerantes à estatina combinados com outros agentes tolerados de redução de lípidos e (2) pacientes que necessitam de terapias adicionais para alcançar os objectivos do CLDL. O estudo de resultados cardiovasculares em curso (CLEAR Outcome) em doentes com historial de, ou com elevado risco de HKE, intolerância à estatina e níveis de LDL-C ≥2.6 mmol/l irá esclarecer melhor o papel do medicamento e se as potenciais reduções nos parâmetros clínicos se relacionam exclusivamente com a redução dos lípidos ou também com uma redução do PCR.
Devido aos elevados custos, como mencionado, a disponibilidade dos inibidores PCSK9 é limitada. Com o advento de biosimilares e outras formas de inibição do PCSK9, os preços podem baixar no futuro e esta terapia eficaz e bem tolerada pode tornar-se disponível para um maior número de pacientes.
Triglicéridos/ hiperlipidemia combinada – terapias orientadas
Os triglicéridos elevados apesar das terapias de redução de LDL-C são um dos problemas mais comuns na prática clínica. Os doentes com hipertriglicéridosemia podem estar em elevado risco residual de doença cardiovascular [30]. Dado que o estilo de vida está a emergir como causa principal de hipertrigliceridemia em doentes com síndrome metabólico, obesidade abdominal ou diabetes mellitus tipo 2 (T2DM), bem como em pessoas que consomem demasiado álcool ou que são fisicamente inactivas, que mais pode um médico fazer para abordar estes factores de risco? Enquanto dieta, actividade e perda de peso são pedras angulares do tratamento, a genética e outros factores não-modificáveis também desempenham um papel. Por exemplo, os pacientes com hiperlipidemia combinada familiar são comuns na prática clínica e podem ter hipertriglicéridosemia apesar do peso corporal normal [31]. Uma condição muito rara é a síndrome monogénica da hipercilomicronaemia familiar.
As provas epidemiológicas e genéticas têm apoiado a hipótese de que as variantes de vários genes-chave do metabolismo dos triglicéridos que afectam os triglicéridos e as lipoproteínas ricas em triglicéridos e residuais estão causalmente associadas às doenças cardiovasculares e à mortalidade geral [32]. Através desta evidência, surgiram novas terapias que visam estas manifestações.
Ácido eicosapentaenóico
Os suplementos de óleo de peixe têm sido tocados há décadas pelos seus efeitos cardiovasculares positivos. Também têm sido amplamente utilizados na prática clínica para reduzir as concentrações de triglicéridos, mas estudos com ácidos gordos ómega 3 não demonstraram a sua protecção em relação à HKE [33]. Portanto, os resultados do estudo REDUCE-IT (Reduction of Cardioascular Events with Icosapent Ethyl-Interention Trial ) vieram como uma surpresa. Os doentes que recebem diariamente 4 g de icosapente-etilo ou um óleo mineral contendo placebo apresentaram uma redução de 25% no desfecho primário de um composto de morte cardiovascular, enfarte do miocárdio não fatal (ataque cardíaco), acidente vascular cerebral não fatal, revascularização coronária ou angina instável [34]. Análises posteriores mostraram um benefício consistente para todos os subgrupos de doentes e uma redução de 31% em (primeiro e subsequentes) eventos isquémicos [35]. A maioria dos pacientes incluídos no estudo basearam-se num HKE existente (71%); quase 60% tinham diabetes e o nível médio de triglicéridos era de 2,4 mmol/l. Por exemplo, a redução impressionante ocorreu num grupo de pacientes com elevado risco cardiovascular, bem mais de 90% dos quais foram tratados com estatinas de intensidade moderada ou alta.
Desde esta publicação, as questões têm-se centrado na diferença entre o icosapentaenóico, que foi utilizado no estudo REDUCE-IT, e o ácido carboxílico ómega 3, que é uma mistura de ácido eicosapentaenóico (EPA) e ácido docosahexaenóico. Este composto foi utilizado numa dose de 4 g/dia no estudo STRENGTH (Statin Residual Risk Reduction with Epanoa in High Cardioascular Risk Patients with Hypertriglyceridemia ), um estudo que não mostrou qualquer redução nos eventos cardiovasculares [36]. Ainda não foi possível esclarecer completamente se estas diferenças podem ser atribuídas a possíveis danos do ácido docosahexaenóico ou à dosagem mais elevada de EPA no estudo REDUCE-IT em comparação com o estudo STRENGTH. Outra explicação que tem sido sugerida é a escolha de placebo no julgamento REDUCE-IT. No grupo de controlo do óleo mineral, os níveis de LDL-C, apolipoproteína B e proteína C reactiva aumentaram 10,9%, 7,8% e 32,3%, respectivamente, sugerindo que os benefícios do icosapente-etilo podem ter sido parcialmente confundidos por danos no grupo de controlo [34,37]. No entanto, a EPA pode ter propriedades que atenuem algumas destas diferenças.
Os mecanismos dos benefícios observados no ensaio REDUCE-IT podem ser multifactoriais, uma vez que as reduções de risco observadas excederam as expectativas para o grau de redução dos triglicéridos. Em média, o nível de triglicéridos diminuiu 18,3% (-0,44 mmol/l) no grupo icosapente-etilo, enquanto que aumentou 2,2% no grupo placebo. Devido à variação dos triglicéridos, cerca de 10% dos participantes tinham níveis normais, mas as reduções de risco eram consistentes em todos os níveis de triglicéridos de base. Os ácidos gordos omega-3 podem reduzir a inflamação, influenciar as arritmias cardíacas devido à modulação da fluidez da membrana e atenuar a formação e progressão da placa aterosclerótica [38]. Embora, por um lado, tenha havido uma redução significativa de 30% de mortes cardíacas súbitas no grupo icosapente-etílico no ensaio REDUCE-IT (uma análise terciária), a taxa de fibrilação atrial foi significativamente mais elevada no grupo icosapente-etílico do que no grupo placebo (5,3% contra 3,9%) [34].
Apesar de algumas incertezas, uma revisão do icosapent-etilo (Vazkepa®) pela EMA em 2021 para aprovação do medicamento como tratamento para reduzir o risco de eventos cardiovasculares em pacientes tratados com estatinas de alto risco com triglicéridos elevados (≥1,7 mmol/l) e HKE existente (ou diabetes e um ou mais factores de risco cardiovascular adicionais).
Pemafibrate
Os fibratos são agonistas activados por proliferadores peroxisómicos (PPAR) que têm sido usados como fármacos que diminuem os triglicéridos durante décadas. Como a maioria dos estudos incluiu uma vasta gama de participantes, os seus efeitos cardioprotectores foram questionados e são principalmente observados em subgrupos com hipertriglicéridosemia [39]. O Pemafibrate destaca-se como um novo modulador PPAR-α altamente selectivo que leva a reduções significativas nos triglicéridos e partículas residuais de colesterol. Contudo, um estudo recente não encontrou reduções significativas em não-HDL-C [40], sugerindo que os potenciais efeitos benéficos podem estar principalmente relacionados com reduções nos resíduos de triglicéridos e triglicéridos. O estudo PROMINENTE em curso (Pemafibrate to Reduce Cardio ascular Outcomes by Reducing Triglycerides in Patients with Diabetes ) inscreveu mais de 10 000 participantes com T2DM (prevenção primária ou secundária), triglicéridos de 2,26-5,64 mmol/l e níveis HDL-C <1,03 mmol/l aleatório para pemafibrar ou placebo, com o ponto final do estudo determinado por eventos. Os resultados serão apresentados em breve [41]. Resultados positivos poderiam melhorar significativamente o tratamento de pacientes com T2DM.
Apolipoproteína C-III e terapias proteicas semelhantes à angiopoietina
O controlo do metabolismo dos triglicéridos envolve uma série de proteínas e vias enzimáticas. Triglicéridos em quilómeros e lipoproteínas de muito baixa densidade são submetidos a lipólise intravascular por lipoproteína lipase para libertar ácidos gordos livres para serem utilizados ou armazenados como combustível. As proteínas centrais que regulam estes processos são a apolipoproteína C-III (ApoCIII), a proteína tipo angiopoietina 3 (ANGPTL3), e a ANGPTL4, todos potentes inibidores da lipoproteína lipase (Fig. 4).
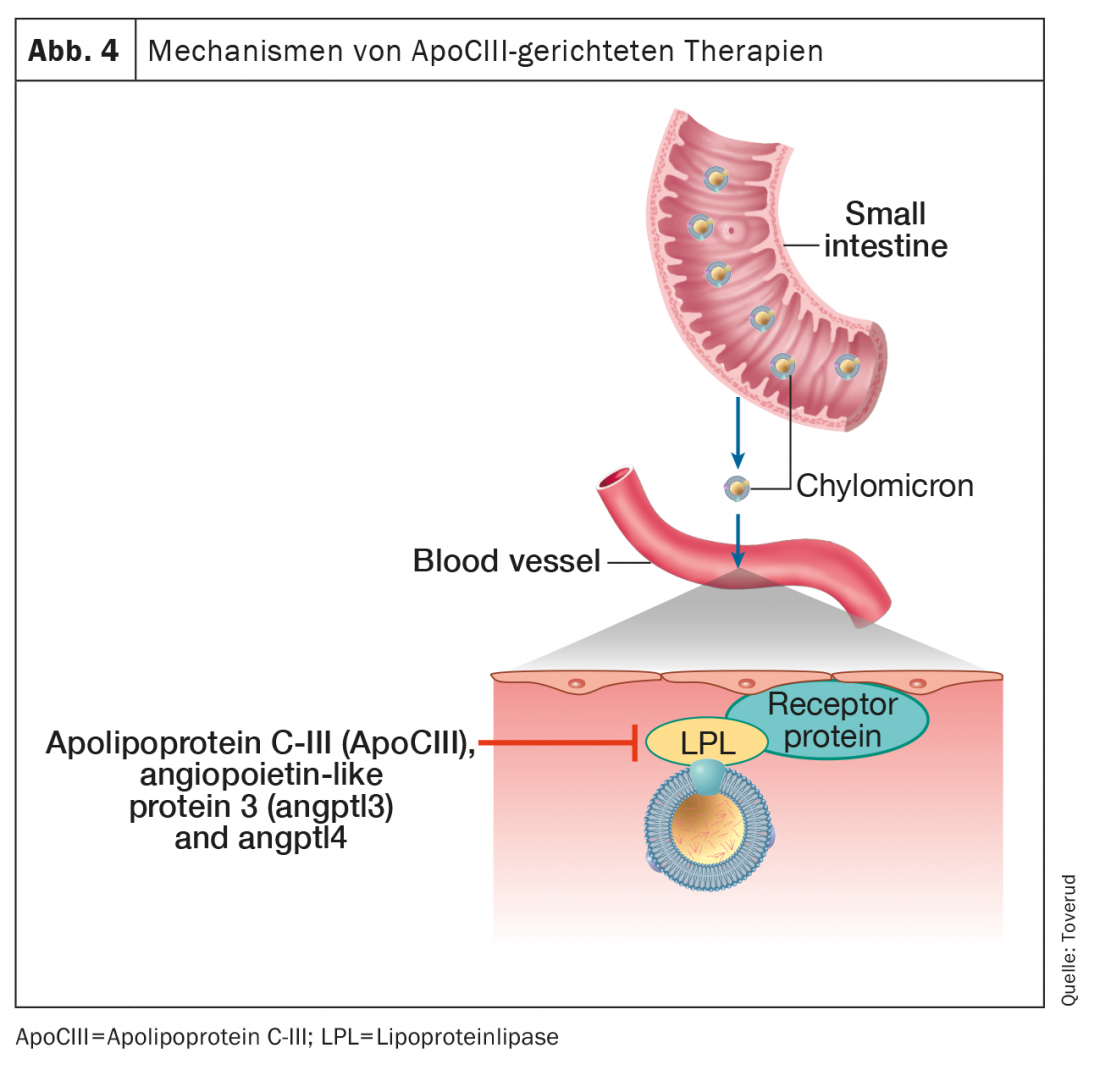
A evidência genética liga as variantes de ApoCIII com níveis reduzidos de triglicéridos e risco cardiovascular [42]. Além disso, o ApoCIII parece contribuir para a aterogenicidade de várias lipoproteínas às quais está ligado, incluindo o HDL [43]. Notavelmente, o baixo risco de HKE em heterozigotos com perda de função ApoCIII parece ser mediado pela sua associação com baixo colesterol residual em vez de baixo LDL-C [44], estabelecendo ainda mais o papel dos resíduos de triglicéridos na aterosclerose. Estes conhecimentos da genética e da fisiopatologia actuaram como catalisadores fundamentais para o desenvolvimento de medicamentos terapêuticos contra a hipertrigliceridemia, inibindo o ApoCIII.
Um estudo recente concluiu que os níveis de ANGPTL3 continuaram a ser determinantes independentes dos eventos cardiovasculares depois de se ajustarem aos factores de risco tradicionais e aos medicamentos para baixar os lípidos [45].
Consequentemente, ficou demonstrado que as mutações por perda de função no gene ANGPTL3 estão associadas à hipobeta-lipoproteinemia e à redução dos níveis de triglicéridos e dos níveis de colesterol LDL e HDL, bem como ao risco de doença coronária [44], enquanto as mutações no gene ANGPTL4 estão associadas à redução dos triglicéridos e ao aumento dos níveis de colesterol HDL [45]. Os pacientes com deficiência de ANGPTL3 não apresentaram aterosclerose coronária [46], o que levou à conclusão de que os bloqueadores de ANGPTL3 poderiam ser agentes redutores de risco promissores. Por outro lado, o desenvolvimento de inibidores angptl4 foi dificultado pela observação de lesões lipogranulomatosas no intestino de ratos com deficiência de angptl4.
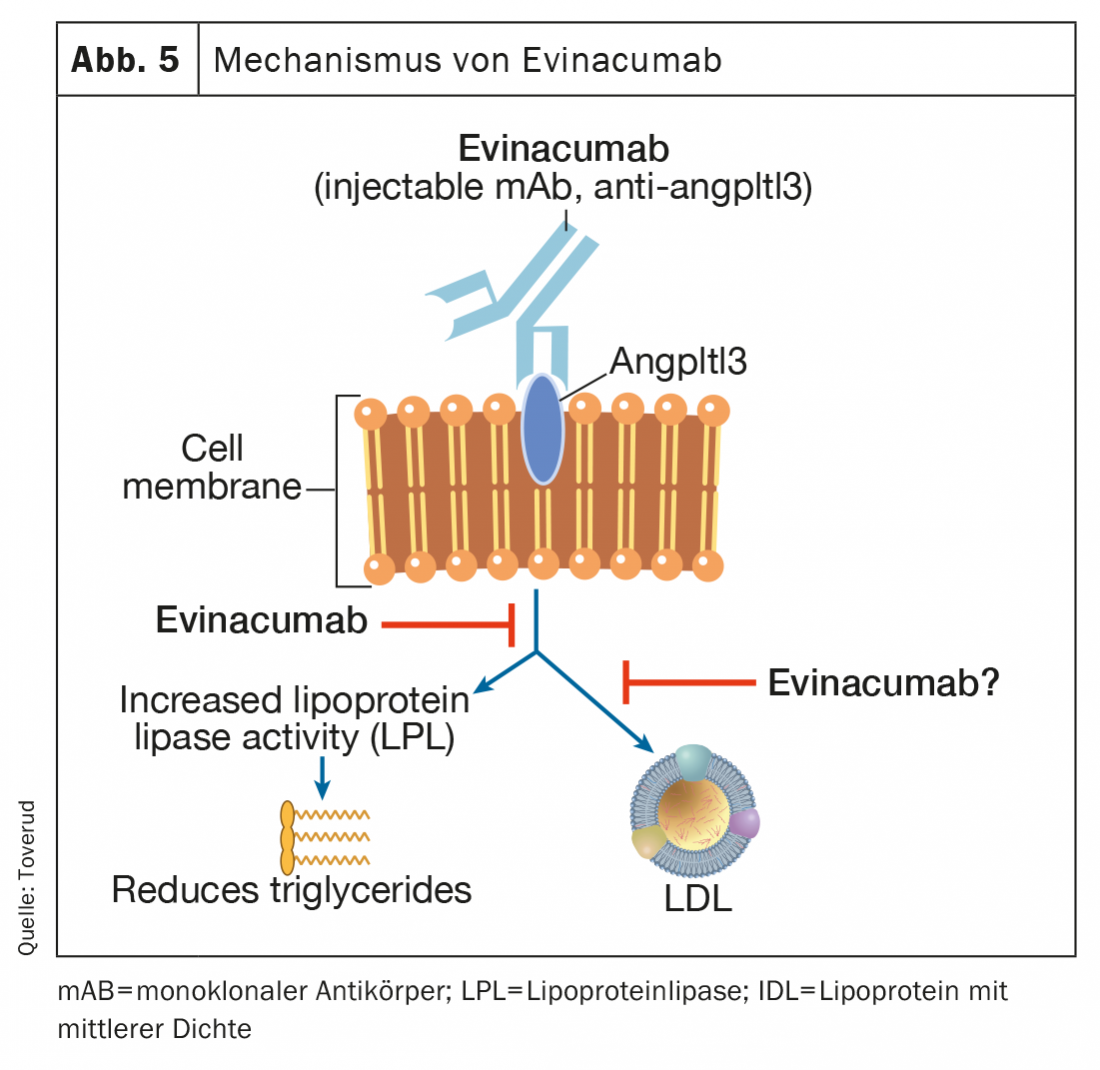
Evinacumab
Evinacumab é um anticorpo monoclonal totalmente humano que se liga aos inibidores angptl3 e os inibe, aumentando assim a actividade da lipoproteína lipase (Fig. 5) . Evinacumab baixa os níveis elevados de triglicéridos, mas não em doentes com triglicéridos gravemente elevados devido à falta de actividade lipoproteica na rara síndrome de hipercilomicronaemia familiar [47,48]. A Evinacumab também baixa os níveis de LDL-C através de um mecanismo independente dos receptores LDL que não é totalmente compreendido. Num estudo recente da fase 3 em doentes com FH homozigotos, as infusões intravenosas mensais de evinacumabe reduziram os níveis de colesterol LDL em 47% (49% versus placebo) e pareceram ser uma nova opção de tratamento promissora para estes doentes difíceis de tratar [49]. Os sintomas semelhantes aos da gripe eram mais comuns em doentes que recebiam evinacumabe. Os efeitos secundários a longo prazo na aterosclerose e na gravidez são registados a partir de um registo de utilizadores em curso. Evinacumab (Evkeeza®) foi aprovado em 2021 para o tratamento de FH homozigotos com 12 anos de idade ou mais.
Vupanorsen
Vupanorsen é um oligonucleótido antisenso em ANGPTL3 mRNA que está a ser desenvolvido como um tratamento potencial para a dislipidemia [50]. Em doentes com diabetes, esteatose hepática (fígado gordo) e hipertrigliceridemia, o medicamento reduziu significativamente os triglicéridos e o colesterol total e não-HDL sem reduzir a contagem de plaquetas [51].
Volanesorsen
Volanesorsen é um oligonucleótido antisense contra o mRNA de Apo-CIII que reduz muito os níveis de triglicéridos e ApoCIII através de vias independentes da lipoproteína lipase (Fig. 4). Os ensaios clínicos aleatórios controlados demonstraram uma redução dos níveis de triglicéridos de cerca de 70% e uma redução do risco de pancreatite aguda associada à hipertrigliceridemia [52]. Foi dado um passo significativo no tratamento de doenças raras em doentes com síndrome de quilomicronaemia familiar, uma doença genética rara e potencialmente fatal devido à perda de actividade lipoproteica, caracterizada por quilomicronaemia com pancreatite recorrente e poucas opções terapêuticas. Os Volanesorsen baixaram os níveis de triglicéridos em 77%, e a maioria dos participantes atingiu níveis de triglicéridos inferiores a 8,5 mmol, um limiar associado a um risco significativamente reduzido de pancreatite [53]. A Volansorsen baixou a apolipoproteína B-48 em 76%, mas aumentou a LDL-C em 136% e a apolipoproteína B total em 20%. Embora estes resultados possam reflectir um possível aumento do risco cardiovascular, os níveis de lipoproteínas aterogénicas foram muito baixos, como é tipicamente visto em doentes com quilomicronaemia familiar.
Um efeito adverso importante do vulanesorsen é a trombocitopenia, o que levou a FDA a recusar a aprovação, bem como as preocupações sobre hemorragias graves. No entanto, a trombocitopenia é invertida ao parar a droga. A EMA aprovou o volanesorsen (Waylivra®) em pacientes adultos com síndrome de quilomicronemia familiar em 2019.
Olezarsen
Olezarsen é um oligonucleótido antisenso que visa o mRNA hepático ApoCIII para inibir a produção de proteínas ApoCIII (Fig. 4). Num estudo recente, o tratamento com olezarsen durante 6-12 meses com triglicéridos dose-dependente de 23-60, sem alterações na contagem de plaquetas, função hepática ou renal, em participantes com triglicéridos elevados e alto risco cardiovascular ou doença cardiovascular [51].
Terapias contra lipoproteínas elevadas (A)
A ligação entre a Lp(a) elevada e a doença cardiovascular foi estabelecida através de estudos após a molécula ter sido identificada em 1968 por Berg em Oslo, Noruega. Uma meta-análise de estudos prospectivos encontrou um aumento aproximado no risco de doença coronária de 1,16 (1,11-1,22) por 3,5 vezes a concentração de Lp(a), diminuindo apenas ligeiramente para 1,13 (1,09-1,18) após ajustamento [54].
Foram também demonstradas associações entre Lp(a) e mortalidade, bem como acidente vascular cerebral, doença arterial periférica e estenose da válvula aórtica calcificada. Esta breve revisão visa apenas terapias específicas para apo(a). Pensa-se que embora alguns estudos tenham descoberto que a redução da Lp(a) em 20% a 25% não representava um risco cardiovascular reduzido para além da redução concomitante da LDL-C, esta observação pode ser explicada pelo pressuposto de que são necessárias grandes reduções nos níveis absolutos, uma vez que estudos das seguintes terapias inovadoras encontraram [55].
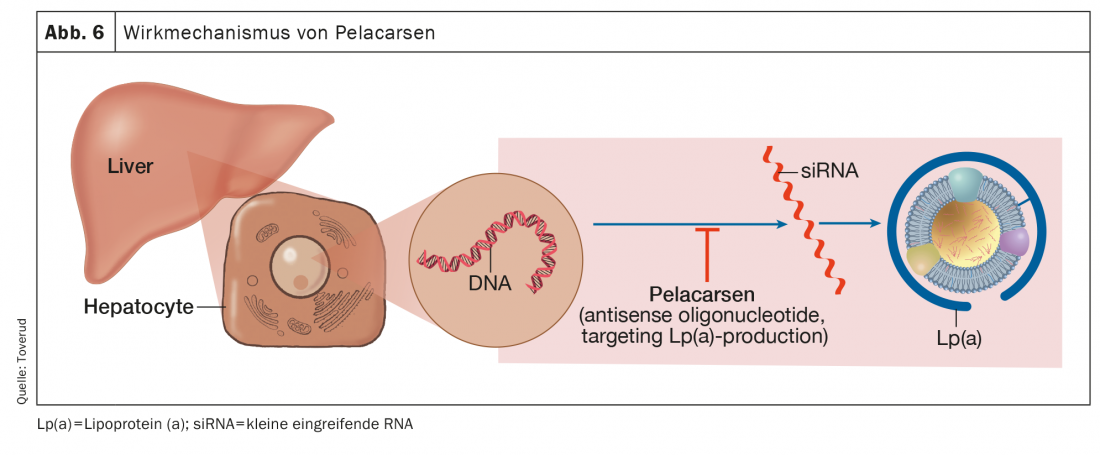
Pelacarsen
Pelacarsen é o oligonucleótido antisenso que visa a produção de apo(a) hepático e tem feito o maior progresso nos ensaios que foram concluídos ou iniciados (Fig. 6). Em comparação com placebo, os pelacaresen reduziram os níveis de Lp(a) de forma dose-dependente e consistente até 80% em doentes com níveis elevados e HKE existentes [56].
Além disso, foram observadas diminuições de fosfolípidos oxidados na apolipoproteína B e apo(a), componentes da Lp(a) susceptíveis de ter efeitos pró-inflamação-ma-articulares. O estudo Lp(a) HORIZON é um ensaio randomizado, duplo-cego, controlado por placebo e multicêntrico para avaliar o efeito dos pelacaresen nos eventos cardiovasculares em pacientes com concentrações existentes de HKE e LP(a) ≥175 nmol/l [57].
Pequena terapia interventiva de ARN
Olpasiran, uma pequena molécula interferente concebida para inibir directamente o ARN do mensageiro Lp(a), mostrou reduções grandes, dependentes da dose e duradouras de 71% a 97% nas concentrações de Lp(a) com efeitos que duram vários meses [58]. Recentemente, tornaram-se conhecidos os resultados de um estudo de escalonamento de outra pequena terapia de RNA interventiva (SLN360), que inibe a tradução do gene de codificação apo(A) em hepatócitos e foi também administrada como dose única. Foram observadas reduções médias de 98% de Lp(a) no grupo que recebeu a dose mais elevada após até 150 dias [59]. As questões de segurança relacionadas com estas duas terapias exigirão estudos mais longos e maiores.
Conclusão
No seu conjunto, existe uma necessidade não satisfeita de terapias mais eficazes para reduzir os lípidos, bem como uma expansão do actual arsenal terapêutico. Os recentes avanços na farmacoterapia sugerem uma série de possíveis vias mecanicistas e farmacológicas que estão a ser utilizadas com o objectivo de levar mais pacientes a alvos lipídicos. O campo está a avançar mais rapidamente do que nas últimas décadas e poderá haver mudanças significativas na forma como abordarmos a carga aterosclerótica global no futuro.
Fonte: Este artigo é uma publicação secundária, uma tradução do artigo original em língua inglesa publicado na revista “Kardiol.Pol. foi publicado. A referência é: Cardiol.Pol 2022; 80(7-8): 741-749. doi: 10.33963/KP.a2022.0117.
Agradecemos a Kari C. Toverud (Certified Medical Illustrator) pelos números.
Mensagens Take-Home
- A aterosclerose continua a ser a causa mais comum de morte em todo o mundo.
- Grande parte do aparecimento e desenvolvimento da aterosclerose é causada por dislipidemia.
- Com o advento das estatinas, ezetimibe e, mais recentemente, dos inibidores da subtilisina/kexina tipo 9 (PCSK9) da proproteína convertase, os médicos de todas as especialidades têm acesso a um arsenal terapêutico para lidar com este importante factor fisiopatológico.
- No entanto, existe ainda uma grande necessidade não satisfeita de estratégias de optimização para a redução de lipídios farmacoterapêuticos.
- Estes concentram-se na redução de triglicéridos (TG) ou lipoproteínas(a) [Lp(a)].
Literatura:
- OMS: Tópicos de saúde nas doenças cardiovasculares 2021. Disponível em linha: www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (Acesso: 28 de Abril de 2022).
- Atar D, Jukema JW, Molemans B, et al: Novas directrizes de prevenção cardiovascular: Como gerir de forma óptima a dislipidemia e o risco cardiovascular em 2021 em pacientes que necessitam de prevenção secundária? Aterosclerose 2021; 319: 51-61, doi: 10.1016/j.atherosclerosis.2020.12.013, indexado em Pubmed: 33476944.
- Sverre E, Peersen K, Husebye E, et al: Controlo desfavorável do factor de risco após eventos coronários na prática clínica de rotina. BMC Cardiovasc Disord 2017; 17(1): 40, doi: 10.1186/s12872-016-0387-z, indexado em Pubmed: 28109259.
- Setny M, Jankowski P, Kamiński K, et al: Secondary prevention of coronary heart disease in Poland: Does sex matter? Resultados do inquérito POLASPIRE. Pol Arch Intern Med 2022; 132(3), doi: 10.20452/pamw.16179, indexado em Pubmed: 34935325.
- Mundal L, Igland J, Ose L, et al: Mortalidade de doenças cardiovasculares em doentes com hipercolesterolemia familiar verificada geneticamente na Noruega durante 1992-2013. Eur J Prev Cardiol 2017; 24(2): 137-144, doi: 10.1177/2047487316676135, indexado em Pubmed: 27794106.
- Bogsrud MP, Græsdal A, Johansen D, et al: Objectivo do colesterol LDL, doença cardiovascular, e risco atribuído de Lp(a) numa grande coorte de hipercolesterolemia familiar predominantemente verificada geneticamente. J Clin Lipidol. 2019; 13(2): 279-286, doi: 10.1016/j.jacl.2019.01.010, indexado em Pubmed: 30910667.
- Mach F, Baigent C, Catapano AL, et al: Grupo de Documentos Científicos do CES. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. Eur Heart J. 2020; 41(1): 111-188, doi: 10.1093/eurheartj/ehz455, indexado em Pubmed: 31504418.
- O’Donoghue ML, Giugliano RP, Atar D, et al: Evolocumab a Longo Prazo em Pacientes com Doenças Cardiovasculares Ateroscleróticas Estabelecidas. Circulação 2022 Oct 11; 146(15): 1109-1119. doi: 10.1093/eurheartj/ehz430, indexado em Pubmed: 31270529.
- Kastelein JJP, Ginsberg HN, Langslet G, et al: ODYSSEY FH I e FH II: 78 resultados semanais com tratamento com alirocumab em 735 doentes com hipercolesterolemia heteroco-gous familiar. Eur Heart J 2015; 36(43): 2996-3003, doi: 10.1093/eurheartj/ehv370, indexado em Pubmed: 26330422.
- Raal FJ, Stein EA, Dufour R, et al: RUTHERFORD-2 Investigadores. PCSK9 em hibição com evolocumab (AMG 145) em hipercolesterolemia familiar heterozigótica (RUTHERFORD-2): um ensaio aleatório, duplo-cego, controlado por placebo. Lancet 2015; 385(9965): 331-340, doi: 10.1016/S0140-6736(14)61399-4, indexado em Pubmed: 25282519.
- Farnier M, Hovingh GK, Langslet G, et al: Long-term safety and efficacy of alirocumab in patients with heterozygous family hypercholesterolemia: An open-label extension of the ODYSSEY program. Aterosclerose 2018; 278: 307-314, doi: 10.1016/j.atherosclerosis.2018.08.036, indexado em Pubmed: 30293878.
- Koren MJ, Sabatine MS, Giugliano RP, et al: Eficácia e segurança a longo prazo da evolocumab em doentes com hipercolesterolemia. J Am Coll Cardiol 2019; 74(17): 2132-2146, doi: 10.1016/j.jacc.2019.08.1024, indexado em Pubmed: 31648705.
- Santos RD, Stein EA, Hovingh GK, et al: Evolocumab a longo prazo em doentes com hipercolesterolemia familiar. J Am Coll Cardiol 2020; 75(6): 565-574, doi: 10.1016/j.jacc.2019.12.020, indexado em Pubmed: 32057369.
- Blom DJ, Harada-Shiba M, Rubba P, et al: Eficácia e segurança de alirocumab em adultos com hipercolesterolemia familiar homozigotos: o ensaio ODYS- SEY HoFH. J Am Coll Cardiol 2020; 76(2): 131-142, doi: 10.1016/j. jacc.2020.05.027, indexado em Pubmed: 32646561.
- Santulli G, Jankauskas SS, Gambardella J: Inclisiran: um novo marco na estrada PCSK9 para enfrentar o risco cardiovascular. Eur Heart J Cardiovasc Pharmacother 2021; 7(3): e11-e12, doi: 10.1093/ehjcvp/pvab014, indexado em Pubmed: 33655296.
- Cuchel M, Bloedon LT, Szapary PO, et al: Inibição da proteína de transferência de triglicéridos microssomal na hipercolesterolemia familiar. N Engl J Med 2007; 356(2): 148-156, doi: 10.1056/NEJMoa061189, indexado em Pubmed: 17215532.
- Ballantyne CM, Davidson MH, Macdougall DE, et al: Eficácia e segurança de um novo modulador duplo de adenosina trifosfato-litrato de lisase e adenosina monofosfato activada por proteína cinase em doentes com hipercolesterolemia: resultados de um ensaio multicêntrico, aleatório, duplo-cego, controlado por placebo, em grupo paralelo. J Am Coll Cardiol 2013; 62(13): 1154-1162, doi: 10.1016/j.jacc.2013.05.050, indexado em Pubmed: 23770179.
- Ballantyne CM, McKenney JM, MacDougall DE, et al: Effect of ETC-1002 on serum low-density lipoprotein cholesterol in hypercholesterolemic patients receiving statin therapy. Am J Cardiol 2016; 117(12): 1928-1933, doi: 10.1016/j.amjcard.2016.03.043, indexado em Pubmed: 27138185.
- Ray KK, Bays HE, Catapano AL, et al: CLEAR Harmony Trial. Segurança e eficácia do ácido bempedóico para reduzir o colesterol LDL. N Engl J Med 2019; 380(11): 1022-1032, doi: 10.1056/NEJMoa1803917, indexado em Pubmed: 30865796.
- Goldberg AC, Leiter LA, Stroes ESG, et al: Efeito do ácido bempedóico vs placebo adicionado às estatinas toleradas ao máximo sobre o colesterol lipoproteico de baixa densidade em pacientes com alto risco de doença cardiovascular: o ensaio clínico aleatório da sabedoria CLEAR. JAMA 2019; 322(18): 1780-1788, doi: 10.1001/jama.2019.16585, indexado em Pubmed: 31714986.
- Lin Y, Parco C, Karathanos A, et al: Eficácia clínica e resultados de segurança do ácido bempedóico para a terapia de redução do LDL-C em doentes com elevado risco cardiovascular: uma revisão sistemática e uma meta-análise. BMJ Aberto. 2022; 12(2): e048893, doi: 10.1136/bmjopen-2021-048893, indexado em Pubmed: 35210334.
- Bytyçi I, Penson PE, Mikhailidis DP, et al: Prevalência da intolerância à estatina: uma meta-análise. Eur Heart J 2022 [Epub ahead of print]: ehac015, doi: 10.1093/eurheartj/ehac015, indexado em Pubmed: 35169843.
- Wood FA, Howard JP, Finegold JA, et al: ensaio N-of-1 de uma estatina, placebo, ou nenhum tratamento para avaliar os efeitos secundários. N Engl J Med 2020; 383(22): 2182-2184, doi: 10.1056/NEJMc2031173, indexado em Pubmed: 33196154.
- Herrett E, Williamson E, Brack K, et al: StatinWISE Trial Group. Statin treat- ment e sintomas musculares: série de ensaios n-of-1 aleatorizados e controlados por placebo. BMJ. 2021; 372: n135, doi: 10.1136/bmj.n135, indexado em Pubmed: 33627334.
- Laufs U, Banach M, Mancini GB, et al: Eficácia e segurança do ácido bempedóico em doentes com hipercolesterolemia e intolerância à estatina. J Am Heart Assoc 2019; 8(7): e011662, doi: 10.1161/JAHA.118.011662, indexado em Pubmed: 30922146.
- Ballantyne CM, Banach M, Mancini GB, et al: Eficácia e segurança do ácido bempedóico adicionado ao ezetimibe em doentes intolerantes à estatina com hipercolesterolemia: Um estudo aleatório, controlado por placebo. Aterosclerose 2018; 277: 195-203, doi: 10.1016/j.atherosclerosis.2018.06.002, indexado em Pubmed: 29910030.
- Ballantyne CM, Laufs U, Ray KK, et al: Ácido bempedóico mais combinação de dose fixa de ezetimibe em pacientes com hipercolesterolemia e alto risco de DCV tratados com terapia com estatina maximamente tolerada. Eur J Prev Cardiol 2020; 27(6): 593-603, doi: 10.1177/2047487319864671, indexado em Pubmed: 31357887.
- Rubino J, MacDougall DE, Sterling LR, et al: Combinação de ácido bempedóico, ezetimibe, e atorvastatina em doentes com hipercolesterolemia: Um ensaio clínico aleatório. Aterosclerose 2021; 320: 122-128, doi: 10.1016/j.atherosclerosis.2020.12.023, indexado em Pubmed: 33514449.
- McKenney J, MacDougall D, Sterling L, et al: Abaixamento lipídico com ácido bempe- doic adicionado à terapia de inibidores da subtilisina/kexina tipo 9 da proproteína convertase: um ensaio aleatório controlado. J Clin Lipidol 2019; 13(3): e55-e56, doi: 10.1016/j.jacl.2019.04.092.
- Soehnlein O, Libby P. Alvejando a inflamação na aterosclerose – desde os conhecimentos experimentais até à clínica. Nature Rev 2021; 20(8): 589-610, doi: 10.1038/s41573-021-00198-1, indexado em Pubmed: 33976384.
- Ginsberg HN, Packard CJ, Chapman MJ, et al: Triglicerídeos – lipoproteínas ricas em triglicéridos e os seus restos: percepções metabólicas, papel na doença cardiovascular aterosclerótica, e estratégias terapêuticas emergentes – uma declaração consensual da Sociedade Europeia de Aterosclerose. Eur Heart J 2021; 42(47): 4791-4806, doi: 10.1093/eurheartj/ehab551, indexado em Pubmed: 34472586.
- Bello-Chavolla OY, Kuri-García A, Ríos-Ríos M, et al: Familial combined hyperlipidemia: conhecimento actual, perspectivas, e controvérsias. Rev In- vest Clin. 2018; 70(5): 224-236, doi: 10.1007/springerreference_35144, indexado em Pubmed: 30307446.
- Aung T, Halsey J, Kromhout D, et al.: Colaboração de Trialistas de Tratamento Omega-3. Associações de utilização de suplemento de ácidos gordos ómega 3 com riscos de doenças cardiovasculares: meta-análise de 10 ensaios que envolveram 77 917 indivíduos. JAMA Cardiol 2018; 3(3): 225-234, doi: 10.1001/jamacardio.2017.5205, indexado em Pubmed: 29387889.
- Bhatt DL, Steg PG, Miller M, et al: REDUCE-IT Investigadores. Redução do risco cardiovascular com icosapente etilo para hipertrigliceridemia. N Engl J Med. 2019; 380(1): 11-22, doi: 10.1056/NEJMoa1812792, indexado em Pubmed: 30415628.
- Peterson BE, Bhatt DL, Steg PhG, et al: REDUCE-IT Investigators, RE- DUCE-IT Investigators, REDUCE-IT Investigators. Efeitos do icosapente etílico no total de eventos isquémicos: da REDUCE-IT. J Am Coll Cardiol 2019; 73(22): 2791-2802, doi: 10.1016/j.jacc.2019.02.032, indexado em Pubmed: 30898607.
- Nicholls SJ, Lincoff AM, Garcia M, et al: Effect of high-dose omega-3 fatty acids vs corn oil on major adverse cardiovascular events in patients at high cardiovascular risk: the STRENGTH randomized clinical trial. JAMA 2020; 324(22): 2268-2280, doi: 10.1001/jama.2020.22258, indexado em Pubmed: 33190147.
- Doi T, Langsted A, Nordestgaard BG: Uma possível explicação para os resultados contrastantes de REDUCE-IT vs. STRENGTH: estudo de coorte que imita os desenhos de ensaios. Eur Heart J 2021; 42(47): 4807-4817, doi: 10.1093/eu-rheartj/ehab555, indexado em Pubmed: 34455435.
- Mason RP, Libby P, Bhatt DL: Mecanismos emergentes de protecção cardiovascular para o ácido ómega 3 eicosapentaenóico de ácido gordo. Arterio- scler Thromb Vasc Biol 2020; 40(5): 1135-1147, doi: 10.1161/ATVBA-HA.119.313286, indexado em Pubmed: 32212849.
- Liu ZL, Li GQ, Bensoussan A, et al: Effects of fibrates on cardiovascular outcomes: a systematic review and meta-analysis. Lancet 2010; 375(9729): 1875-1884, doi: 10.1016/S0140-6736(10)60656-3, indexado em Pubmed: 20462635.
- Ginsberg HN, Hounslow NJ, Senko Y, et al: Eficácia e segurança do K-877 (pe-mafibrato), um modulador selectivo pparα, em doentes europeus sobre terapia com estatinas. Diabetes Care 2022; 45(4): 898-908, doi: 10.2337/dc21-1288, indexado em Pubmed: 35238894.
- Pradhan AD, Paynter NP, Everett BM, et al: Raciocínio e concepção do pemafibrato para reduzir os resultados cardiovasculares através da redução dos triglicéridos em pacientes com diabetes (PROMINENTE) estudo. Am Heart J 2018; 206: 80-93, doi: 10.1016/j.ahj.2018.09.011, indexado em Pubmed: 30342298.
- Dib I, Khalil A, Chouaib R, et al: Apolipoproteína C-III e doenças cardiovasculares: quando a genética encontra patologias moleculares. Mol Biol Rep 2021; 48(1): 875-886, doi: 10.1007/s11033-020-06071-5, indexado em Pubmed: 33389539.
- Wulff AB, Nordestgaard BG, Tybjærg-Hansen A. APOC3 mutações de perda de função, colesterol remanescente, colesterol lipoproteico de baixa densidade, e risco cardiovascular: mediações- e meta-análises de 137 895 indivíduos. Arterioscler Thromb Vasc Biol 2018; 38(3): 660-668, doi: 10.1161/AT- VBAHA.117.310473, indexado em Pubmed: 29348120.
- Stitziel NO, Khera AV, Wang X, et al.: PROMIS and Myocardial Infarction Genetics Consortium Investigators. Deficiência de ANGPTL3 e protecção contra doença arterial coronária. J Am Coll Cardiol 2017; 69(16): 2054-2063, doi: 10.1016/j.jacc.2017.02.030, indexado em Pubmed: 28385496.
- Dewey FE, Gusarova V, O’Dushlaine C, et al: Inactivação de variantes em ANGPTL4 e risco de doença arterial coronária. N Engl J Med 2016; 374(12): 1123-1133, doi: 10.1056/NEJMoa1510926, indexado em Pubmed: 26933753.
- Hussain A, Sun C, Selvin E, et al: lipoproteínas ricas em triglicéridos, proteína apolipo C-III, proteína tipo angiopoietina 3, e eventos cardiovasculares em adultos mais velhos: Estudo do risco de aterosclerose em comunidades (ARIC). Eur J Prev Cardiol 2022; 29(2): e53-e64, doi: 10.1093/eurjpc/zwaa152, indexado em Pubmed: 33580780.
- Ahmad Z, Banerjee P, Hamon S, et al: Inibição da proteína 3 do tipo angiopoietina com um anticorpo monoclonal reduz os triglicéridos em hipertri-gliceridemia. Circulação 2019; 140(6): 470-486, doi: 10.1161/CIRCULATIONAHA.118.039107, indexado em Pubmed: 31242752.
- Ahmad Z, Pordy R, Rader D, et al: Inibição da proteína tipo angiopoietina 3 com evinacumab em indivíduos com hipertrigliceridemia elevada e grave. J Am Coll Cardiol 2021; 78(2): 193-195, doi: 10.1016/j.jacc.2021.04.091, indexado em Pubmed: 34238441.
- Raal FJ, Rosenson RS, Reeskamp LF, et al: ELIPSE HoFH Investiga- tors. Evinacumab para a hipercolesterolemia familiar homozigotos. N Engl J Med 2020; 383(8): 711-720, doi: 10.1056/NEJMoa2004215, indexado em Pubmed: 32813947.
- Gaudet D, Karwatowska-Prokopczuk E, Baum SJ, et al: Vupanorsen, um medicamento antisenso conjugado com N-acetil galactosamina a ANGPTL3 mRNA, baixa triglicéridos e lipoproteínas aterogénicas em doentes com diabetes, esteatose hepática e hipertriglicéridosemia. Eur Heart J 2020; 41(40): 3936-3945, doi: 10.1093/eurheartj/ehaa689, indexado em Pubmed: 32860031.
- Tardif JC, Karwatowska-Prokopczuk E, Amour ES, et al: Apolipoprotein C-III redução em sujeitos com hipertrigliceridemia moderada e com elevado risco cardiovascular. Eur Heart J. 2022; 43(14): 1401-1412, doi: 10.1093/eu- rheartj/ehab820, indexado em Pubmed: 35025993.
- Gelrud A, Digenio A, Alexander V, et al: Tratamento com triglicéridos e pancreatite reduzidos em doentes com FCS e sHTG vs placebo: resultados dos estudos APPROACH e COMPASS. Aterosclerose; 32(Suppl 2018): 157-158.
- Witztum JL, Gaudet D, Freedman SD, et al: Volanesorsen and triglyceride levels in familial chylomicronemia syndrome. N Engl J Med. 2019; 381(6): 531-542, doi: 10.1056/nejmoa1715944, indexado em Pubmed: 31390500.
- Erqou S, Kaptoge S, Perry PL, et al: Colaboração em Factores de Risco Emergentes. Concentração de lipoproteínas(a) e o risco de doença coronária, acidente vascular cerebral e mortalidade não vascular. JAMA 2009; 302(4): 412-423, doi: 10.1001/jama.2009.1063, indexado em Pubmed: 19622820.
- Ference BA: O benefício clínico potencial de baixar a lipoproteína(a). JAMA 2022 [Epub ahead of print], doi: 10.1001/jama.2022.5333, indexado em Pubmed: 35368050.
- Tsimikas S, Karwatowska-Prokopczuk E, Xia S, et al: AKCEA-APO(a)-LRx Study Investigators. Lipoproteína (a) redução em pessoas com doenças cardiovasculares. N Engl J Med 2020; 382(3): 244-255, doi: 10.1056/NEJ-Moa1905239, indexado em Pubmed: 31893580.
- Avaliação do Impacto da Lipoproteína (a) Abaixamento com Pelacarsen (TQJ230) em Grandes Eventos Cardiovasculares em Pacientes com CVD. https://clinicaltrials.gov/ct2/show/NCT04023552 (28 de Abril de 2022).
- Koren MJ, Moriarty PM, Baum SJ, et al: Desenvolvimento pré-clínico e ensaio da fase 1 de um novo siRNA visando a lipoproteína(a). Nat Med 2022; 28(1): 96-103, doi: 10.1038/s41591-021-01634-w, indexado em Pubmed: 35027752.
- Nissen SE, Wolski K, Balog C, et al: Estudo de dose única ascendente de um pequeno RNA interferente visando a produção de lipoproteínas (a) em indivíduos com níveis elevados de lipoproteína(a) plasmática. JAMA 2022 [Epub ahead of print], doi: 10.1001/jama.2022.5050, indexado em Pubmed: 35368052.
CARDIOVASC 2022; 21(4): 6-15











