Mais uma vez, teve lugar em Genebra a Conferência Europeia sobre o Cancro do Pulmão. Desta vez, também, o foco foi principalmente o cancro do pulmão de células não pequenas. As terapias que visam variantes mutantes e não mutantes de EGFR estão a ser investigadas isoladamente ou em combinação com quimioterapia. Vários destes medicamentos já estão aprovados na UE e nos EUA. Além disso, uma abordagem inovadora do campo da imunologia foi discutida com uma terapia no campo do mesotelioma.
As coisas estão a acontecer no tratamento do cancro do pulmão de células não pequenas (NSCLC). Por um lado, os resultados do estudo sobre osimertinib foram discutidos no congresso. Trata-se de um potente inibidor irreversível da tirosina quinase EGFR de terceira geração que já foi aprovado nos EUA e na UE (ainda não na Suíça). Dois resumos tardios confirmaram a sua eficácia no NSCLC alterado por EGFR, particularmente na presença de uma mutação T790M. Uma actualização da AURA P1 (fase I) e dados conjuntos da extensão AURA e AURA 2 (ambos ensaios da fase II) mostraram os seguintes resultados para o osimertinib na dose recomendada de 80 mg/d (oral):
- Dos 63 pacientes da AURA P1, 71% tiveram uma resposta objectiva que durou uma mediana de 9,6 meses. A sobrevivência sem progressão foi de 9,7 meses. Os efeitos secundários causais mais comuns incluíam erupções cutâneas (37%, nenhuma de grau 3) e diarreia (35%, dos quais 2% eram de grau 3).
- Dos 411 pacientes nos dois ensaios conjuntos de fase II, 66% tiveram uma resposta objectiva (de acordo com uma revisão independente) que durou uma mediana de 12,5 meses. A sobrevivência sem progressão foi de 11 meses. Após um ano, 47,5% dos participantes ainda estavam sem progressão. Mais uma vez, a erupção cutânea (41%, incluindo 1% grau 3) e a diarreia (38%, incluindo 1% grau 3) estavam entre os efeitos secundários causais mais comuns.
Os dados agrupados da fase II confirmariam claramente os resultados da AURA P1 e de publicações anteriores, disseram os apresentadores. Em pacientes com NSCLC avançado e a mutação EGFR T790M que progrediram na terapia EGFR TKI prévia, o osimertinib 80 mg/d fornece uma alta taxa de resposta durante uma duração relativamente longa com uma sobrevivência sem progressão encorajadora (especialmente em comparação com os quatro a cinco meses de quimioterapia) e um perfil de efeito secundário controlável.
De acordo com os autores, o diagnóstico molecular da mutação T790M já deveria ser padrão. Os dados mostrariam claramente que os pacientes com um mecanismo de resistência correspondente beneficiam do osimertinib.
Osimertinib também eficaz na primeira linha
A segunda apresentação mostrou dados de dois coortes da fase I com osimertinib na dose de 80 ou 160 mg/d, desta vez administrados como terapia de primeira linha, ou seja, em 60 doentes com ingenuidade terapêutica. Esta foi também uma actualização do estudo da AURA. Os pacientes tinham o NSCLC alterado localmente ou metastático EGFR-mutado (cinco deles eram T790M-positivos). O tempo médio de seguimento foi de 16,6 meses. A taxa de resposta global objectiva foi de 77% (67% na coorte de 80 mg e 87% na coorte de 160 mg). Os pacientes permaneceram sem progressão durante uma mediana de 19,3 meses. Após um ano e meio, um total de 55% ou mais. sem progressão em 57% (80 mg) e 53% (160 mg), dependendo do coorte.
Os acontecimentos adversos mais comuns foram a diarreia (60% e 87%, respectivamente, dos quais 0% e 7% eram de grau 3 ou superior), a estomatite (43% e 50%, respectivamente, dos quais 0% e 3% eram de grau 3 ou superior) e a paroníquia (30% e 53%, respectivamente, dos quais 0% e 7% eram de grau 3 ou superior). A 10% (80 mg) resp. 47% (160 mg) dos pacientes tiveram de ter a dose reduzida para que os efeitos secundários fossem controlados.
A toma de osimertinibe altera a biologia do tumor?
Osimertinib também mostrou potencial na primeira linha, concluíram os autores. É uma das melhores taxas de resposta global alcançada com terapias de primeira linha para o NSCLC alterado por EGFR, e a sobrevivência sem progressão também excede em muito a experiência com os medicamentos de primeira e segunda geração correspondentes (aproximadamente 10-13 meses). Muitos pacientes ainda não mostraram progressão e continuam a beneficiar do osimertinibe.
Além disso, nas pessoas com doença progressiva, a mutação T790M não parece ser responsável pela resistência, os dados iniciais mostram. É possível que o uso de osimertinib em primeira linha altere a biologia do tumor. O perfil de segurança é bom, especialmente na dosagem mais baixa (aprovada); uma taxa de 10% de pacientes com reduções de dose é considerada baixa.
Outros estudos em preparação
A inibição de EGFR é actualmente o padrão de cuidados para pacientes NSCLC com mutações activadoras de EGFR. Através da mutação T790M, 50-60% dos pacientes desenvolvem resistência ao tratamento. O Osimertinib é particularmente útil para estes pacientes porque inibe potentemente as mutações EGFR originais (exon 19 e 21), mas também a mutação EGFR T790M. Com o osimertinib, a resistência pode ser retardada, o tumor aparentemente tem de procurar novos mecanismos de resistência para além da mutação EGFR T790M. A clareza sobre as vantagens do inibidor de terceira geração na primeira linha será agora fornecida por um ensaio de fase III com mais de 500 pacientes, no qual o osimertinib está a ser comparado com o erlotinibe e o gefitinibe. Os resultados são esperados daqui a cerca de um ano e meio.
Necitumumab – os pacientes com tumores EGFR-expressores são os mais beneficiados
Para além do osimertinibe, houve também novos dados sobre o necitumumab. Este anticorpo monoclonal também visa o EGFR e é administrado juntamente com quimioterapia (gemcitabina e cisplatina) em doentes NSCLC com carcinoma espinocelular avançado. Necitumumab já está aprovado nos EUA e na UE.
Os dados apresentados no congresso provêm do ensaio SQUIRE (fase III) e tratavam do subgrupo de doentes com tumores que expelem EGFR (95% da população avaliada [n=982]). Enquanto os 5% de pacientes sem a proteína EGFR não mostraram qualquer benefício, os 95% com os tumores com EGFR-expressão mostraram uma melhoria significativa na sobrevivência global e sem progressão de 21% e 16% respectivamente (em comparação com a quimioterapia apenas) – um benefício ligeiramente maior do que na população global. Dado o mecanismo de acção do necitumumabe, este é um resultado óbvio: onde não há receptor e, portanto, não há alvo, a droga não pode ligar-se. De acordo com a EMA, o necitumumab só é portanto aprovado para os pacientes com tumores EGFR-expressores, enquanto que a FDA decidiu com base na população total de SQUIRE e não especificou mais a aprovação.
Mesmo esta análise de subgrupo não permite chegar a uma conclusão firme, uma vez que o grupo de pacientes sem tumores expressores EGFR era claramente demasiado pequeno (5% ou apenas 47 pacientes) e o desenho do estudo não foi dirigido a estes pacientes. Devem esperar-se estudos maiores para se poder dizer com certeza se os doentes com tumores EGFR-negativos também beneficiam ou não de necitumumab.
Será que uma bactéria ajuda contra o mesotelioma?
O mesotelioma pleural maligno é uma doença rara mas muito agressiva, com um mau prognóstico. O tratamento é difícil e consiste actualmente em quimioterapia pemetrexada e de platina como padrão. São alcançadas taxas de resposta de cerca de 30%, mas o benefício de sobrevivência é baixo. São, portanto, necessárias novas abordagens de tratamento. Uma dessas promessas é a imunoterapia com uma bactéria viva chamada CRS-207, uma forma atenuada de Listeria monocytogenes com duas supressões genéticas, para reduzir a patogenicidade. A bactéria foi concebida para expressar mesotelina, um antigénio que é sobreexpresso por vários tumores, incluindo o mesotelioma, e que é importante para a sobrevivência celular. Assim, pensa-se que o CRS-207 induz uma resposta anti-mesoteína e, portanto, uma resposta imunitária endógena, adaptativa e específica de tumores. Juntamente com a quimioterapia, o microambiente tumoral é alterado e é possível a morte imunitária das células tumorais.
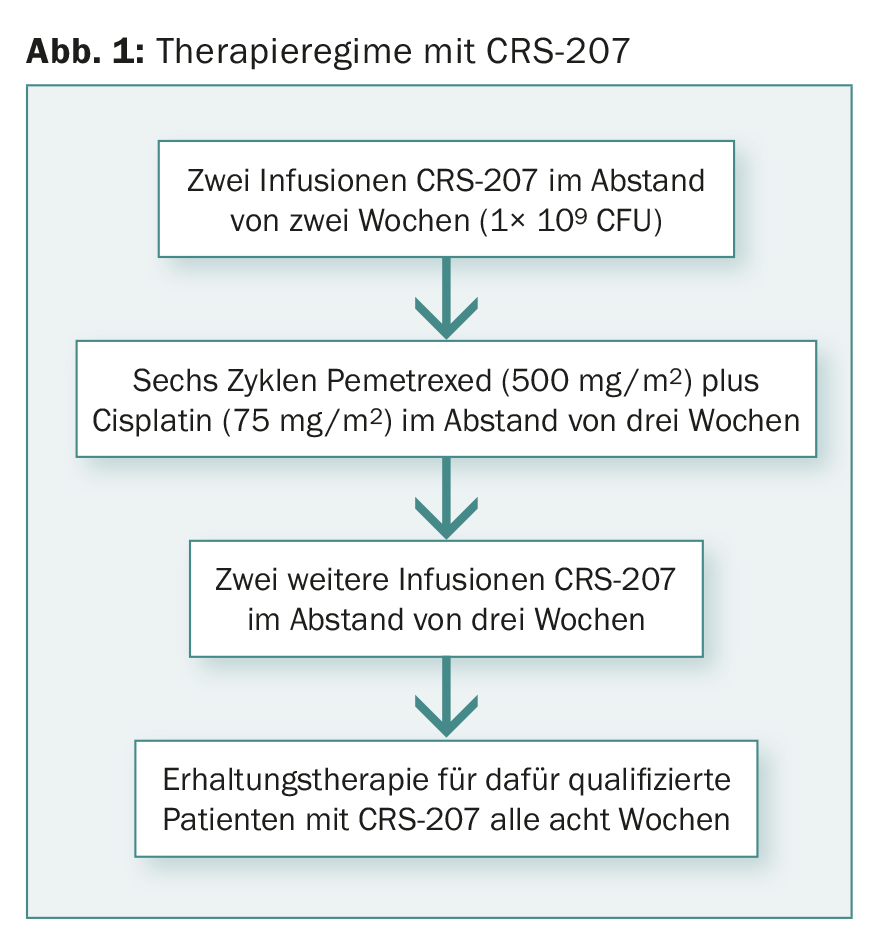
Pacientes quimioterápicos com plauramesotelioma avançado e não digerível participaram no ensaio de fase Ib. Na altura da apresentação, os dados de 38 pacientes tinham sido avaliados. A figura 1 mostra o regime terapêutico.
A imuno-histoquímica encontrou um aumento de linfócitos infiltrantes de tumores após o tratamento com CRS. Após um acompanhamento mediano de 9,4 meses, 59% das pessoas tratadas apresentaram uma resposta parcial. Em 35%, a doença era estável. Em conjunto, isto dá uma taxa de controlo de doenças de 94%. Em média, os pacientes viveram 8,5 meses sem progressão.
Nenhum efeito secundário grave ou morte foi associado ao tratamento. Febre, quedas/rigorações de temperatura, hipotensão, náuseas e vómitos foram relatados com mais frequência (grau 1 e 2). A maior parte dos efeitos secundários estavam relacionados com a própria infusão e diminuíram após 24 horas.
A resposta imune é de facto estimulada
Uma resposta de quase 60% com uma taxa global de controlo de doenças superior a 90% foi encorajadora, os apresentadores resumiram os dados. Além disso, a nova abordagem não só mediu os linfócitos que infiltram tumores, mas também as alterações correspondentes nas células imunitárias circulantes e nos biomarcadores do soro. Por exemplo, foi medido um aumento de macrófagos, células CD8+ infiltrantes e células assassinas naturais. A resposta imunitária específica e não específica com subsequente controlo sinérgico do tumor em combinação com a quimioterapia poderia assim ser efectivamente iniciada.
A terapia será agora mais investigada em ensaios da fase III, pois parece produzir resultados significativamente melhores do que a quimioterapia por si só. O perfil de segurança e tolerabilidade da nova abordagem também é surpreendentemente bom; as toxicidades cumulativas não parecem ocorrer.
Fonte: ELCC 2016 European Lung Cancer Conference, 13-16 de Abril de 2016, Genebra
InFo ONCOLOGy & HEMATOLOGy 2016; 4(4): 30-32