O microbioma da pele de doentes com dermatite atópica (DA) tem uma diversidade bacteriana reduzida. O agente patogénico Staphylococcus aureus (S. aureus) predomina frequentemente. Esta bactéria Gram-positiva intensifica os processos inflamatórios e está associada a episódios agudos de DA. Um estudo publicado em 2024 no JCI Insight por Clowry et al. fornece informações sobre as assinaturas imunitárias sistémicas e cutâneas associadas à DA pediátrica infetada com S. aureus.
Para o estudo de Clowry et al. foram recrutados 93 doentes com DA com idades compreendidas entre os 0 e os 16 anos [6]. Destes, 12 tinham uma infeção cutânea por S. aureusconfirmada com base em critérios clínicos (“ADS.aureus”) [7]. Os critérios clínicos incluíam exsudação, formação de pústulas, abcessos e/ou formação de crostas, bem como resultados positivos de esfregaços bacterianos. Os restantes 46 doentes com DA não cumpriram os critérios clínicos para o diagnóstico de infeção cutânea por S. aureus(grupo de controlo da DA). O grupo de controlo de pele saudável era constituído por 35 participantes que não tinham uma infeção cutâneaativa por S. aureusnem uma história de atopia.
A infeção cutânea por S. aureusfoi associada a uma maior gravidade da DA
Foram criados perfis imunológicos sistémicos para todos os 93 doentes e, além disso, foram criados perfis imunológicos locais da pele para um subgrupo (n=69) [6]. Este subgrupo incluiu 9 doentes com “ADS.aureus”, 32 doentes do grupo de controlo da DA e 28 controlos com pele saudável. Os doentes com “AD.aureus” apresentavam uma maior gravidade da DA em comparação com o grupo de controlo da DA (pontuações EASI médias de 29,4-32 em comparação com 14,8-15). Além disso, um maior número de doentes do grupo “ADS.aureus” foi afetado por níveis elevados de colonização por S. aureustanto na pele lesional (67% e 37%, respetivamente) como na pele não lesional (30% e 5%, respetivamente). Todos os doentes do grupo “ADS.aureus” apresentavam níveis moderados ou elevados de S. aureus na pele lesionada, 60% tinham colonização da pele não lesionada e 66% tinham colonização nasal. Em contrapartida, o grupo de controlo AD não apresentava sinais clínicos de infeção por S. aureus. Em 51% destes doentes, o S. aureus foi identificado na pele lesionada da DA, em 30% na pele não lesionada da DA e 48% tinham colonização nasal. Os doentes com “DA.aureus” tinham menos probabilidades de estar a tomar terapêuticas do sistema imunomodulador (8-11% em comparação com 41-46% no grupo de controlo da DA).
| A investigação do microbioma acrescenta um nível importante ao conhecimento dos processos patogénicos na DA. Sabe-se agora que o microbiota cutâneo pode influenciar e modular as respostas imunitárias na pele, parecendo que o S. aureus desempenha um papel fundamental [1]. < >Enquanto o S. aureus só é detetável na pele saudável em 5% de todas as zaragatoas, é encontrado em crianças com DA em 90% dos casos [2]. A função de barreira da pele já enfraquecida na DA pode ser ainda mais prejudicada peloS. aureus , uma vez que a bactéria possui proteases que reduzem ainda mais a integridade da barreira [3]. Isto porque a atividade das proteases permite a penetração na epiderme, o que resulta na estimulação de citocinas Th2, pelo que o S. aureus pode ser encontrado não só na epiderme, mas também na derme das lesões da DA [4]. Além disso, o S. aureus expressa uma α-toxina – uma proteína formadora de poros que danifica a membrana celular dos queratinócitos [5]. |
Perfis imunológicos de “ADS.aureus” vs. grupo de controlo AD?
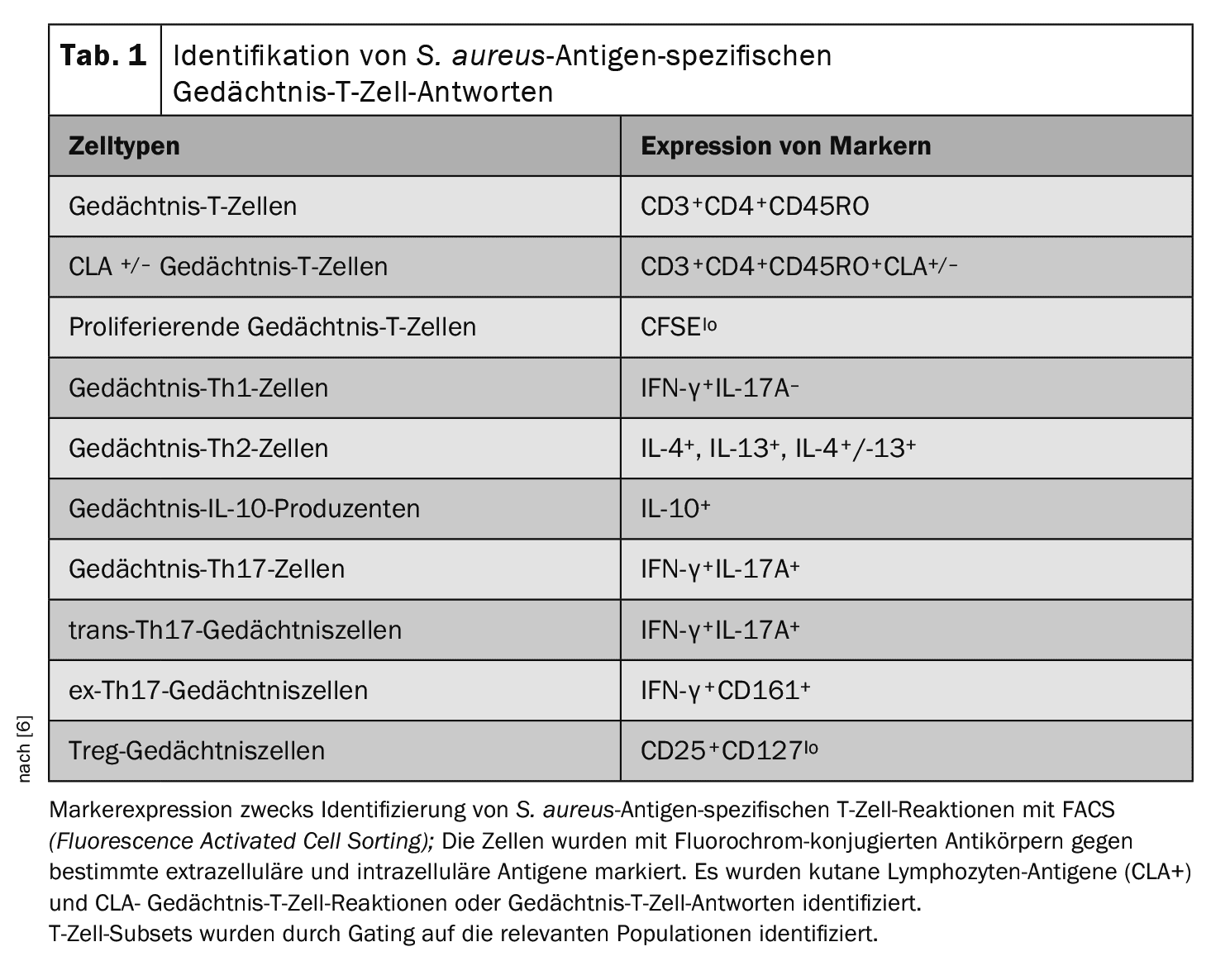
A análise inicial centrou-se na totalidade das respostas das células T de memória específicas do antigénio “AD.aureus” [6]. O homing seletivo da pele de células T de memória e efectoras é um processo imunológico importante na fisiopatologia da DA. O antigénio cutâneo associado aos linfócitos (CLA) é um recetor de homing cutâneo que define um subconjunto de células T de memória circulantes. Para compreender melhor as respostas das células T de memória específicas do antigénio da AD.aureus dirigidas para a pele, o painel de coloração foi alargado de modo a incluir o CLA [8].
Caracterização das células T circulantes e das respostas de células T específicas do antigénio de S. aureusassociadas a recaídas infectadas com S. aureus: Para determinar se podem ser identificados diferentes fenótipos de células T circulantes e respostas decélulas T específicas do antigénio de S. aureuspodem ser identificados entre “ADS.aureus”, o grupo de controlo da DA e os controlos saudáveis da pele, foram recolhidas células mononucleares do sangue periférico (PBMCs) de todos os 93 doentes recrutados [6]. As populações de leucócitos circulantes foram analisadas para determinar a proporção de subconjuntos específicos de células T por coloração citométrica de fluxo. Para avaliar as respostas sistémicas específicas do antigénio de S. aureus, os leucócitos totais foram marcados com éster succinimidílico de carboxifluoresceína (CFSE) e cultivados in vitro na presença de S. aureus inactivado pelo calor (estirpe AD08). As células estimuladas apenas com o meio ou com enterotoxina estafilocócica A (SEA) representaram controlos negativos e positivos, respetivamente. No dia 8, as células foram recolhidas e coradas com uma série de anticorpos conjugados com fluorocromos contra marcadores de superfície e intracelulares (Quadro 1). A triagem de células activadas por fluorescência (FACS) foi utilizada para identificar os subconjuntos de células T especificados.
As proporções dos subconjuntos de células T sistémicas circulantes e dos subconjuntos de células T de memória específicas do antigénio de S. aureusidentificados nos três grupos foram introduzidas num modelo multinomial Bayesiano.
- Resultados da análise: A caraterística com maior probabilidade de distinguir o “AD.aureus” dos controlos AD foi a das células T de memória produtoras de IL-10, com uma probabilidade média de mais de 80%, seguida das células Th1 circulantes, com uma probabilidade média de 75%, e das células Vδ2+ circulantes, com uma probabilidade média de 63%. Outras caraterísticas distintivas foram as células CD8+, CD4+, Vδ1+ e Th2 circulantes, bem como as células de memória ex-Th17 (um subconjunto funcionalmente diferente de células Th17 que já não produzem IL-17 mas IFN-γ), cuja probabilidade média de diferenciação se situava entre 50% e 60%.
- Para determinar a direccionalidade das caraterísticas com a maior probabilidade de associação com “AD.aureus” (>50%), foram utilizados gráficos de cumeeira para comparar a expressão das oito variáveis mais importantes em “AD.aureus” em comparação com os controlos de AD. As células IL-10+ de memória e as células Th1 circulantes foram suprimidas no “ADS.aureus” em comparação com o grupo de controlo da DA, enquanto as células Vδ2+ circulantes aumentaram no “ADS.aureus” em comparação com os controlos da DA. Além disso, as células de memória CD8+, CD4+ e ex-Th17 circulantes também foram suprimidas no grupo “ADS.aureus”, enquanto as células Th2 e Vδ1+ circulantes aumentaram.
Caracterização das respostas das células T específicas do antigénio de S. aureus na pele e dos marcadores inflamatórios locais em ligação com as crises infectadas por S. aureus: Ao adicionar CLA ao painel de coloração, as células T de memória específicas do antigénio de S. aureuspuderam ser identificadas na pele [8]. O CLA é uma molécula de adesão específica da pele e representa uma modificação pós-tradução do ligando-1 da P-selectina (PSGL-1) [9]. [10]O epítopo do ALC liga-se especificamente à E-selectina no endotélio das vénulas pós-capilares e permite a migração selectiva de linfócitos T da circulação periférica para a derme.
| Resumo |
| Na coorte pediátrica da DA estudada por Clowry et al. a infeção cutânea por S. aureusfoi mais fortemente associada a um aumento das quimiocinas cutâneas IP10 e TARC, que dirigem preferencialmente as células Th1 e Th2 para a pele [6]. As células T CD4+ e CD8+ sistémicas, com exceção das células Th2, foram suprimidas na infeção cutânea por S. aureus, especialmente as células Th1 circulantes, as células T de memória IL-10+ e as células de memória Th17 residentes na pele. Além disso, foi observada uma expansão sistémica das células T γδ em doentes com infeção cutânea por S. aureus. |
| [12] [13,14]O aumento tanto das células Th2 circulantes na análise apenas dos sistemas como da resposta de memória IL-4+IL-13+ (Th2) específica do antigénio de S. aureusna análise combinada reflecte a assinatura Th2 que caracteriza a DA e é reforçada por S. aureus . |
| A resposta de memória Th2 específica do antigénio de S. aureusCLA-IL-4+IL-13+ teve uma maior probabilidade de associação com “ADS.aureus”. Isto pode dever-se ao homing da população CLA+IL-4+IL-13+. Curiosamente, apenas os linfócitos T duplos produtores de IL-4 e IL-13 estavam consistentemente elevados em “ADS.aureus” em comparação com os controlos AD. |
| Os resultados deste trabalho sugerem que o aumento dos subconjuntos protectores de células T é uma estratégia terapêutica potencial para reduzir a predominância de S. aureusna DA. |
- Resultados da análise: Tal como anteriormente, os resultados identificaram respostas imunitárias mediadas por células T cutâneas, tanto sistémicas como localizadas, que discriminaram entre “AD.aureus”, controlos de DA e controlos saudáveis da pele com o maior poder discriminatório. A adição de respostas cutâneas sistémicas e de marcadores da resposta inflamatória cutânea aumentou de 8 para 30 o número de caraterísticas que discriminavam entre “AD.aureus”, controlos de DA e controlos saudáveis da pele com um grau de confiança superior a 50%, sugerindo que a adição destas caraterísticas adicionais proporciona uma melhor compreensão dos perfis imunitários locais associados à “AD.aureus”.
Literatura:
- Lee HJ, Kim M: A função de barreira da pele e o microbioma. Int J Mol Sci 2022 Oct 28; 23(21): 13071. doi: 10.3390/ijms232113071.
- Schöfer H, et al.: S2k + IDA guideline: Diagnosis and treatment of Staphylococcus aureus infections of the skin and mucous membranes.
2011. https://dgpi.de/wp-content/uploads/2013/04/013-038l_S2k_ Staphyococcus_aureus_2011-09.pdf, (último acesso em 02/08/2024). - Fölster-Holst R: O papel do microbioma da pele na dermatite atópica – correlações e consequências. JDDG 2022; 20(5): 571-578.
- Nakatsuji T, et al: Staphylococcus aureus explora os defeitos da barreira epidérmica na dermatite atópica para desencadear a expressão de citocinas. J Invest Dermatol 2016; 136: 2192-2200.
- Brauweiler AM, Goleva E, Leung DYM: As citocinas Th2 aumentam a morte de queratinócitos induzida pela toxina alfa de Staphylococcus aureus através do transdutor de sinal e ativador da transcrição 6 (STAT6). J Invest Dermatol 2014; 134: 2114-2121.
- 6 Clowry J, et al: Distinct T cell signatures are associated with Staphylococcus aureus skin infection in paediatric atopic dermatitis. JCI Insight 2024 Apr 11; 9(9): e178789.
- Alexander H, et al: O papel das infecções bacterianas da pele na dermatite atópica: declaração de peritos e revisão do Grupo de Infecções Cutâneas do Conselho Internacional do Eczema. Br J Dermatol 2020; 182(6): 1331-1342.
- de Jesús-Gil C, et al: A relevância translacional das células T positivas do antigénio associado a linfócitos cutâneos de memória circulante humana em doenças inflamatórias da pele. Front Immunol. 2021; 12: 652613. doi: 10.3389/fimmu.2021.652613.
- Fuhlbrigge RC, et al: Cutaneous lymphocyte antigen is a specialised form of PSGL-1 expressed on skin-homing T cells. Nature 1997; 389(6654): 978-981.
- Czarnowicki T, et al. Células T CLA+ circulantes na dermatite atópica e o seu possível papel como biomarcadores periféricos. Allergy 2017; 72(3): 366-372.
- Andersson AM, et al: Avaliação de biomarcadores na dermatite atópica pediátrica através de tiras de fita adesiva e biópsias cutâneas. Allergy 2022;77(5):1499-1509.
- Czarnowicki T, et al: Endótipos da dermatite atópica e implicações para terapêuticas direcionadas. JACI 2019; 143(1): 1-11.
- Karauzum H, Datta SK: Imunidade adaptativa contra staphylococcus aureus. Curr Top Microbiol Immunol 2017; 409: 419-439.
- Geoghegan JA, et al: Staphylococcus aureus e dermatite atópica: uma relação complexa e em evolução. Trends Microbiol 2018; 26(6): 484-497.
PRÁTICA DE DERMATOLOGIA 2024; 34(4): 26-27