No Congresso da EHA em Milão, o mieloma múltiplo foi o foco de vários eventos. Que resultados produzem actualmente os inibidores do proteasoma e os medicamentos imunomoduladores e o que prometem para o futuro? Como se pode melhorar a situação terapêutica dos doentes mais idosos? Três peritos forneceram informações a este respeito.
(ag) Falando sobre o uso de pomalidomida em mieloma múltiplo avançado recidivado e refractário (rrMM), o Prof. Meletios Dimopoulos, MD, Atenas, Grécia, disse: “Com base nas provas actualmente disponíveis, a pomalidomida e a dexametasona de baixa dose é bem tolerada em rrMM e é uma opção de tratamento eficaz para pacientes que esgotaram a terapia com lenalidomida e bortezomibe”. A dose inicial ideal é de 4 mg/tgl. Pomalidomida em dias 1-21 de cada ciclo de 28 dias, independentemente das co-morbilidades. Segundo o Prof. Dimopoulos, não é necessário utilizar a dosagem de 4 mg/tgl. ajustar para uma insuficiência renal ligeira a moderada (CrCl ≥45 ml/min). No entanto, deve ter lugar um acompanhamento atento dos efeitos secundários. A dexametasona é administrada como uma dose de 40 mg semanalmente. Para doentes com mais de 75 anos, reduzir para 20 mg.
“O tratamento deve ser continuado até que ocorra uma progressão ou toxicidade inaceitável. A modificação da dosagem é possível em doentes com neutropenia, trombocitopenia e outros eventos adversos de grau 3 – 4. A profilaxia deve ser considerada para prevenir infecções e tromboembolismo venoso (VTE)”, diz o perito. Uma destas inclui, por exemplo, a administração de factor estimulante de colónia de granulócitos (G-CSF) nos ciclos 1-3 para prevenir a neutropenia, antibióticos (ciclos 1-3) para reduzir o risco de infecção e tromboprofilaxia (aspirina e heparina fraccionada de baixo peso molecular em alto risco) para minimizar o risco de TEV em todos os doentes.
Paisagem Terapêutica 2014
Paul G. Richardson, MD, Boston, resumiu a situação relativa aos novos agentes da seguinte forma:
Os inibidores do proteasoma (IP) e os medicamentos imunomoduladores (IMiD) mostram melhorias significativas na sobrevivência global e sem progressão [1]. À medida que o seu modo de acção se torna melhor compreendido, novas combinações terapêuticas estão a emergir. Um problema grave é a diminuição da duração da resposta e das taxas de sobrevivência quando se somam os regimes terapêuticos de salvamento bem sucedidos [2]. Os inibidores proteasómicos da próxima geração, tais como o carfilzomibe, estão actualmente a ser investigados em combinação com lenalidomida e dexametasona em ensaios de fase III.
- A função imune na linha de base parece ser um ponto chave para o sucesso. Pode ser possível visá-los (com o bloqueio PD1/PDL1).
- Os anticorpos monoclonais mostram actividade em formas de doença de alto risco e representam novas vias de acção (tal como outras imunoterapêuticas). Daratumumab, um anticorpo monoclonal humano CD38, demonstrou a destruição efectiva das células tumorais CD38-expressoras em estudos in vitro. Suspeita-se, portanto, de eficácia clínica. O efeito sinérgico de uma combinação de daratumumab, lenalidomida e dexametasona está actualmente a ser investigado. Os resultados [3] foram apresentados na ASCO 2014 e são promissores no que diz respeito ao perfil de segurança e actividade.
- Muitos outros chamados “pequenos inibidores de moléculas” oferecem esperança. Um estudo sobre o inibidor de histone deacetylase (HDAC) panobinostato foi também apresentado pelo Prof. Richardson na ASCO deste ano: Mostrou que a combinação de panobinostato mais bortezomibe mais dexametasona melhorou muito significativamente a sobrevivência sem progressão (nomeadamente por uma mediana de 3,9 meses) em comparação apenas com os outros dois agentes. As taxas de resposta completas foram também quase duplicadas em comparação com o braço de controlo [4].
O factor “idade
O Prof. Dr. med. Thierry Facon, Lille, falou sobre as opções terapêuticas dos doentes com MM recentemente diagnosticados que não são elegíveis para transplante de células estaminais: “O mieloma múltiplo é principalmente uma doença dos idosos. A idade mais avançada, no entanto, exclui quase sempre o transplante.
Quais são as opções para esta população? No PRIMEIRO estudo [5], conseguimos mostrar que a terapia oral contínua com lenalidomida + dexametasona de baixa dose era significativamente superior à combinação tripla de melfalan + prednisona + talidomida e lenalidomida + dexametasona ao longo de 18 ciclos”. A sobrevivência sem progressão foi de 25,5, 21,2 e 20,7 meses, respectivamente. Também encontrámos um benefício desta opção de tratamento na análise intercalar da sobrevivência global. Por isso, deve-se considerar aqui o regime contínuo como um novo padrão”.
Os factores associados a uma sobrevivência mais curta durante a terapia com melfalan + prednisona + talidomida e/ou bortezomibe incluem de acordo com uma metástase [6]:
- Idade (>75 anos)
- Insuficiência renal
- efeitos secundários graves cardiovasculares/infecciosos
- Terminação da terapia
Um estudo também apresentado no Congresso da EHA de 2014 encontrou um risco significativamente aumentado de toxicidade e maus resultados (sobrevivência global) para pacientes frágeis (isto é, idosos, comorbidos, cognitiva e funcionalmente em más condições) [7].
Desafios para o futuro
De acordo com o Prof. Facon, grandes progressos têm sido feitos nos últimos anos nos pacientes MM que são adequados para um transplante de células estaminais.
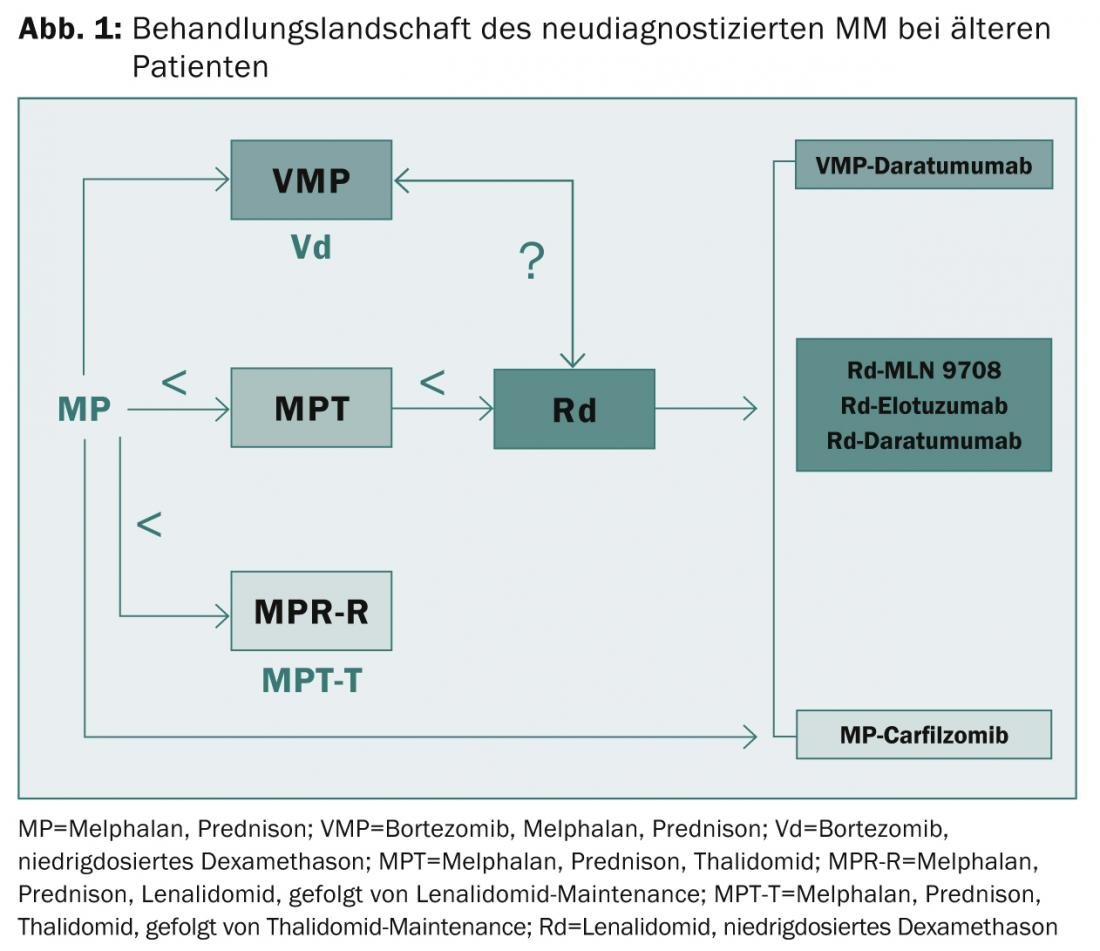
estão fora de questão. A sobrevivência sem progressão mediana foi prolongada de cerca de 10-15 para 25-30 meses e a sobrevivência global de cerca de 30 a 60 meses. “No entanto, os pacientes de alto risco continuam a sofrer de um resultado muito fraco mesmo com os novos agentes da primeira geração”, resumiu o perito. “A necessidade de opções de tratamento inovadoras e de uma avaliação de risco apropriada continua, portanto, a ser grande. Os doentes frágeis representam um desafio permanente. Neste contexto, pode ser útil avaliar com precisão o funcionamento dos órgãos, comorbilidades, fragilidades e deficiências”, explicou o Prof Facon. “PI, IMiDs e anticorpos monoclonais de segunda e terceira geração desempenharão um papel crucial na resolução destes problemas no futuro (Fig. 1)“.
Fonte: Congresso da EHA 2014, 12-15 de Junho de 2014, Milão
Literatura:
- Kumar SK, et al: Blood 2008 Mar 1; 111(5): 2516-2520.
- Kumar SK, et al: Mayo Clin Proc 2004 Jul; 79(7): 867-874.
- Plesner T, et al: J Clin Oncol 2014; 32: 5s (suppl; abstr 8533).
- Richardson PG, et al: J Clin Oncol 2014; 32: 5s (suppl; abstr 8510).
- Facon T, et al: EHA 2014 #Abstract S643.
- Bringhen S, et al: Haematologica 2013 Jun; 98(6): 980-987.
- Mina R, et al: EHA 2014 #Abstract P354.
InFo Oncologia & Hematologia 2014; 2(6): 31-32