Existem hoje várias opções de tratamento disponíveis para pacientes com insuficiência cardíaca crónica. Nem sempre é fácil fazer a escolha certa.
Os avanços no tratamento médico, especialmente da síndrome coronária aguda, levaram a um aumento constante da prevalência de insuficiência cardíaca crónica no passado recente – afectando actualmente cerca de 26 milhões em todo o mundo e cerca de 200.000 pacientes na Suíça. Uma vez que o curso da doença só pode ser atrasado, mas a doença subjacente não pode ser invertida, cada vez mais pacientes, mesmo os mais jovens, atingem uma fase gravemente sintomática com uma qualidade de vida severamente limitada e uma elevada mortalidade de um ano.
Decidir que doente deve receber que terapia adicional, e quando, é uma das tarefas mais difíceis aqui. O transplante cardíaco oferece geralmente uma qualidade de vida muito boa e os pacientes têm uma excelente sobrevida a longo prazo (após 12,4 anos, 50% dos pacientes transplantados ainda estão vivos [ISHLT]). No entanto, devido à contínua escassez de órgãos doadores, este tratamento só pode ser oferecido a alguns poucos pacientes seleccionados e na sua maioria mais jovens. Com um tempo médio de espera de 1-2 anos, o transplante não é uma opção na situação aguda; o apoio circulatório mecânico com um dispositivo de assistência ventricular esquerda (LVAD) pode então ser considerado como uma alternativa terapêutica a longo prazo (terapia de destino) ou ponte (ponte para transplante). T. Carrel e D. Reineke escreveram no
último número
deu uma boa visão geral do suporte circulatório mecânico na insuficiência cardíaca aguda e crónica.
Quem beneficia de um coração artificial e como se reconhece o tempo ideal para tal terapia?
Nos últimos anos, principalmente pacientes das categorias 1-3 do INTERMACS (IM) foram considerados para o implante de um dispositivo de assistência ventricular esquerda (LVAD) (Tab.1). Ou seja, pacientes com choque cardiogénico crítico (perfil IM 1), deterioração rápida apesar da terapia médica intensiva máxima (perfil IM 2) ou aqueles que não podem ser desmamados da terapia com inotrópicos (perfil IM 3); ou seja, aqueles pacientes para os quais a sobrevivência fora do hospital não teria sido possível sem terapia adicional.
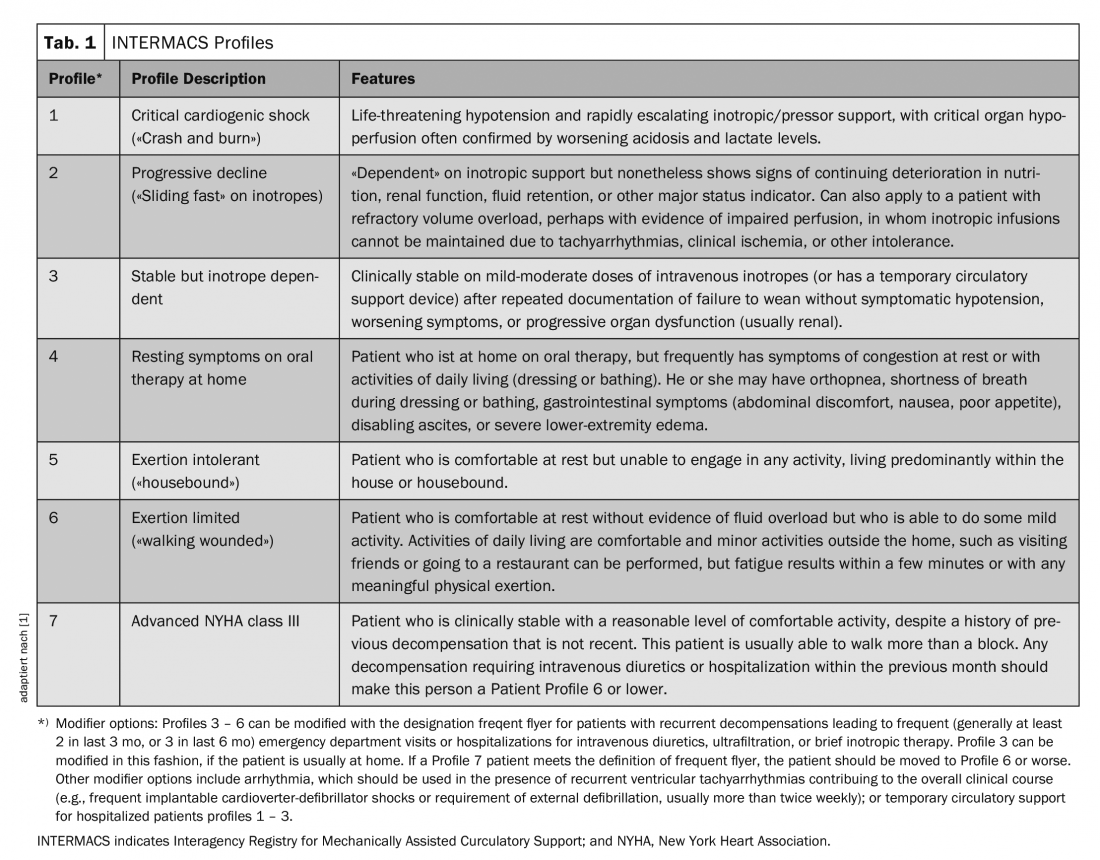
O maior registo de pacientes com dispositivos de apoio mecânico é mantido pela Sociedade Internacional para o Registo de Apoio Circulatório Mecânico de Transplante de Coração e Pulmão (IMACS). Inclui dados de 35 países, bem como dos principais registos da Europa (EUROMACS), dos EUA (INTERMACS) e do Japão (J-MACS) [2]. Entre Janeiro de 2013 e Dezembro de 2016, foi registado um total de 14.062 implantações de dispositivos, dos quais 93% eram LVADs puros, 5% sistemas de apoio biventricular e 2% “corações artificiais totais”. 83% dos pacientes estavam na categoria IM 1-3, pouco menos de 28% estavam activamente listados para transplante cardíaco, 41% receberam um LVAD como terapia definitiva (terapia de destino).
As taxas de sobrevivência de um e dois anos foram de 81% e 71%, respectivamente, para pacientes após a implantação do LVAD com fluxo contínuo. Os pacientes com perfil IM 1 tiveram uma taxa de sobrevivência significativamente pior num ano do que aqueles com perfil IM 3 (71% vs. 84%), e as melhores taxas de sobrevivência de dois e três anos foram observadas em pacientes com perfil IM 5-7, ou seja, pacientes ambulatórios com insuficiência cardíaca grave.
Estamos a esperar demasiado tempo?
O estudo ROADMAP abordou esta questão e incluiu 200 pacientes externos com insuficiência cardíaca grave (perfil IM ≥4, distância a pé em 6 minutos de teste a pé (6 MWT) <300 metros, pelo menos uma hospitalização ou duas apresentações ao serviço de urgência devido a insuficiência cardíaca no último ano) que não são elegíveis para transplante cardíaco foram incluídos neste estudo prospectivo multicêntrico não aleatório [3]. Juntamente com os seus médicos, os pacientes puderam escolher entre terapia medicamentosa óptima (OMT) ou implante de LVAD (terapia de destino). O ponto final primário foi a sobrevivência sob a terapia originalmente escolhida e uma melhoria de 75 metros ou mais nos 6 MWT. Os pontos finais secundários incluíram qualidade de vida (EuroQol 5 dimensões, questionário de 5 níveis, EQ-5D-5L) e pontuação de depressão (Questionário de Saúde do Paciente, PHQ-9) por questionário, classe NYHA e eventos adversos.
Como esperado, os pacientes que inicialmente optaram pela LVAD estavam globalmente mais doentes e tinham pior qualidade de vida (grupo LVAD vs. grupo OMT: qualidade de vida (EQ-5D VAS) 44 vs. 66 pontos, depressão (pontuação PHQ-9) 10 vs. 7 pontos, NYHA IV 52% vs. 25%, perfil Intermacs 4 65% vs. 34%, IM 5 ou superior 32% vs. 64%).
Apesar da linha de base menos favorável, mais pacientes mostraram uma melhoria no desempenho para a classe I/II da NYHA dois anos após a implantação do LVAD (69% vs. 37% sob OMT) e a distância percorrida a pé aumentou significativamente. Além disso, os pacientes relataram uma melhoria significativa na qualidade de vida (EQ-5D VAS +27Pkt) bem como no humor (pontuação de depressão PHQ 9 pontuação -4,6Pkt). Nenhuma alteração significativa pôde ser detectada no grupo OMT.
Curiosamente, no entanto, quase um quarto dos pacientes do grupo OMT (21%) optaram pela implantação do LVAD nos dois anos seguintes, a uma média de 4,9 meses após a inclusão. Mais de metade dos pacientes (55%) com implantação retardada do LVAD já estavam em terapia com inotrópicos nesta altura, 70% tinham atingido a fase IV da NYHA e a distância média a pé diminuiu de inicialmente 219 m para 90 m.
Se este grupo relativamente grande de pacientes com implante retardado de LVAD for adicionado ao grupo OMT (intention-to-treat), não há diferença significativa na sobrevivência entre os dois grupos. Contudo, se os separarmos de acordo com a terapia efectivamente recebida, vemos que apenas 41% do grupo OMT, mas 70% do grupo LVAD sobreviveu à terapia original.
O número de eventos adversos (EA) foi mais elevado no grupo LVAD do que no grupo OMT. As EAs mais comuns após a implantação do LVAD foram a hemorragia, infecções por via biliar, trombose da bomba e AVC; no grupo OMT, a insuficiência cardíaca agravou-se principalmente (50% dos pacientes). Surpreendentemente, apesar das EC e das hospitalizações mais frequentes (86% vs. 78%), os doentes com LVAD relataram melhor qualidade de vida e melhor humor.
Se dividirmos os pacientes de acordo com a gravidade da sua doença, verificamos que especialmente os pacientes com IM 4 beneficiaram, aqueles com IM 5-7 apenas se tivessem previamente comunicado uma qualidade de vida limitada.
Resumindo todos os resultados deste estudo, pode dizer-se que os pacientes com MI 5-7 que relatam uma qualidade de vida aceitável podem esperar com a implantação sem correr o risco de mortalidade excessiva desde que sejam monitorizados regularmente e de perto num centro (a deterioração mediana neste estudo ocorreu após apenas 4,9 meses).
Optimização terapêutica antes da implantação do LVAD
Desde a implementação do estudo ROADMAP e a última recolha de dados do registo IMACS em 2016, as terapias mais recentes (sacubitril-valsartan) e intervencionais (MitraClip®, ablação por fibrilação atrial) têm sido cada vez mais utilizadas na prática diária. No ensaio PARADIGM-HF, a terapia com sacubitril-valsartan mostrou uma redução relativa da mortalidade e hospitalizações devido a insuficiência cardíaca de 20% em menos pacientes (apenas menos de 1% tinha NYHA IV, a maioria aproximadamente 70% tinha NYHA II) em comparação com a terapia com enalapril [4]. Em CASTLE-AF, num grupo altamente seleccionado de pacientes com insuficiência cardíaca e fibrilação atrial, houve uma redução relativa de 38% no desfecho combinado de morte e re-hospitalização devido a insuficiência cardíaca após a ablação por fibrilação atrial [5]. O ensaio COAPT mostrou uma redução da mortalidade (RRR -38%) e da taxa de re-hospitalização devido ao HI (RRR -47%) após a implantação do MitraClip® em comparação com a terapia medicamentosa em doentes com regurgitação mitral secundária grave e insuficiência cardíaca [6]. Ainda que nem todos os doentes beneficiem destas terapias, temos cada vez mais possibilidades de ajudar estes doentes graves.
No entanto, também houve muitos desenvolvimentos técnicos nos últimos anos que reduziram a taxa de complicações após a implantação do LVAD. Por um lado, dados mais recentes permitem uma gestão mais optimizada dos pacientes (por exemplo, no Ensaio Suplementar ENDURANCE, foi conseguida uma redução significativa da taxa de AVC através de um melhor controlo da tensão arterial); por outro lado, a última geração do LVAD (HeartMate 3®, Abbott) também mostrou alterações técnicas [7]. No estudo MOMENTUM 3, a implantação do HeartMate 3® (uma bomba centrífuga) reduziu significativamente a taxa global de AVC (10% vs. 19%), com o número de AVCs graves (pontuação Rankin modificada de >3) permaneceu o mesmo), bem como uma taxa significativamente mais baixa de trombose possível ou confirmada da bomba (1,1% vs. 15,7%) em comparação com o HeartMate 2®. Nem um único HeartMate 3® teve de ser substituído ou explantado devido a suspeita de trombose da bomba, enquanto que este foi o caso em 12% dos doentes com HeartMate 2® [8].
A terapia optimizada para cada paciente
Com todas as opções técnicas, intervencionais e medicamentosas, podemos oferecer aos pacientes com insuficiência cardíaca muito mais opções hoje do que no passado. Ao mesmo tempo, isto também traz consigo a obrigação de encontrar a terapia mais adequada para cada paciente. A fim de dar aos doentes e aos seus familiares a oportunidade de lidar com todas as vantagens e desvantagens de cada terapia em paz e de realizar intervenções, se desejado, num ambiente eletivo, é importante conhecer os doentes numa fase precoce num centro de insuficiência cardíaca grave e coordenar mais cuidados juntamente com os médicos de clínica geral, cardiologistas e outras pessoas envolvidas no ambiente.
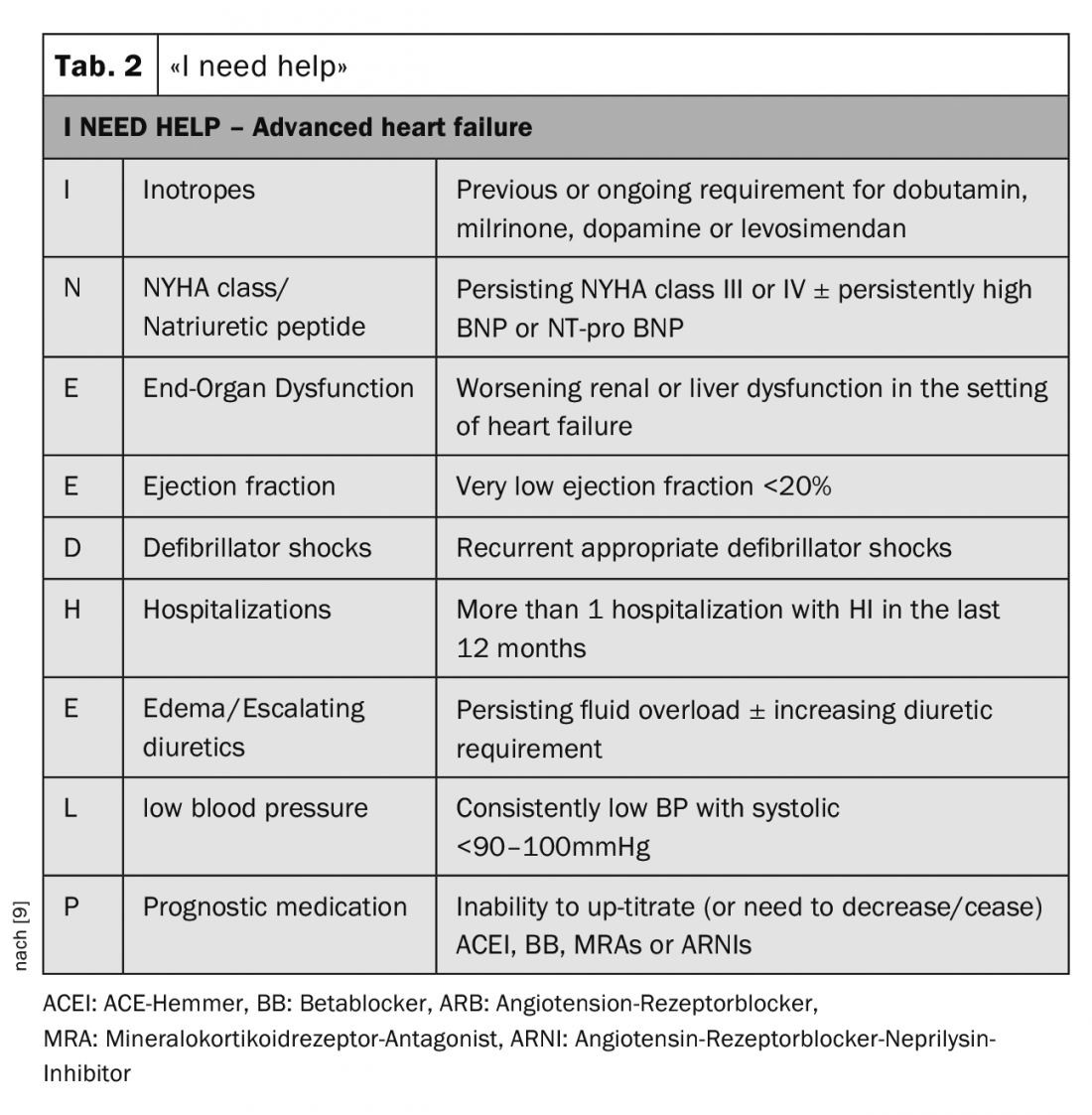
Para a identificação de doentes que necessitam de uma avaliação mais aprofundada num centro, a mnemónica “Preciso de ajuda” é muito útil (Tab. 2). Em particular, os doentes com descompensação cardíaca recorrente ou aqueles em que é impossível aumentar a medicação para insuficiência cardíaca ou que precisam mesmo de a reduzir, devem ser encaminhados para avaliação por um especialista.
A decisão final a favor ou contra uma LVAD deve ser tomada em conjunto com o doente, a sua família e os prestadores de cuidados (por exemplo, o médico de família, cardiologista, Spitex), tendo em conta os desejos e ideias do doente sobre a vida e incluindo a sua rede social (amigos, familiares) (Fig. 1).
Mensagens Take-Home
- Para pacientes com insuficiência cardíaca, temos agora um número crescente de terapias medicamentosas (sacubitril-valsartan), intervencionais (CRT, Mitralclip® para regurgitação mitral, ablação para fibrilação atrial) e técnicas (LVAD) disponíveis. A fim de dar aos doentes, familiares e médicos tratantes a oportunidade de discutir em paz todas as opções terapêuticas disponíveis e de encontrar o tratamento ideal para cada doente individual, é importante apresentá-los num centro de insuficiência cardíaca o mais cedo possível.
- Como guia para quando os pacientes devem ser enviados a um especialista de IH, o mais tardar, a mnemónica “Preciso de ajuda” é útil.
- Nos últimos anos, uma melhor gestão dos pacientes, bem como os avanços técnicos, levaram a uma redução de complicações graves (por exemplo, trombose da bomba, AVC) para os pacientes com LVAD. Devido à crescente escassez simultânea de órgãos doadores, a implantação de LVAD é, portanto, uma boa alternativa para um número cada vez maior de pacientes com insuficiência cardíaca grave.
- Os pacientes com perfil INTERMACS 5-7 e qualidade de vida preservada devem esperar com a implantação do LVAD. Uma vigilância apertada é essencial para não perder os primeiros sinais de uma deterioração frequentemente rápida e assim evitar intervenções arriscadas de alto risco.
- Os pacientes com perfil INTERMACS 5-7 com uma qualidade de vida limitada devem ponderar se estão dispostos a aceitar uma maior taxa de complicações para a hipótese de uma melhoria na qualidade de vida.
Literatura:
- Yancy CW et al: 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. (Adaptado de Stevenson et al. INTERMACS perfis de insuficiência cardíaca avançada: o quadro actual. J Transplante de pulmão de coração. 2009;28:535-4). Circulation 2013;128(16):e240-327.
- Kirklin JK, et al: J Heart Lung Transplant 2018; 37(6): 685-691.
- Starling RC, et al: Risk Assessment and Comparative Effectiveness of Left Ventricular Assist Device and Medical Management in Ambulatory Heart Failure Patients: The ROADMAP Study 2-Year Results. JACC Heart Fail 2017; 5(7): 518-527.
- McMurray JJ, et al: Angiotensin-neprilysin inibição versus enalapril na insuficiência cardíaca. N Engl J Med 2014; 371(11): 993-1004.
- Marrouche NF, et al: Catheter Ablation for Atrial Fibrillation with Heart Failure (Ablação por Fibrilação Atrial com Insuficiência Cardíaca). N Engl J Med 2018; 378(5): 417-427.
- Stone GW, et al: Transcatheter Mitral-Valve Repair in Patients with Heart Failure. N Engl J Med 2018; 379(24): 2307-2318.
- Milano CA, et al: HVAD: The ENDURANCE Supplemental Trial. JACC Heart Fail 2018; 6(9): 792-802.
- Mehra MR, et al: Resultados de Dois Anos com uma Bomba Cardíaca Magneticamente Levitada na Insuficiência Cardíaca. N Engl J Med 2018; 378(15): 1386-1395.
- Baumwol J: “Preciso de ajuda” – uma mnemónica para ajudar no encaminhamento atempado em caso de insuficiência cardíaca avançada. J Transplante de pulmão de coração 2017; 36(5): 593-594.
CARDIOVASC 2019; 18(1): 16-19