Com um tempo ensolarado no início da Primavera, foi difícil ficar nas salas de conferências sem luz no 25º Curso de Formação Contínua de Médicos em Oncologia Clínica em St. Gallen, mas valeu a pena. O PD Dr. Markus Jörger, Oncologia e Hematologia, St. Gallen, forneceu na sua palestra informações completas sobre as interacções medicamentosas nas terapias oncológicas.
A definição de interacções adversas de drogas (AMI) é a seguinte: “Uma alteração mensurável no efeito específico do medicamento (em magnitude ou duração) devido à administração prévia ou simultânea de outro medicamento”. Na prática, contudo, a AMI pode ser causada não só por medicamentos, mas também por alimentos, substâncias herbais, substâncias nocivas como o álcool e o tabagismo, e outras substâncias químicas. O risco de IAM aumenta com o número de drogas administradas, o uso de drogas com uma gama terapêutica estreita, o aumento do comprometimento das funções dos órgãos (fígado, rim) e as comorbilidades. Além disso, as pessoas com sensibilidades especiais (excesso de peso, cachexia, velhice) são mais afectadas pelo AMI.
Farmacêutica, cinética e dinâmica
Basicamente, a AMI pode ser dividida em três formas:
- As interacções farmacêuticas devem-se às propriedades químicas dos princípios activos. Por exemplo, a dependência do pH da absorção gástrica de um fármaco é clinicamente significativa.
- Nas interacções farmacocinéticas, um fármaco afecta a absorção, distribuição, metabolismo ou eliminação (ADME) de outro fármaco. As alterações nas concentrações plasmáticas têm um efeito sobre a actividade ou toxicidade de outra substância activa, pelo que pode ser necessária uma redução ou aumento da dose. As enzimas hepáticas CYP-P450 e a eliminação renal de fármacos são importantes.
- Nas interacções farmacodinâmicas, um fármaco altera a eficácia de um segundo fármaco sem baixar ou aumentar a concentração plasmática. Estas interacções também podem ser utilizadas terapeuticamente: Exemplos típicos são a combinação de diferentes anti-hipertensivos, a administração de antagonistas em casos de intoxicação ou a combinação de citostáticos em oncologia.
Cuidado com os alimentos
Os AMIs ocorrem frequentemente: De acordo com as estimativas, 7% de todas as reacções adversas aos medicamentos (RAM) em doentes hospitalizados e 30% de todas as RAM fatais são devidas à IAM. Quanto mais medicamentos um paciente toma, maior é o risco.
Basicamente, a maioria dos AMIs são evitáveis se se estiver consciente do risco e das situações de risco especial (Tab. 1). Os medicamentos de alto risco incluem não só os conhecidos grupos de substâncias (drogas oncológicas, AINEs, anticoagulantes, etc.), mas também preparações à base de ervas como a equinácea e a erva de São João. Este último é um forte indutor de CYP e pode assim reduzir a eficácia de outros medicamentos. Os dois efeitos mais significativos da erva de São João são sobre os efeitos da ciclosporina (crises de rejeição de órgãos) e dos contraceptivos (hemorragias intermitentes e gravidezes indesejadas). A soja contém flavonóides com efeitos pró-estrogénicos, pelo que os doentes com cancro da mama e tratamento com tamoxifeno devem ser cuidadosos ao tomarem produtos de soja.
Especialmente com os medicamentos orais oncológicos, as interacções droga-alimentar podem também desempenhar um papel importante. Uma refeição rica em gordura aumenta a absorção de inibidores de tirosina quinase (TKIs) e, portanto, o risco de efeitos secundários. O jejum é portanto recomendado para a maioria dos TKI, embora haja excepções como o imatinib ou o dasatinib. “Para evitar tanto quanto possível a IAM, é necessário informar os doentes quando devem tomar o medicamento”, salientou o Dr. Jörger. “Em St. Gallen, as enfermeiras, que também distribuem os medicamentos, têm as fichas correspondentes para que possam transmitir a informação em pormenor aos pacientes. Os sumos de fruta (sumo de maçã, sumo de toranja, sumo de laranja, etc.) também podem ser problemáticos: Abrandam a excreção e assim aumentam o risco de IAM e complicações como o prolongamento do QT, arritmias ou mielossupressão.
Na segunda parte da sua apresentação, o Dr. Jörger apresentou vários casos de AMI.

Capezitabine e Marcoumar
Uma paciente de 66 anos com carcinoma de mama metastásico estava a receber Marcoumar desde Janeiro de 2007 devido a embolias pulmonares bilaterais. Desde Janeiro de 2008, o doente foi tratado com Capezitabine (Xeloda®). Em Novembro, o paciente desenvolveu um hematoma subdural crónico. A razão para tal foi rapidamente encontrada: O Capezitabine é um forte inibidor do CYP2C9 e assim previne a degradação de Marcoumar. O Dr. Jörger disse que os pacientes em tratamento com Xeloda® devem ser trocados de Marcoumar para uma heparina de baixo peso molecular (LMWH) para evitar complicações hemorrágicas.
Erlotinib e simvastatin
Uma paciente feminina de 75 anos com adenocarcinoma do pulmão foi tratada com erlotinibe (Tarceva®) como terapia de segunda linha. Após seis semanas, foi internada no hospital como um caso de emergência com dores musculares e astenia, e foi-lhe diagnosticada rabdomiólise aguda. Devido a comorbidades, o doente tinha tomado aspirina, atenolol, amlodipina e sinvastatina durante anos sem complicações. A inibição de CYP3A4 por erlotinibe tinha aumentado a concentração plasmática de sinvastatina, levando à rabdomiólise. A paragem da sinvastatina após a fase de recuperação permitiu um tratamento posterior sem problemas com erlotinibe.
O erlotinibe oral EGFR TKI interage com toda uma gama de substâncias. Devido à indução de CYP3A4, há um risco de eficácia reduzida quando combinado com agentes como a fenitoína, a erva de São João, a dexametasona, etc. Este problema também existe nos fumadores, que têm níveis plasmáticos significativamente mais baixos do que os não fumadores na dose padrão de 150 mg/d. Por outro lado, existe o risco de aumento da toxicidade quando o erlotinibe é combinado com azóis, sumo de toranja, macrólidos, antagonistas de Ca, nelfinavir, etc. A ingestão simultânea de erlotinibe e inibidores da bomba de protões (PPI) deve ser evitada se possível, ou a ingestão deve ser cronometrada separadamente (erlotinibe de manhã, PPI à noite).
Sunitinibe e carbamazepina
Num paciente de 76 anos de idade com carcinoma de células renais metastásicas que foi tratado com carbamazepina e fenittonina, a terapia com sunitinib (Sutent®) estava em discussão. Sunitinib é um substrato de CYP3A4, carbamazepina e fenitoína são fortes indutores de CYP3A4. Nesta situação, recomenda-se que o neurologista mude para um medicamento antiepiléptico não indutor de enzimas (não EIAED) (Tab. 2) . Se a combinação de sunitinibe e um EIAED for inevitável, um aumento gradual da dose de sunitinibe deve ser considerado, pelo menos, se bem tolerado, para evitar a perda de eficácia.
Capecitabina e diclofenaco
Um paciente de 62 anos com cancro rectal recebeu quimioterapia adjuvante com capecitabina (Xeloda®). Após cinco meses, foi admitido de emergência com febre neutrogénica, diarreia, erupção cutânea e eritema nas palmas das mãos e na sola das mãos. Foi feito um diagnóstico de síndrome do pé-mão e disfunção renal subaguda. O doente tinha tomado doses elevadas de diclofenaco devido a uma lumbalgia aguda.
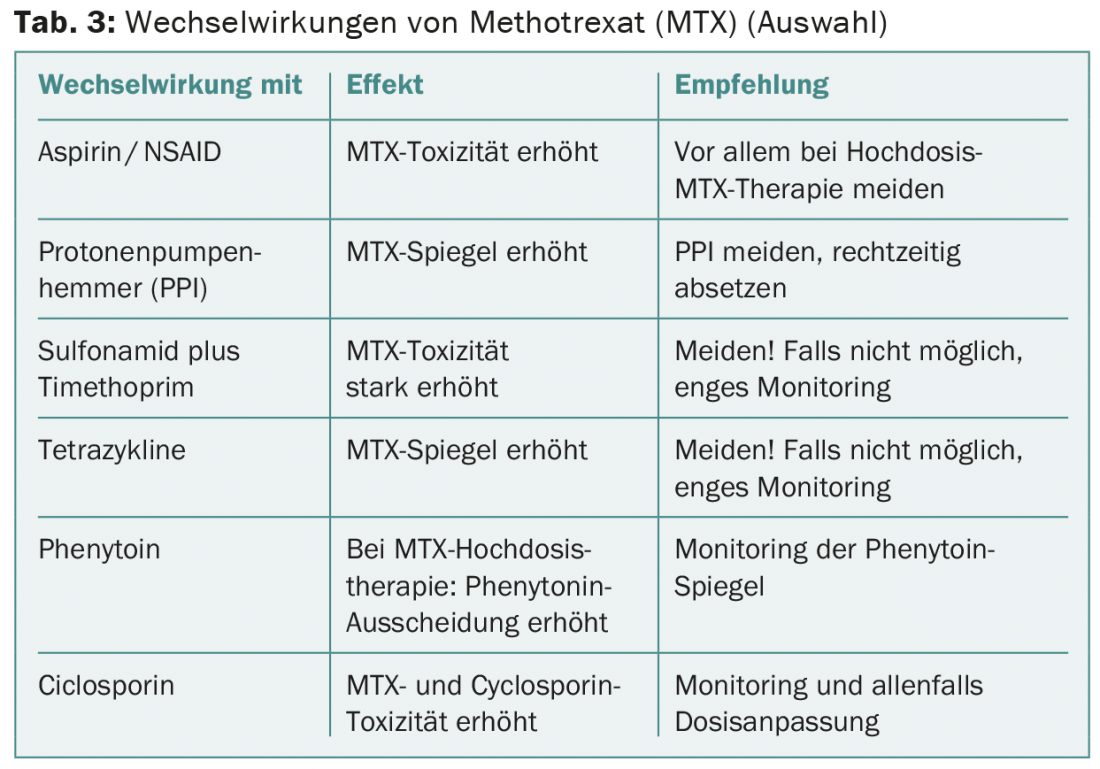
AMI com metotrexato
O metotrexato (MTX) interage com muitas outras drogas (tab. 3) . Um paciente de 65 anos com carcinoma laríngeo foi tratado com MTX 60 mg i.v. após uma recidiva local. Uma semana mais tarde, sofreu de estomatite grave, exantema ulcerativo e neutropenia grave. Além disso, houve pneumonia, da qual o doente acabou por morrer. Tinha tomado mefenazida intermitentemente, o que, neste caso, tinha provavelmente levado a uma disfunção renal subaguda e atrasado gravemente a eliminação da MTX.
AMI com imatinib
Um doente de 75 anos com leucemia mielóide crónica (LMC) iniciou a terapia imatinibular (Gleevec®). Um ano mais tarde, foi admitido como um caso de emergência com dor abdominal superior, icterícia e enzimas hepáticas gravemente elevadas. Foi feito um diagnóstico de hepatite lobular subaguda, muito provavelmente de toxicidade e medicina. Dois meses antes, o paciente tinha começado a tomar uma preparação de ginseng. No entanto, o ginseng é um inibidor do sistema CYP3A4 e também inibe a degradação do imatinibe, o que levou ao aumento dos níveis de imatinibe plasmático e toxicidade severa neste paciente. Após a descontinuação do medicamento, as enzimas hepáticas normalizaram no prazo de três semanas e o imatinibe pôde ser reintroduzido sem qualquer problema.
A combinação de imatinib e simvastatin é também problemática. Antes de iniciar a terapia imatinibular, recomenda-se, portanto, a mudança da sinvastatina para a pravastatina.
Além disso, deve-se ter cuidado quando o paracetamol e o imatinibe são administrados simultaneamente, pois a toxicidade hepática também pode ocorrer com esta combinação. A dose máxima diária correspondente de paracetamol é de cerca de 1300 mg e não deve ser excedida, se possível.
Conclusão para a prática
- Os AMI são comuns e clinicamente significativos.
- Muitos AMIs podem ser evitados.
- Evitar o mais possível a polifarmácia: Observar cuidadosamente a lista de medicamentos e avaliar se algo pode ser omitido ou alterado.
- O conhecimento dos medicamentos e suplementos específicos de banda desenhada é importante.
- Apoio ao cumprimento de medicamentos.
- Pedir aos pacientes para dizerem se estão a tomar produtos adicionais (medicamentos OTC, ervas medicinais ou remédios alternativos).
Fonte: 25º Curso de Formação Contínua de Médicos de Oncologia Clínica, St. Gallen, 19-21 de Fevereiro de 2015
InFo ONCOLOGy & HaEMATOLOGy 2015; 3(3-4), 30-32