A trombose venosa profunda desenvolve-se em 1/1000 pessoas por ano na Europa Ocidental. Na fase aguda, é crucial prevenir a complicação da embolia da artéria pulmonar. Hoje em dia, isto é efectivamente feito no diagnóstico com anticoagulação. No entanto, vários milhares de pessoas morrem deste tromboembolismo pulmonar todos os anos porque o diagnóstico não foi feito.
A trombose venosa profunda desenvolve-se em 1/1000 habitantes da Europa Ocidental por ano [1]. Na fase aguda, é crucial prevenir a complicação da embolia da artéria pulmonar. Hoje em dia, isto é efectivamente feito no diagnóstico com anticoagulação. No entanto, cerca de 25.000 pessoas na Alemanha morrem anualmente deste tromboembolismo pulmonar, porque os pacientes com embolia aguda da artéria pulmonar, entre outras coisas, morrem subitamente ou o diagnóstico é feito demasiado tarde.
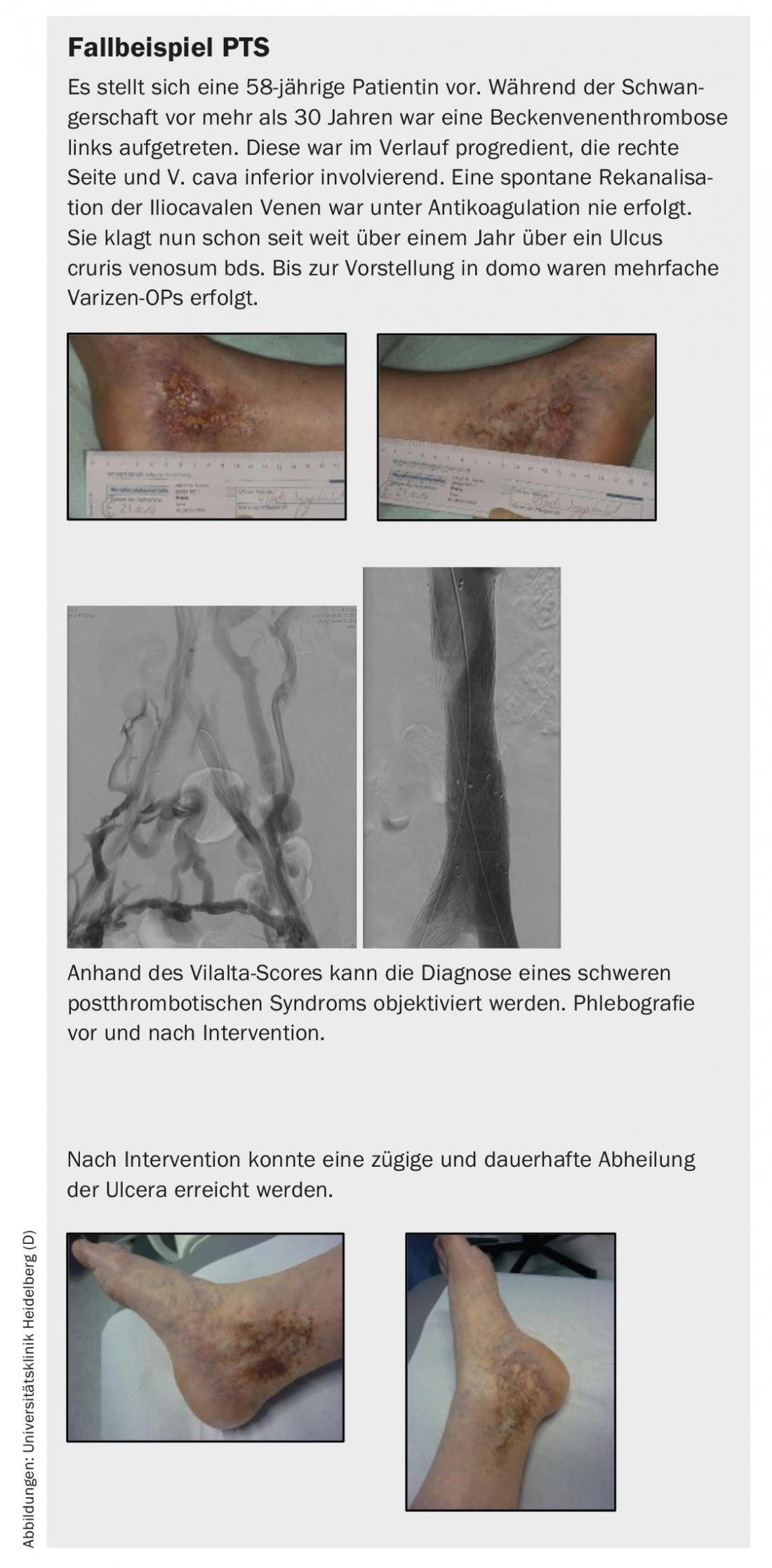
Por mais eficaz que a anticoagulação seja na prevenção do tromboembolismo, é ineficaz na prevenção da síndrome pós-trombótica (PTS). A longo prazo, os doentes com trombose venosa profunda desenvolvem síndrome pós-trombótica em 20-83%, dependendo da localização e extensão da trombose [2,3]. As veias ilíacas estão envolvidas na trombose iliofemoral em cerca de 40% dos casos e, apesar da anticoagulação, a recanálise não é bem sucedida em 70% dos casos [4,5]. Isto leva então à obstrução crónica da drenagem e, como resultado, ao PTS.
O PTS resume as queixas devidas a veias profundas danificadas e/ou bloqueadas causadas por trombose venosa profunda. Estes incluem geralmente uma sensação de peso, paraestesia, prurido, cólicas, dor e edema periférico nas pernas. Há também induções cutâneas, hiperpigmentação, vermelhidão, ectasia venosa, úlceras de perna e dores de compressão na barriga da perna. Em particular, a claudicação venosa é um sintoma principal, que, tal como a claudicação intermitente, leva a uma limitação da distância a pé. A ulceração como fase final da sintomatologia causa custos elevados para o sistema de saúde devido a consequências socioeconómicas como a mobilidade reduzida e a necessidade de cuidados [6,7].
Trombose venosa profunda
Diagnóstico: Em casos de suspeita de trombose venosa profunda, o procedimento de diagnóstico é claramente definido nas directrizes. Qualquer suspeita de trombose venosa profunda deve ser esclarecida imediatamente a fim de iniciar uma terapia anticoagulante, se necessário. Esta é a única forma de reduzir o risco de embolia da artéria pulmonar e parar a progressão da TVP [8]. A avaliação inclui primeiro um historial médico e um exame físico. Devido à única baixa sensibilidade, isto por si só não é suficiente para diagnosticar ou excluir trombose. Portanto, dependendo da probabilidade clínica (CL), seguem-se diagnósticos laboratoriais, especialmente a determinação dos dímeros D, e/ou ultra-sons de compressão. Existem pontuações validadas para determinar o KW para a presença de DVT, tais como a pontuação frequentemente utilizada em Wells [8].
Usando a pontuação, são questionados factores como a doença tumoral ou a diferença de circunferência das pernas e é dada uma pontuação de 0 ou 1. Isto resulta num KW alto ou baixo para a presença de DVT. Isto deve ser documentado como uma etapa de diagnóstico separada. Se o KW for baixo, o teste D-dímero costuma seguir-se. Se isto for negativo, é altamente provável que a TVP tenha sido excluída e não seja necessário realizar mais testes de diagnóstico [8]. Se a probabilidade clínica for alta, segue-se uma ultra-sonografia de compressão. Se isto for inconclusivo, devem ser realizadas mais imagens ou um exame de ultra-som repetido após 3-5 dias. Recomenda-se que toda a perna afectada, incluindo as veias pélvicas, seja examinada através de ultra-sons de compressão. Se a imagiologia de diagnóstico não estiver disponível atempadamente, a anticoagulação é indicada em casos de elevada probabilidade clínica após pesagem do risco de hemorragia [8].
Terapia: O tratamento da TVP inclui anticoagulação, terapia de compressão e mobilização rápida. Também é recomendado parar ou alterar o possível factor de risco de desencadeamento, como a contracepção, e tratar uma doença subjacente recém-diagnosticada, como a doença tumoral. A anticoagulação foi expandida nos últimos anos pelos Novos Anticoagulantes Orais (NOAKs), o que certamente facilitou a gestão dos pacientes. Contudo, os NOAKs estão cada vez mais a interagir com outros medicamentos, tais como antibióticos e antiarrítmicos. Isto deve ser verificado no momento da preparação e durante as verificações do progresso.
Após terapia de manutenção por 3-6 meses, deve ser discutida a terapia de manutenção prolongada. A Sociedade Alemã de Angiologia tem um esquema de semáforo adequado para ajudar a decidir se deve continuar a terapia (Tab. 1). Deve ser mencionado que os dois estudos com rivaroxaban e apixaban para terapia de manutenção prolongada com doses mais baixas ainda não receberam atenção aqui, e estes também só são aprovados por 1 ano. [9,10]. Uma clarificação trombofílica pode ser realizada em doentes seleccionados durante o curso, mas só raramente tem uma consequência terapêutica. Exemplos de uma consequência terapêutica têm síndrome antifosfolipídica, deficiência de antitrombina III ou deficiência significativa de inibidores.

Um controlo clínico do doente com TVP deve ser realizado nos primeiros 21 dias, um controlo sonográfico após 3 meses ou após a conclusão da anticoagulação.
Para a terapia de compressão, apesar de todas as fraquezas do protocolo de estudo, o ensaio de Sox não mostrou nenhuma vantagem para a terapia de compressão na prevenção da síndrome pós-trombótica (PTS) [13]. No entanto, a compressão é indispensável para aliviar os sintomas; a terapia de compressão deve ser realizada especialmente nas primeiras semanas.
O DVT de origem pouco clara tem a maior taxa de recorrência, até 9%, no primeiro ano. A discussão sobre se os doentes com TVP têm um risco acrescido de doença tumoral ainda não foi decidida de forma conclusiva [14,15]. Se o rastreio for realizado, um rastreio adequado à idade mais a história e o laboratório parecem ser suficientes [16]. Em pacientes mais jovens, um trabalho de vasculite pode ser útil.
Os doentes com tumor têm um risco diferente de TVP, dependendo da entidade tumoral e da localização. Os pacientes com tumor pancreático têm o maior risco de TVP. A ocorrência de TVP em doentes com tumores está associada a um resultado significativamente pior [17]. Os doentes com tumores têm uma probabilidade clínica mais elevada desde o início e os dímeros D são regularmente elevados per se. Por conseguinte, a clarificação de uma possível TVP em doentes com tumores é recomendada principalmente com a ajuda da sonografia duplex a cores e, se necessário, de outras imagens [18]. Os doentes tumorais devem ser tratados com uma heparina de baixo peso molecular durante 3-6 meses, uma vez que esta é superior à heparina não fracionada [19,20] e Marcumar [21–23]. A dosagem e a duração devem ser decididas em consulta com os colegas de tratamento oncológico. Devido ao risco muito elevado de recorrência de até 20%, recomenda-se a anticoagulação a longo prazo, dependendo do risco de hemorragia, pelo menos enquanto a doença tumoral estiver presente, embora os dados sobre isto sejam limitados.
Em comparação com a heparina de baixo peso molecular, foram realizados vários estudos com os NOAK em pacientes com tumores. Edoxaban em comparação com a dalteparina mostrou uma taxa de recorrência reduzida (7,9% vs. 11,3%), mas ao custo de um aumento da taxa de sangramento (6,9% vs. 4,0%) aos 12 meses [24]. O aumento da taxa de hemorragia ocorreu principalmente no tracto gastrointestinal em pacientes com tumores gastrointestinais. O estudo piloto Select-D investigou o rivaroxaban em comparação com o dalteparin durante um período de 6 meses. Mais uma vez, houve uma vantagem para o rivaroxaban na taxa de trombose recorrente (4% vs. 11%), enquanto a taxa de sangramento para hemorragias importantes foi aumentada (6% vs. 4%) [25]. Neste estudo, o aumento da taxa de hemorragia gastrointestinal também foi perceptível. Após a actualização das directrizes a este respeito, os dados sobre apixaban ainda se encontravam pendentes. Um ensaio internacional randomizado conseguiu mostrar a não-inferioridade do apixaban à dalteparina em termos de taxa de recorrência (5,6% vs. 7,9%). Apixaban, contudo, ao contrário do edoxaban e do rivaroxaban, não aumentou as complicações hemorrágicas (3,8% vs. 4,0%) [26] numa população de doentes comparável.
Em resumo, os NOAK parecem ser uma alternativa para os pacientes com tumores, mas os pacientes com tumores gastrointestinais ou urogenitais ainda precisam de ser muito cuidadosos. De acordo com estes dados, os NOAK poderiam ser utilizados a partir do diagnóstico de TVP, mas isto depende da entidade tumoral, da fase tumoral e do actual tratamento tumoral.
A trombose da perna (trombose venosa profunda distal), tal como a trombose da veia muscular, é anticoagulada durante um máximo de 3 meses devido ao seu curso prognóstico favorável, mesmo em caso de recidiva ou génese idiopática [27,28]. No entanto, não há provas claras da necessidade de anticoagulação, e a dosagem está actualmente em discussão.
|
Pontuação LEFT
|
Uma das causas mais comuns de morte durante a gravidez e o puerpério é a TVP, com um risco quatro vezes maior [29]. A TVP ocorre na perna esquerda em 70-90% dos casos em mulheres grávidas [30,31]. A trombose venosa pélvica também é diagnosticada com maior frequência durante a gravidez. A pontuação LEFt com um elevado valor preditivo negativo é portanto utilizada para o diagnóstico, mas requer uma avaliação adicional numa população de doentes maior (caixa) . Os D-dimers são elevados na gravidez, mas não são conhecidos de Morse et al. e Chan et al. isto pode ser adaptado à idade gestacional [32,33]. No entanto, estudos recentes indicam uma prática clínica pobre da utilização exclusiva de D-dimers para excluir a TVP, fora dos doentes de alto risco [34]. Pelo contrário, as regras de previsibilidade clínica parecem úteis em combinação com testes de D-dímero para poupar radiação quando se suspeita de embolia pulmonar.

A este respeito, o algoritmo de anos de gravidez adaptados proposto nas actuais directrizes do CES para a embolia pulmonar não deve passar despercebido [35,36]. No entanto, em última análise, o ultra-som de compressão deve ser utilizado regularmente para excluir a TVP durante a gravidez, se necessário também na posição lateral. Se não for possível chegar a uma conclusão sobre a DVT aqui, recomenda-se a obtenção de imagens utilizando a flebografia de MR [37], evitando o gadolínio e utilizando sequências melhoradas sem contraste [8]. Se o ultra-som de compressão for negativo, recomenda-se uma verificação 7 dias depois [8].
Se for detectada TVP, recomenda-se a anticoagulação com heparinas, de preferência heparina de baixo peso molecular, que deve ser realizada durante 3 meses com uma dose terapêutica. Posteriormente, a redução da dose para intermédio (2× profiláctico) ou profiláctico pode ser reduzida [8]. No entanto, a anticoagulação deve ser continuada durante pelo menos 6 semanas pós-parto [38]. Os NOAK estão contra-indicados durante a gravidez devido à sua toxicidade placentária, mas também durante o período de amamentação devido à falta de dados de segurança [39].
Em pacientes com sintomas pronunciados devido a trombose aguda da veia pélvica descendente, deve ser discutida uma abordagem endovascular com baixo risco de hemorragia. A trombose descendente tem geralmente origem numa estenose/oclusão na veia cava inferior e/ou veia ilíaca, resultando num rápido crescimento descendente do trombo, levando a uma rápida sintomatologia intensa no doente afectado. Os pacientes com este tipo de trombose beneficiam de um procedimento intervencional de acordo com uma análise de subgrupo do Ensaio de Atracção [11]. Uma vez que se trata sobretudo de pacientes jovens, a exposição à radiação deve ser minimizada ou contornada com a ajuda de terapia endovascular guiada por ultra-sons (Fig. 1). Sob orientação de ultra-sons, a trombectomia, a terapia de lise local, a PTA e o implante de stents podem ser realizados, como parcialmente demonstrado no seguinte relatório de caso [12].
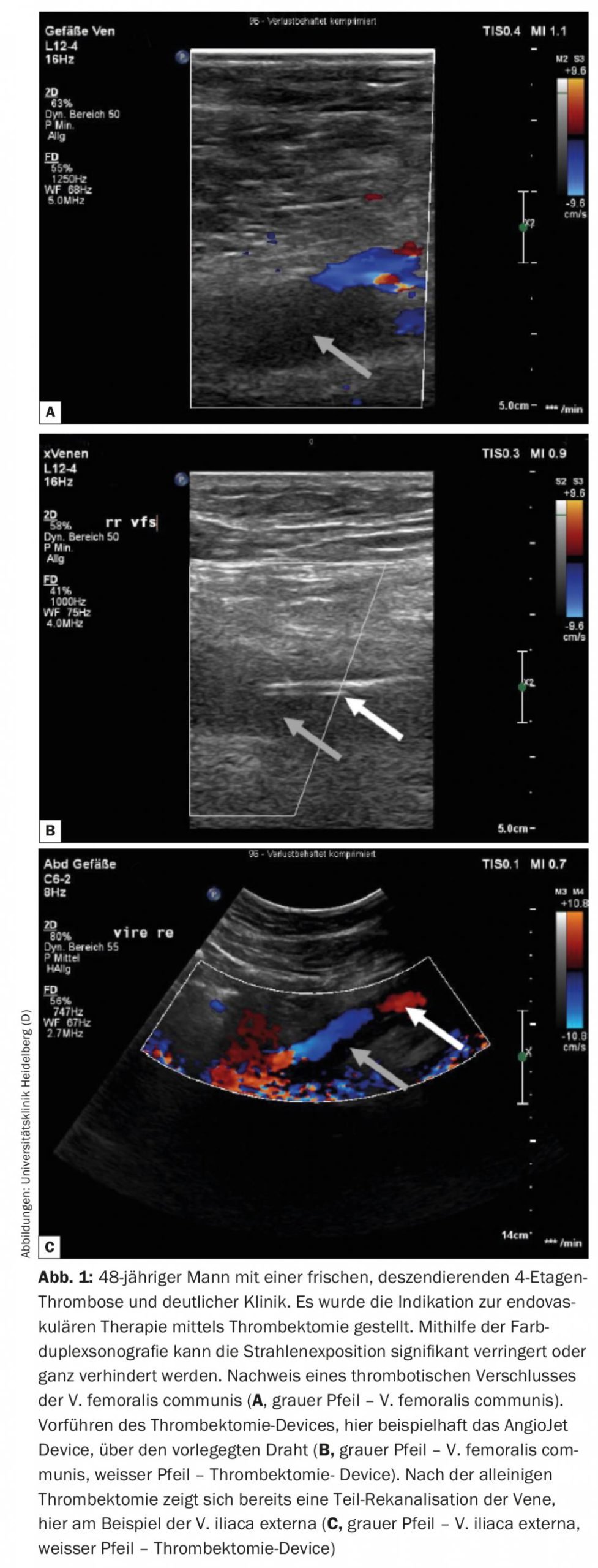
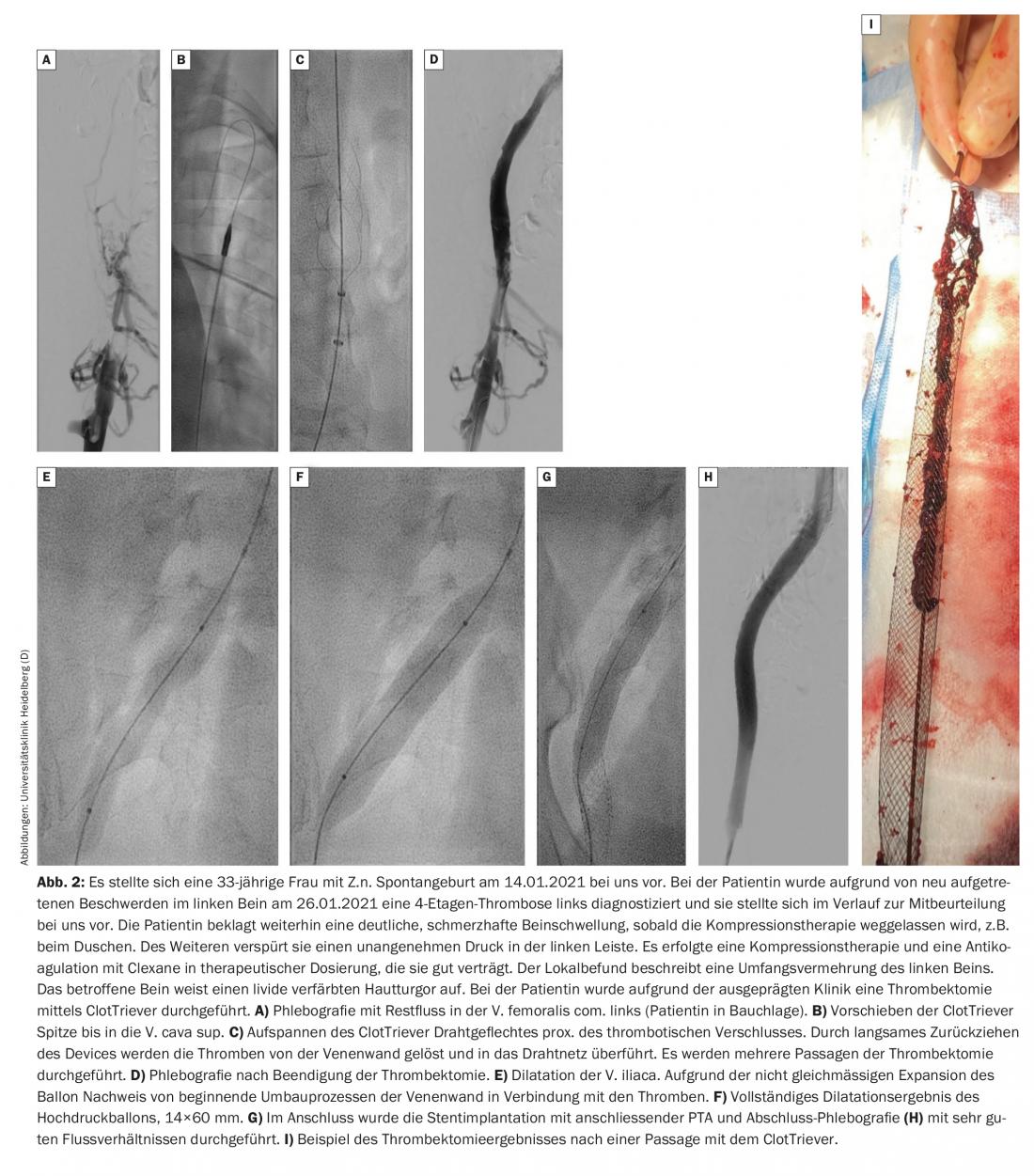
De acordo com o protocolo de Heidelberg, os pacientes são tratados pela primeira vez de forma conservadora durante alguns dias. Se não houver melhoria significativa dos sintomas ou prolongamento do trombo durante este período, um procedimento endovascular deve ser discutido com o paciente e realizado, se necessário. A trombectomia deve ser realizada no prazo de 14 dias após o início dos sintomas, se possível. Um novo dispositivo, o chamado ClotTriever, aparentemente também torna possível tratar eficazmente a trombose subaguda da veia pélvica. Está actualmente em curso um registo e resta saber quais serão os primeiros resultados (Fig. 2).
Terapia para a síndrome pós-trombótica (PTS)
Indicação e esclarecimento diagnóstico antes de uma intervenção endovascular: A indicação de uma intervenção endovascular depende dos sintomas do paciente. A partir da fase 3 do CEAP, há uma indicação para reabrir as veias ocluídas de acordo com as recomendações americanas. As veias seguintes podem ser tratadas com intervenções endovasculares: a veia femoral comum, a veia ilíaca, a veia cava inferior e superior e, em parte, a veia subclávia. Antes da intervenção, é feito primeiro um diagnóstico com um exame clínico, um teste de marcha, uma sonografia duplex a cores e, se necessário, outras imagens como uma flebotomia por RM ou TAC. A extensão da oclusão das veias, bem como a entrada e saída são aqui essenciais, uma vez que a taxa de abertura a longo prazo depende destes factores.
Terapia: A terapia básica para PTS consiste em terapia de compressão, medidas físicas e exercício. O movimento é essencial para o desenvolvimento de circuitos de bypass e, portanto, para a melhoria dos sintomas. Além disso, o tratamento óptimo da ferida é elementar no caso de uma úlcera de perna.
O tratamento invasivo da trombose venosa proximal ou oclusão venosa crónica foi introduzido internacionalmente há 30 anos; no nosso país, as intervenções endovasculares têm sido realizadas com sucesso nos principais centros há vários anos com altas taxas de abertura e levam a uma melhoria significativa dos sintomas do paciente e à cura de úlceras venosas.
Se a clínica for apropriada, uma possível intervenção venosa pode ser discutida com o paciente e as vantagens, bem como desvantagens ou riscos podem ser discutidos. Não importa a idade da obstrução em termos das hipóteses de sucesso do procedimento. A taxa aberta primária após 5 anos é de quase 70%. Nesta meta-análise, houve também uma melhoria significativa dos sintomas; até 82% dos pacientes tratados estavam livres de dor após 5 anos. Além disso, o procedimento levou à cura a longo prazo de uma úlcera de perna em até 80% [1].
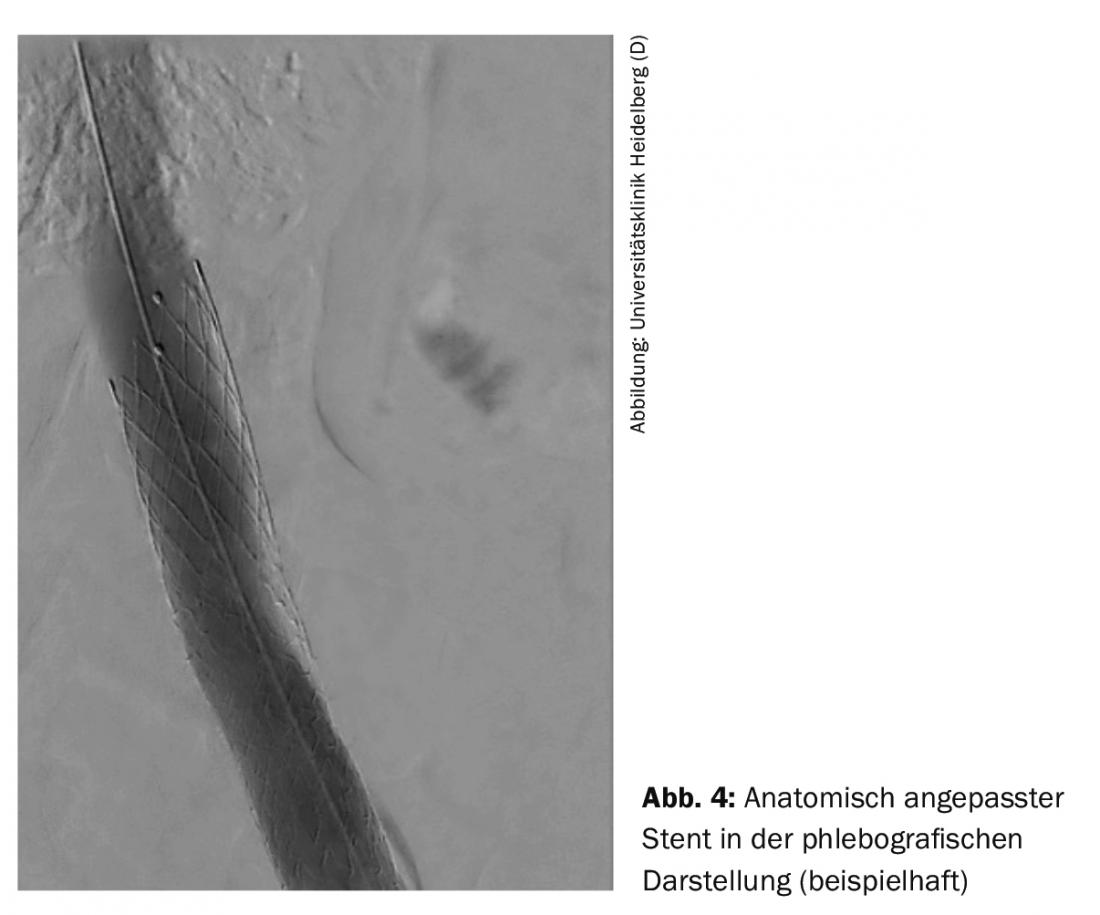
O procedimento endovascular é normalmente realizado através da veia poplítea. Outras vias de acesso são a veia femoral e a veia jugular. Dependendo do caso, o procedimento pode ser realizado sob analgosedação ou anestesia por intubação. Após a flebografia, uma passagem de arame ocorre através da oclusão. Posteriormente, devido à rigidez das oclusões venosas, são utilizados balões especiais de alta pressão com diâmetros de 14-16 mm na veia ilíaca e 20-24 mm na veia cava inferior para uma dilatação adequada. utilizado. Após dilatação, a parede da veia não é uma construção estável e colapsa rapidamente, razão pela qual as endopróteses especificamente concebidas para as veias são utilizadas para assegurar uma taxa aberta a longo prazo. A fim de alcançar uma colocação óptima do stent em intervenção unilateral na área da veia ilíaca proximal, estão disponíveis stents anatomicamente adaptados (Fig. 4).
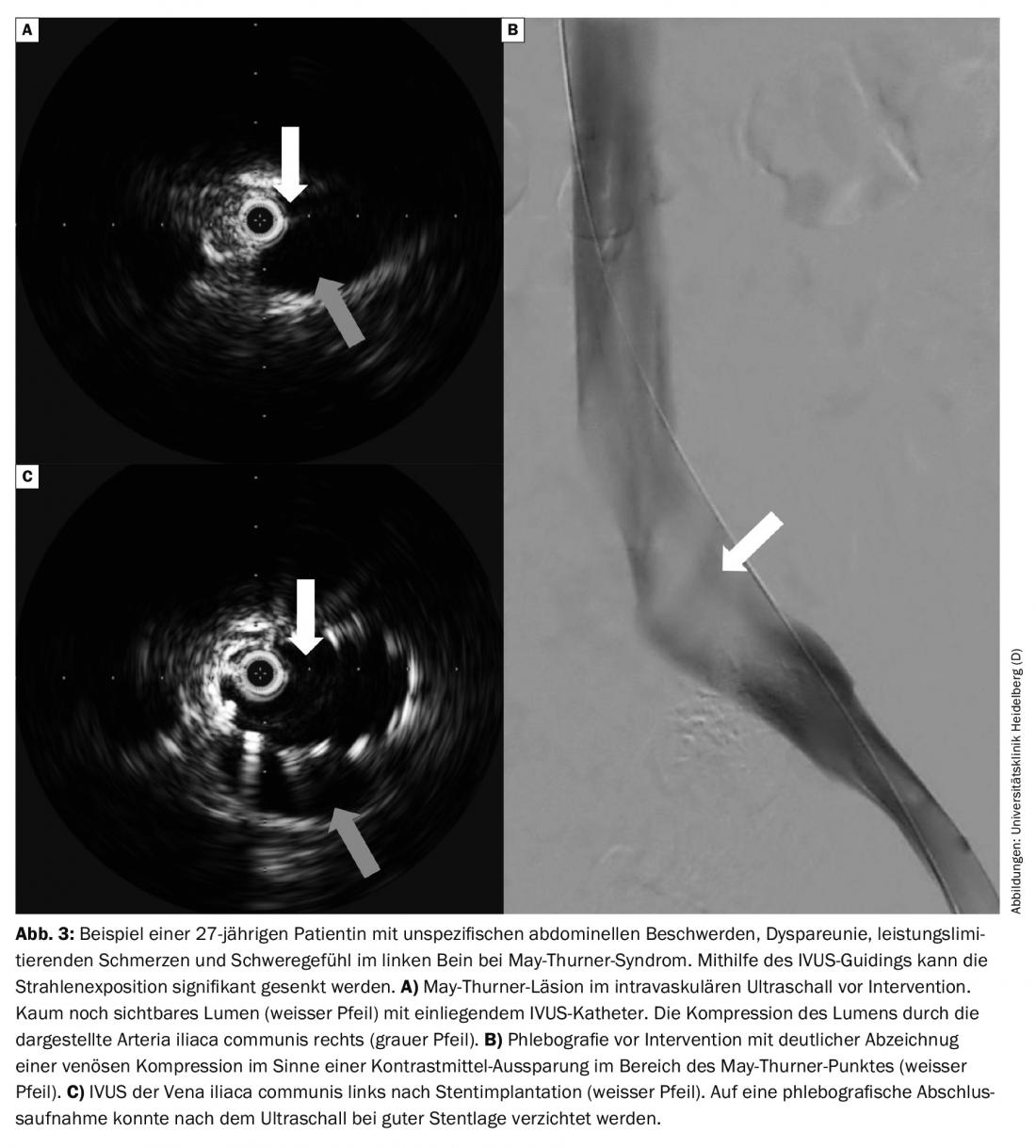
Outros colectivos de doentes: As etiologias complementares são a compressão da veia por artérias, as chamadas estenoses venosas não trombóticas (NIVL) ou lesões que ocupam espaço, tais como tumores. NIVL geralmente envolve compressão da veia ilíaca com. esquerda através da A. iliaca com. à direita, a chamada estenose de May-Thurner. Se forem acrescentadas queixas, então fala-se de uma síndrome de May-Thurner. Estas compressões NIVL podem ser realizadas eficazmente hoje em dia com uma taxa de abertura muito elevada de cerca de 90% após 5 anos, com um tempo de intervenção curto e um produto de baixa dose de área [1].
As limitações da sonografia duplex a cores, TAC e flebografia de RM na detecção de obstrução dinâmica ilíaca podem agora ser satisfeitas através da utilização de ultra-sons intravasculares (IVUS) em casos de suspeita de trombose da veia pélvica com sintomas típicos sem correlação de diagnóstico. (Fig. 3A). Desta forma, as doses de raios X podem ser salvas ou mesmo dispensadas no diagnóstico deste grupo de pacientes frequentemente mais jovens. Se a intervenção for necessária, IVUS pode ser uma ajuda na escolha do tamanho e comprimento do stent.
O tratamento invasivo da compressão venosa por um tumor pode levar a um alívio rápido dos sintomas, não só no ambiente paliativo. Após a colocação do stent e pós-dilatação, o stent atinge a sua forma óptima para manter a veia correspondente aberta com forças externas.
Acompanhamento: Recomenda-se visitas de acompanhamento após 1,3 e 12 meses. Nestes dias, é realizado um acompanhamento clínico e duplex sonográfico a cores. Uma nova flebografia ou CTA não é rotineiramente necessária.
O tratamento antitrombótico pós-intervencional depende da etiologia do risco de trombose e hemorragia do indivíduo. É feito individualmente. Na maioria dos casos, a anticoagulação terapêutica completa é necessária durante 6-12 meses. Posteriormente, o procedimento seguinte é discutido e realizado individualmente com o paciente. Além disso, a inibição das plaquetas pode ser aconselhável durante os primeiros 6 meses. As NIVL exigem um regime menos apertado após a intervenção do que as oclusões crónicas complexas. Recomenda-se a anticoagulação completa durante 3-6 meses. Depois disso, a anticoagulação é então interrompida.
Em resumo, a terapia endovascular das oclusões venosas é uma forma muito boa de ajudar eficazmente os pacientes com sintomas mais pronunciados a longo prazo.
Mensagens Take-Home
- A terapia NOAK pode ser administrada a doentes com tumores.
- Contudo, isto depende da entidade tumoral (não em tumores GI e urogenitais), da fase tumoral e da sua terapia.
- A anticoagulação com base em guias minimiza a taxa de tromboembolismo, mas não a probabilidade de síndrome pós-trombótica (PTS).
- Na trombose pélvica aguda, claramente sintomática, deve ser discutido um procedimento interventivo se os sintomas e a extensão do trombo não melhorarem sob terapia conservadora.
- Na síndrome pós-trombótica, a reabertura endovascular das veias ocluídas pode melhorar significativamente a qualidade de vida dos doentes sintomáticos. Além disso, esta é uma terapia eficaz para a cura a longo prazo de úlceras venosas.
- Em estenoses venosas não-trombóticas (por exemplo, estenoses de May-Thurner), a taxa de abertura após intervenção é de cerca de 90% após 5 anos.
Literatura:
- Razavi MK, Jaff MR, Miller LE: Safety and Effectiveness of Stent Placement for Iliofemoral Venous Outflow Obstruction: Systematic Review and Meta-Analysis. Circ Cardiovasc Interv 2015; 8: e002772.
- Kahn SR, Shrier I, Julian JA, et al: Determinantes e curso temporal da síndrome pós-trombótica após trombose venosa profunda aguda. Ann Intern Med 2008; 149: 698-707.
- Prandoni P, Lensing AW, Cogo A, et al: O curso clínico a longo prazo de trombose venosa profunda aguda. Ann Intern Med 1996; 125: 1-7.
- Johnson BF, Manzo RA, Bergelin RO, Strandness DE, Jr: Relação entre mudanças no sistema venoso profundo e o desenvolvimento da síndrome pós-trombótica após um episódio agudo de trombose venosa profunda dos membros inferiores: um seguimento de um a seis anos. J Vasc Surg 1995; 21: 307-312; discussão 13.
- Akesson H, Brudin L, Dahlstrom JA, et al: Função venosa avaliada durante um período de 5 anos após trombose venosa iliofemoral aguda tratada com anticoagulação. Eur J Vasc Surg 1990; 4: 43-48.
- Ashrani AA, Heit JA: Incidência e carga de custos da síndrome pós-trombótica. J Thromb Thrombolysis 2009; 28: 465-476.
- Guanella R, Ducruet T, Johri M, et al: Carga económica e determinantes de custo da trombose venosa profunda durante 2 anos após o diagnóstico: uma avaliação prospectiva. J Thromb Haemost 2011; 9: 2397-2405.
- Directriz S2: Diagnóstico e terapia da trombose venosa e embolia pulmonar. www.awmf.org/leitlinien/detail/ll/065-002.html. Situação actual: 10 de Outubro de 2015.
- Agnelli G, Buller HR, Cohen A, et al: Apixaban para o tratamento prolongado do tromboembolismo venoso. N Engl J Med 2013; 368: 699-708.
- Weitz JI, Lensing AWA, Prins MH, et al: Rivaroxaban ou Aspirina para o Tratamento Estendido do Tromboembolismo Venoso. N Engl J Med 2017; 376: 1211-1222.
- Comerota AJ, Kearon C, Gu CS, et al: Remoção do Trombo Endovascular para a Trombose Venosa Profunda Aguda Iliofemoral. Circulação 2019; 139: 1162-1173.
- Heckmann MB, Wangler S, Katus HA, Erbel C: Tratamento endovascular assistido por ultra-sons de tromboses venosas agudas. Vasa 2019; 48: 443-449.
- Kahn SR, Shapiro S, Wells PS, et al: meias de compressão para prevenir a síndrome pós-trombótica: um ensaio aleatório controlado por placebo. Lanceta 2014; 383: 880-888.
- Carrier M, Lazo-Langner A, Shivakumar S, et al: Screening for Occult Cancer in Unprovoked Venous Thromboembolism. N Engl J Med 2015; 373: 697-704.
- Robin P, Le Roux PY, Planquette B, et al: rastreio limitado com versus sem (18)F-fluorodeoxiglicose PET/CT para malignidade oculta em tromboembolismo venoso não provocado: um ensaio controlado aleatorizado de rótulo aberto. Lancet Oncol 2016; 17: 193-199.
- Khan F, Vaillancourt C, Carrier M.: Devemos fazer um rastreio exaustivo do cancro após uma trombose venosa não provocada? BMJ 2017; 356: j1081.
- Levitan N, Dowlati A, Remick SC, et al: Taxas de doença tromboembólica inicial e recorrente entre pacientes com malignidade versus aqueles sem malignidade. Análise de risco utilizando dados de reivindicações Medicare. Medicina (Baltimore) 1999; 78: 285-291.
- Gary T: Tromboembolismo venoso relacionado com o cancro – profilaxia e terapia. Vasa 2014; 43: 245-251.
- Akl EA, Rohilla S, Barba M, et al: Anticoagulação para o tratamento inicial do tromboembolismo venoso em doentes com cancro: uma revisão sistemática. Cancro 2008; 113: 1685-1694.
- Akl EA, Kahale L, Neumann I, et al: Anticoagulação para o tratamento inicial do tromboembolismo venoso em doentes com cancro. Cochrane Database Syst Rev 2014: CD006649.
- Akl EA, Kahale L, Barba M, et al: Anticoagulação para o tratamento a longo prazo do tromboembolismo venoso em doentes com cancro. Cochrane Database Syst Rev 2014: CD006650.
- Hull RD, Pineo GF, Brant RF, et al: Heparina de longo prazo de baixo peso molecular versus cuidados habituais em doentes com trombose da veia proximal com cancro. Am J Med 2006; 119: 1062-1072.
- Lee AYY, Kamphuisen PW, Meyer G, et al: Tinzaparin vs Warfarin para Tratamento de Tromboembolismo Venoso Agudo em Pacientes com Cancro Activo: Um Ensaio Clínico Aleatório. JAMA 2015; 314: 677-686.
- Raskob GE, van Es N, Verhamme P, et al: Edoxaban para o Tratamento do Tromboembolismo Venoso Associado ao Cancro. N Engl J Med 2018; 378: 615-624.
- Young AM, Marshall A, Thirlwall J, et al: Comparação de um Inibidor de Factor Oral Xa com Heparina de Baixo Peso Molecular em Pacientes com Cancro com Tromboembolismo Venoso: Resultados de um Ensaio Randomizado (SELECT-D). J Clin Oncol 2018; 36: 2017-2023.
- Agnelli G, Becattini C, Meyer G, et al: Apixaban para o Tratamento do Tromboembolismo Venoso Associado ao Cancro. N Engl J Med 2020; 382: 1599-1607.
- Galanaud JP, Sevestre MA, Genty C, et al: Incidência e preditores de recorrência de tromboembolismo venoso após uma primeira trombose venosa profunda distal isolada. J Thromb Haemost 2014; 12: 436-443.
- Baglin T, Douketis J, Tosetto A, et al: A apresentação clínica e a extensão da trombose venosa prevêem a probabilidade e o tipo de recidiva? Uma meta-análise ao nível do paciente. J Thromb Haemost 2010; 8: 2436-2442.
- Marik PE, Plante LA: doença tromboembólica venosa e gravidez. N Engl J Med 2008; 359: 2025-2033.
- Chan WS, Spencer FA, Ginsberg JS: Distribuição anatómica da trombose venosa profunda na gravidez. CMAJ 2010; 182: 657-660.
- Ginsberg JS, Brill-Edwards P, Burrows RF, et al: Trombose venosa durante a gravidez: perna e trimestre de apresentação. Thromb Haemost 1992; 67: 519-520.
- Morse M: Estabelecer uma gama normal para os níveis de D-dímeros através da gravidez para ajudar no diagnóstico de embolia pulmonar e trombose venosa profunda. J Thromb Haemost 2004; 2: 1202-1204.
- Chan WS, Lee A, Spencer FA, et al: D-dimer testing in pregnant patients: towards determining the next ‘level’ in the diagnosis of deep vein thrombosis. J Thromb Haemost 2010; 8: 1004-1011.
- Goodacre S, Horspool K, Nelson-Piercy C, et al: The DiPEP study: an observational study of the diagnostic accuracy of clinical assessment, D-dimer and chest x-ray for suspected pulmonary embolism in pregnancy and postpartum. BJOG 2019; 126: 383-392.
- Konstantinides SV, Meyer G, Becattini C, et al: 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J 2020; 41: 543-603.
- van der Pol LM, Tromeur C, Bistervels IM, et al: Algoritmo de anos de gravidez adaptados para o diagnóstico de suspeita de embolia pulmonar. N Engl J Med 2019; 380: 1139-1149.
- Tan M, Mol GC, van Rooden CJ, et al: A ressonância magnética directa de trombos diferencia a trombose venosa profunda ipsilateral aguda recorrente da trombose residual. Sangue 2014; 124: 623-627.
- Chan WS, Rey E, Kent NE, et al: Tromboembolismo venoso e terapia antitrombótica na gravidez. J Obstet Gynaecol Can 2014; 36: 527-553.
- Cohen H, Arachchchillage DR, Middeldorp S, et al: Gestão de anticoagulantes orais directos em mulheres com potencial de procriação: orientação do SSC do ISTH. J Thromb Haemost 2016; 14: 1673-1676.
- Bauersachs, et al.: Dtsch Med Wochenschr 2018; 143: 1-6 (13).
CARDIOVASC 2022; 21(1): 12-19