O vírus SRA-CoV-2 é um problema particular para os doentes hematológicos. perigo. Por um lado, o seu sistema imunitário é frequentemente enfraquecido pela doença, e por outro lado, numerosas terapias reduzem adicionalmente a resposta imunitária. O que fazer quando o cancro do sangue e a COVID-19 se encontram? E qual é a importância da vacinação?
Tendo em conta a pandemia, não só o cuidado dos doentes hematológicos está em risco, como surgiu outra ameaça para eles sob a forma de um vírus potencialmente mortal. Enquanto a mortalidade relacionada com a COVID-19 no sector hospitalar é de cerca de 12,1% para os doentes não oncológicos em geral, é de 20,5% para os doentes oncológicos – uma diferença estatisticamente significativa. Estes números são fornecidos pelo RegistoEuropeu LEOSS (Lean European Open Survey on SARS-CoV-2 infected patients). Mesmo após tratamento médico intensivo da infecção, segundo o registo, a mortalidade dos doentes afectados pelo cancro é mais elevada do que a dos doentes sem diagnóstico oncológico. As pessoas afectadas por uma doença hematológica estão adicionalmente em risco, como mostra um estudo publicado na revista científica Nature em Agosto de 2020 [1]. Isto provou o que muitos já suspeitavam na altura: A mortalidade de doentes hematológicos na COVID-19 é particularmente elevada. É superior ao de todos os outros doentes oncológicos e comparável ao dos doentes imunossuprimidos. No primeiro ano de terapia, o risco de morrer do vírus SRA-CoV-2 é mesmo aumentado por um factor de 2 em comparação com a população em geral. No que diz respeito à doença subjacente, os linfomas em particular parecem ser um mau pré-requisito para o curso da infecção pelo SRA-CoV-2 [2]. Estas descobertas dos últimos dois anos dão razão para uma abordagem diferenciada da doença COVID-19 em doentes hematológicos e sublinham a importância da melhor profilaxia possível nesta população – um desafio dada a situação dinâmica e o jovem panorama de estudo.
Que pacientes estão particularmente em risco?
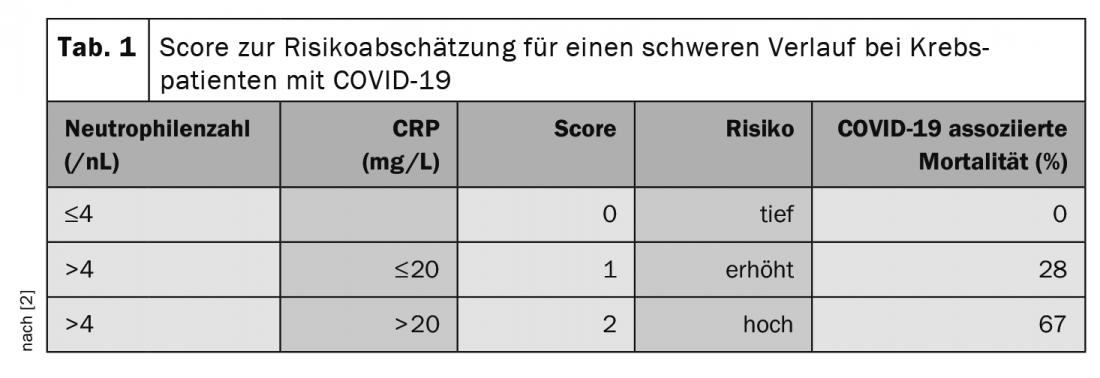
Na reunião anual das Sociedades Alemã, Austríaca e Suíça de Hematologia e Oncologia Médica em Outubro, o Prof. Clemens Wendtner, MD, Médico Chefe da Clínica Munique Schwabing e Secretário Científico do Grupo de Estudo CLL Alemão (DCLLSG), salientou a importância do tratamento do risco associado à COVID-19. Em particular, os doentes submetidos a terapia com anticorpos anti-CD20 como o Rituximab e o tratamento com esteróides estão em risco, sendo que já >10 mg/d equivalente de prednisona para >5 dias deve ser considerado crítico. Os inibidores Checkpoint também estão associados ao aumento da letalidade [2]. Um estudo também procurou factores para prever a progressão grave da COVID-19 em doentes com tumores [2]. Aqui, a contagem de neutrófilos (>4,4/nL) e o valor de CRP (>20 mg/L) antes da infecção parecem ser de valor prognóstico. Os autores desenvolveram uma partitura a partir desta descoberta (Tab. 1).
Gestão da SRA-CoV-2 em doentes hematológicos: Dançar com o diabo
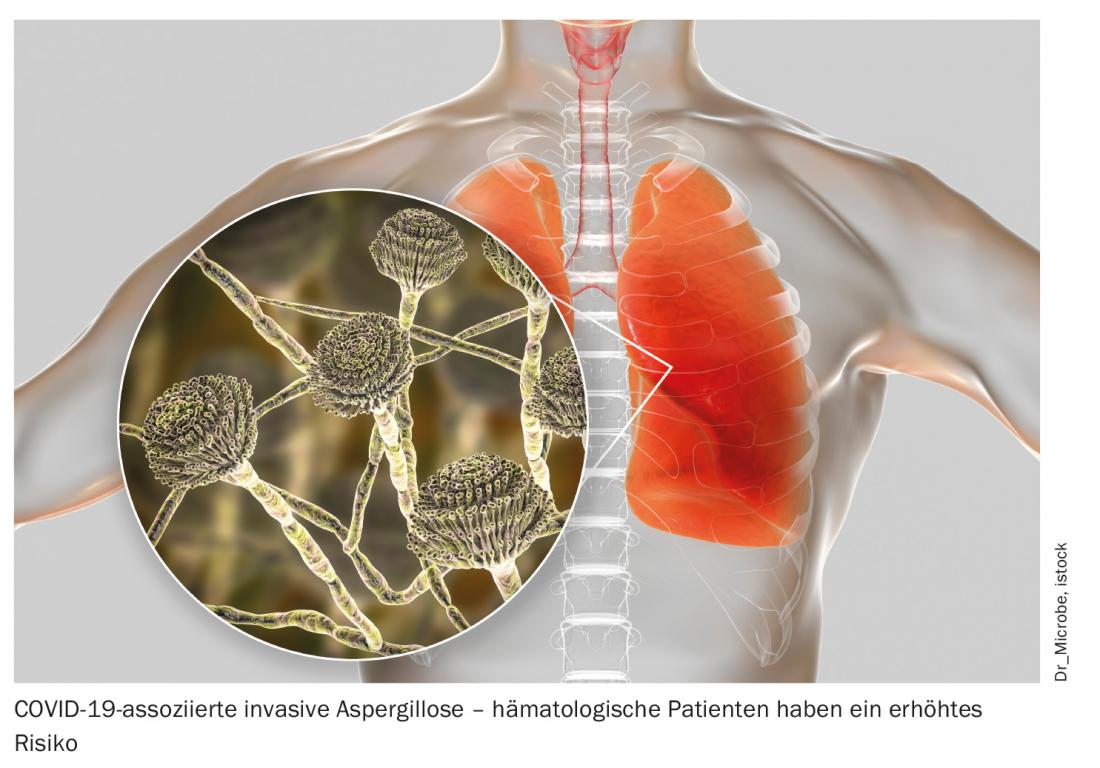
Para além do aumento da susceptibilidade a cursos COVID-19 severos e fatais, o prolongamento da descamação viral até 70 dias após o diagnóstico é também encontrado nas pessoas afectadas por malignidades hematológicas. Isto representa um risco potencial de infecção dos contactos – mesmo que o doente seja assintomático – e não deve ser negligenciado no tratamento de tais doentes [3]. Para além da estrita adesão a medidas de higiene em benefício de todos os envolvidos, o tratamento precoce reveste-se de particular importância. Ao mesmo tempo, a melhor abordagem terapêutica ainda não é clara. Segundo os peritos do congresso, a optimização das medidas de apoio, em particular, está indubitavelmente em primeiro plano. Isto inclui a anticoagulação profiláctica em pacientes hospitalizados, mas também uma boa profilaxia antibiótica, antiviral e antifúngica e terapia de infecções secundárias. Por exemplo, uma protecção consistente contra drogas leva a uma incidência significativamente mais baixa de aspergilose pulmonar associada à COVID-19 [4]. As imunoglobulinas intravenosas (IVIG) podem e devem também ser utilizadas em casos de deficiência comprovada de imunoglobulinas secundárias. Se qualquer imunossupressão deve ser interrompida face à doença COVID-19 não está actualmente esclarecida e deve ser decidida numa base individual. Em geral, o tratamento deste grupo de doentes particularmente vulnerável deve ser individualizado e orientado de perto para a imunossupressão e o título de anticorpos.
No que diz respeito à terapia específica COVID-19, como em pacientes não hematológicos, são utilizados em particular o Remdesivir antiviral, Dexametasona e Tocilizumab. Cada vez mais, o tratamento usando a terapia passiva de anticorpos está também a tornar-se cada vez mais importante. Isto desempenha um papel crescente especialmente em doentes seronegativos – e os doentes imunossuprimidos e os afectados por malignidades hematológicas pertencem frequentemente a este grupo. Entretanto, existem alguns estudos sobre a combinação dos ingredientes activos casirivimab e imdevimab, também conhecidos como REGEN-COV. Alternativamente, o plasma convalescente pode ser utilizado, embora não existam actualmente estudos positivos sobre doentes imunossuprimidos. Em qualquer caso, o tratamento precoce dentro de 3-5 dias após o início dos sintomas é muito promissor. A utilização em doentes de alto risco como parte de uma profilaxia pós-exposição – por exemplo após um surto nosocomial – é concebível e está actualmente a ser investigada. Num estudo correspondente, este procedimento mostrou uma redução de risco de 83% quando utilizado numa fase inicial, e está em curso um procedimento de aprovação com a US Food and Drug Administration [5]. Especialmente em doentes de alto risco, como os que se encontram em terapia de esgotamento de células B, o uso de tratamento de anticorpos ainda pode ser considerado mais tarde no decurso da doença se houver suspeita de que a produção própria do doente é insuficiente. Isto é recomendado pelo STAKOB (Standing Working Group of Competence and Treatment Centres for Diseases Caused by Highly Pathogenic Pathogens) alemão, especialmente se a carga viral for elevada. Além disso, de acordo com o STAKOB, devem ser tomados anticorpos anti-spike e o resultado não tem de ser esperado. Com a terapia de anticorpos, o risco de reacções alérgicas não deve ser negligenciado; é necessário um acompanhamento clínico rigoroso com um período de seguimento de pelo menos uma hora.
No que diz respeito à eficácia do REGEN-COV, certas lacunas são evidentes tanto na África do Sul como nas variantes brasileiras e escocesas. O mais recente sotrovimab (VIR-7831), por outro lado, parece ser totalmente eficaz também aqui. Com o aparecimento contínuo de outras variantes, é provável que haja alguns desafios para os médicos e para a indústria farmacêutica. É importante manter um acompanhamento atento em todas as fases da pandemia e mantermo-nos actualizados a nível individual. Esta é a única forma de assegurar o melhor cuidado possível.
Vacinar, vacinar, vacinar
Também no contexto da vacinação, o aparecimento de novas variantes está sempre em destaque – com preocupações sobre a eficácia da imunização activa que não podem ser descartadas de forma descontrolada. Isto varia entre as diferentes variantes de vírus. E também aqui, as pessoas afectadas por doenças hematológicas são um caso especial. Por exemplo, uma análise de 88 pacientes após transplante de células estaminais hematopoiéticas que tinham recebido a vacinação contra o mRNA mostrou que 41% não desenvolveram protecção vacinal suficiente [6]. A resposta à vacinação foi particularmente fraca se a imunossupressão tivesse sido realizada nos últimos três meses, se o transplante tivesse ocorrido menos de um ano antes e a contagem de linfócitos fosse <1 G/L – todos os factores já conhecidos de outras vacinações.
Mas mesmo com uma resposta de vacinação comprovadamente mais fraca, os peritos na conferência anual concordaram: a vacinação continua a ser a medida de prevenção mais importante – e a baixa taxa de vacinação o maior problema. Porque mesmo que a protecção vacinal seja inferior em doentes imunodeprimidos, a vacinação não faz mal nenhum. Isto também é recomendado antes, durante ou após a terapia hemato-oncológica – independentemente do tipo de tratamento. Uma vez que a protecção não é apenas de células B, mas também de células T mediadas, mesmo o esgotamento das células B e a terapia de alta dose com transplante de células estaminais hematopoiéticas não são contra-indicações absolutas de acordo com as directrizes actualmente válidas da Onkopedia [7]. No entanto, a resposta à vacinação é maior com o aumento do intervalo de tempo do transplante de células estaminais hematopoiéticas. Por conseguinte, tendo em conta a situação infecciosa, pode justificar-se uma abordagem de espera e observação.
A terceira dose de vacina é actualmente alvo de grande esperança, o que deverá aumentar a resposta e a duração da resposta de vacinação. Para pacientes de transplante de órgãos, já foi demonstrado que isto tem um efeito duradouro na resposta imunitária [8]. O risco de cursos graves na população em geral também pode ser significativamente reduzido pela terceira dose, de acordo com dados israelitas [9]. De acordo com os dados, isto é aumentado por um factor de 19,5 em pessoas com mais de 60 anos sem vacinação de reforço. O Prof. Wendtner suspeita que este efeito também será perceptível em doentes com malignidades hematológicas. Num estudo com pacientes após transplante alogénico de células estaminais, a terceira vacinação mostrou uma melhoria significativa da resposta vacinal. No entanto, 22% dos participantes no estudo não obtiveram uma resposta de vacinação suficiente [10]. De acordo com o Prof. Wendtner, dependendo da situação, já é possível uma vacinação de reforço após 3-4 meses, uma administração simultânea com a vacinação contra a gripe não é problemática e é uma opção. A terceira vacinação deve em qualquer caso ser realizada com um agente baseado em mRNA, mesmo que tenha sido utilizada previamente uma vacina vectorial. O perito também aconselha a monitorização de baixo limiar de resposta de vacinação em doentes hematológicos e oncológicos para dar garantias aos doentes e profissionais de saúde.
Fonte: Palestras “COVID 19 em doenças hematológicas” de Clemens-Martin Wendtner e “COVID-19 em receptores de células estaminais alogénicas” de Eduard Schulz no simpósio científico “COVID 19 – Parte 1”. Reunião Anual das Sociedades Alemã, Austríaca e Suíça de Hematologia e Oncologia Médica, 02.10.2021, Berlim (D).
Literatura:
- Williamson EJ, et al: Factores associados à morte relacionada com a COVID-19 usando OpenSAFELY. Natureza 2020; 584(7821): 430-436.
- Kiani A, et al: Os parâmetros do laboratório de pré-infecção podem prever a gravidade da COVID-19 em pacientes com tumores. Cancer Med 2021; 10(13): 4424-4436.
- Avanzato VA, et al.: Estudo de caso: Descarga prolongada de SRA-CoV-2 a partir de um indivíduo imunocomprometido com cancro. Célula 2020; 183(7): 1901-1912.e9.
- Hatzl S, et al: Antifungal prophylaxis for prevention of COVID-19-associated pulmonary aspergillosis in critically ill patients: an observational study. Critérios Cuidados 2021; 25(1): 335.
- O’Brien MP, et al: Subcutaneous REGEN-COV Antibody Combination to Prevent Covid-19. N Engl J Med 2021; 385(13): 1184-1195.
- Redjoul R, et al: Resposta de anticorpos após a segunda dose de BNT162b2 em receptores alogénicos de HSCT. Lancet 2021; 398(10297): 298-299.
- Lilienfeld-Toal M, et al: Coronavirus infection (COVID-19) in patients with blood disorders and cancer – Onkopedia guideeline. Situação Abril 2021. www.onkopedia.com/de/onkopedia/guidelines/coronavirus-infektion-covid-19-bei-patient-innen-mit-blut-und-krebserkrankungen/@@guideline/html/index.html.
- Kamar N, et al: Três doses de uma vacina contra o mRNA Covid-19 em receptores de transplante de órgãos sólidos. N Engl J Med 2021. 385: 661-662.
- Bar-On YM, et al: Protection of BNT162b2 Vaccine Booster against Covid-19 in Israel. N Engl J Med 2021; 385(15): 1393-1400.
- Redjoul R, et al: Resposta de anticorpos após a terceira dose de BNT162b2 em receptores de HSCT alogénico. Lancet Haematol 2021; 8(10): e681-e683.
InFo ONCOLOGY & HEMATOLOGY 2021; 9(6): 23-24 (publicado 8.12.21, antes da impressão).