O papel da imagiologia no diagnóstico da DP reside actualmente principalmente na exclusão das causas do Parkinson secundário. Contudo, em ligação com a clínica, pode também fornecer argumentos para a presença da doença de Parkinson ou de síndromes atípicas de Parkinson. Os desenvolvimentos mais recentes visam o diagnóstico correcto de pacientes individuais por meio de imagens num contexto clínico.
A doença de Parkinson é a doença neurodegenerativa do movimento mais comum e a doença neurodegenerativa mais comum após a doença de Alzheimer [1]. Foi-lhe dado o nome do médico inglês James Parkinson, que publicou a primeira descrição detalhada do quadro clínico em 1817 [2].
O diagnóstico da doença de Parkinson é feito clinicamente, embora só possa ser confirmado definitivamente de forma histopatológica. Normalmente, é necessária uma combinação de sintomas motores (rigor, tremor, bradicinesia) com o aparecimento de sintomas assimétricos, uma resposta à L-dopa, um curso progressivo de mais de dez anos e a exclusão de outras causas de parkinson [3, 4]. Nas fases iniciais, contudo, nem todos os sintomas estão frequentemente presentes; além disso, outras entidades podem causar sobreposição de sintomas; estudos post-mortem mostraram que uma proporção relativamente elevada de diagnósticos incorrectos de DP é feita (76% de confirmação na autópsia [5]).
Os métodos de imagem (tanto morfológicos como funcionais) não podem ajudar no diagnóstico da DP, fornecendo sinais específicos da doença, mas podem identificar ou apoiar o diagnóstico de outras causas de DP. Com a ajuda de métodos mais recentes, estão também a ser feitas tentativas para diagnosticar a própria doença de Parkinson para doentes individuais.
Imagem de corte transversal
A correlação patológico-anatómica da doença de Parkinson é a perda de células dopaminérgicas na substantia nigra pars compacta (Fig. 1), que, no entanto, só raramente se reflecte num estreitamento do mesmo na ressonância magnética. Na maioria dos casos, existe apenas uma atrofia não específica com expansão dos espaços do QCA interno e externo. Actualmente, o verdadeiro valor da imagem reside na possibilidade de excluir outras causas, possivelmente tratáveis, da sintomatologia.
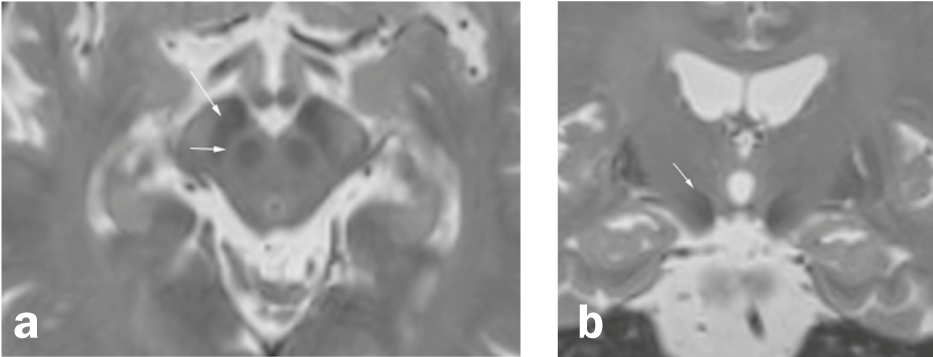
Fig. 1 Substanciala nigra e arredores
Axial (a) e coronária (b) Reconstrução de uma sequência ponderada em T2 3D de alta resolução (MRI). a) A substantia nigra localizada entre a borra de núcleo e os feixes de fibras do cerebri da crista consiste em duas camadas, uma zona hipointensa na parte posterior do cerebri da crista (pars reticularis; seta longa) e uma camada relativamente hiperintensa (seta curta) entre os pars reticularis e a borra de núcleo (em que as zonas na ponderação T2 não correspondem exactamente à localização anatómica). b) O núcleo subthalâmico (seta) é um núcleo medial à cápsula interna e superolateral ao ncl. Ruber e uma das áreas-alvo para a estimulação cerebral profunda na doença de Parkinson.
Exclusão de outras causas de parkinson: Os diagnósticos diferenciais de DP incluem Parkinson secundário de aetiologia tóxica, metabólica ou vascular e pseudoparkinsonismo, por exemplo devido a hidrocefalia de pressão normal [6] ou hematoma subdural crónico, alguns dos quais são facilmente detectados por TC e/ou MRI (Fig. 2).
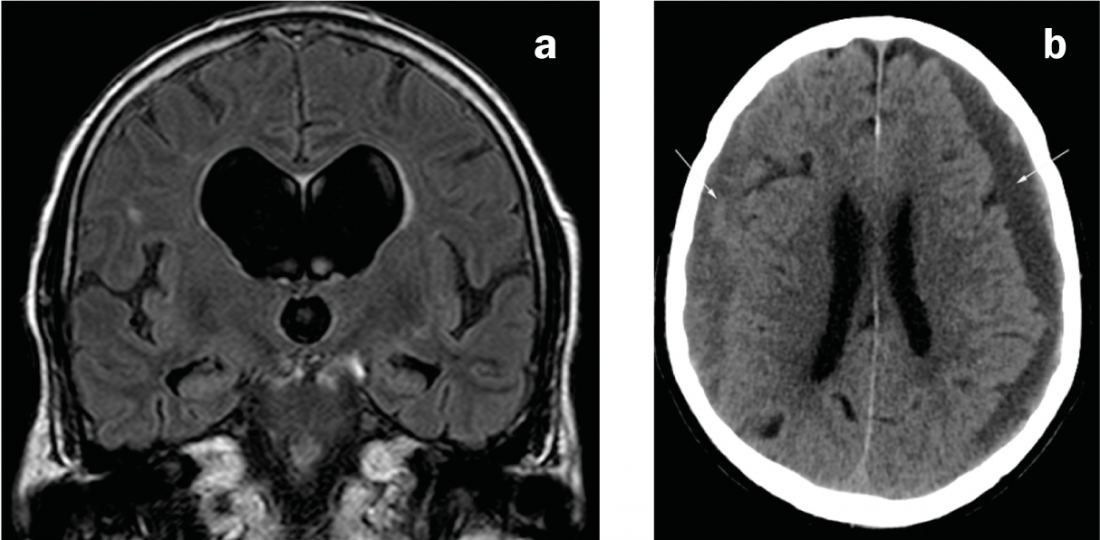
Fig. 2: Causas do parkinsonismo secundário
a) Ressonância magnética coronária na ponderação FLAIR. Sistema ventricular desproporcionalmente dilatado em comparação com os espaços externos do LCR em hidrocefalia de pressão normal. b) CT axial. Hematoma subdural bilateral de idade mista: esquerda predominantemente hipodensa (i.e. crónica), direita predominantemente isodensa (i.e. subaguda).
Exclusão da síndrome de Parkinson atípica: Os diagnósticos diferenciais clínica e radiologicamente mais difíceis incluem as síndromes atípicas de Parkinson MSA (atrofia multissistémica), PSP (paralisia progressiva do olhar supranuclear) e CBD (degeneração ganglionar corticobasal). As manifestações de imagem só podem muitas vezes ser detectadas em fases avançadas.
Os sinais de MSA-C (tipo cerebelar) são a atrofia das pons e do cerebelo (incluindo brachium pontis) e o sinal “hot cross bun” (hiperintensidade em forma de cruz nas pons em imagens axiais ponderadas em T2/FLAIR devido à degeneração dos neurónios pontine e das ligações pontocerebelar). (Fig. 3a e b). O sinal típico de MSA-P (tipo putaminal/Parkinsonian, um diagnóstico diferencial da doença de Parkinson devido a sintomas extrapiramidais) é a hipointensidade do putamen dorsolateral em sequências T2-/T2* com banda hiperintensa adjacente (“putaminal slit sign” devido a perda de volume putaminal). (Fig. 3c). Os resultados descritos podem ser encontrados em todos os subtipos de MSA, embora os resultados infratentoriais sejam mais comuns em MSA-C do que em MSA-P (e os resultados putaminais, por sua vez, são descritos mais frequentemente em MSA-P) [7].
Na PSP, há atrofia do mesencéfalo (incluindo o colículo superior) e do pedúnculo cerebelar superior, o que leva ao sinal de “pinguim” em imagens sagitais (diz-se que o mesencéfalo plano e a redondeza preservada dos pons levam a uma semelhança com a silhueta de um pinguim com uma cabeça pequena e barriga redonda). (Fig. 3d e e). O cinzento periaqueductal pode aparecer T2 hiperintenso.
As descobertas da CDB são um estreitamento do giro pré e pós central (Fig. 3f), gliose subcortical com hiperintensidade T2/FLAIR e atrofia parasagital proeminente. Atrofia dos gânglios basais pode ser discreta.
Como todos estes sinais podem ser muito subtis e há uma certa sobreposição nos resultados de todos os quadros clínicos mencionados, várias medidas (por exemplo, diâmetro e área do mesencéfalo e pons ou pedúnculo cerebelaris superior e médio) e índices foram utilizados numa tentativa de definir sinais objectivos para o diagnóstico diferencial das várias entidades e assim fazer diagnósticos específicos para além das diferenças a nível de grupo. Por exemplo, o “MR-parkinsonian-index” [8] permite distinguir um possível ou provável PSP de M. Parkinson, MSA e controlos normais.
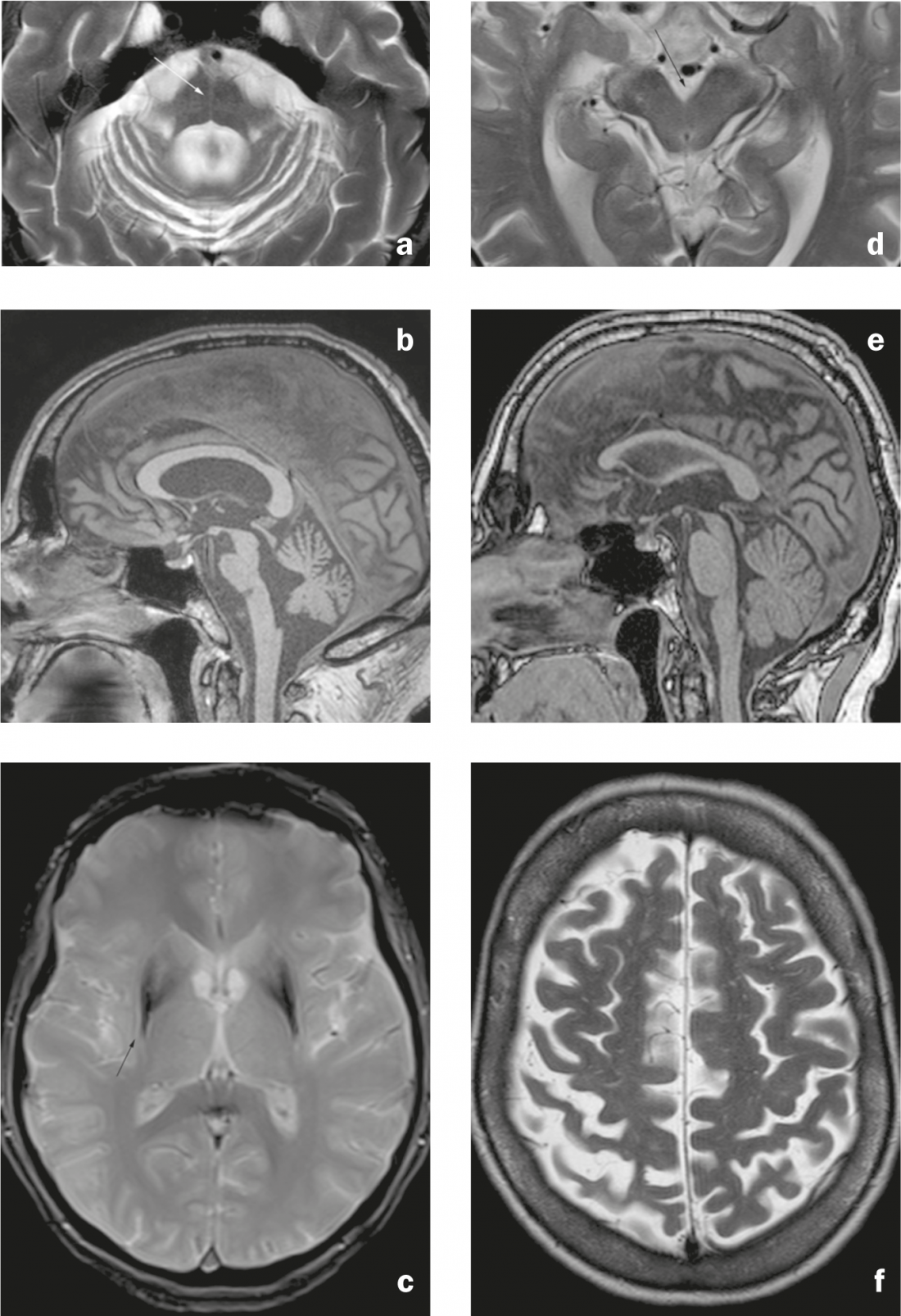
Fig. 3: Sindromes atípicas de Parkinson. MSA-C: a) Imagem axial ponderada em T2. Atrofia pontiaguda e cerebelar com sinal de “pão cruzado quente” (seta), dilatação do quarto ventrículo e estreitamento do pontiagudo braquial. b) Imagem sagital na ponderação T1. Aplanamento dos pons. MSA-P: c) Imagem axial T2* ponderada. Hypointensity of the dorsolateral putamen with adjacent linear hyperintensity (seta). PSP: d) Imagem axial ponderada em T2. Atrofia do mesencéfalo com dilatação da cisterna interpeduncular. e) Sagittal imagem ponderada em T1. Atrofia do mesencéfalo, que parece estreita em comparação com os pons (“pinguim” ou sinal de “beija-flor”). CDB: f) Imagem axial ponderada em T2. Atrofia do giro pré-central e pós-central com alargamento do sulco central (ênfase direita).
Novos desenvolvimentos em imagiologia por RM: Para além da imagiologia convencional, também estão a ser investigadas técnicas avançadas de RM, tais como imagem ponderada por difusão (DWI), imagem tensor de difusão (DTI) ou sequências ponderadas por susceptibilidade, tais como T2* ou imagem ponderada por susceptibilidade (SWI), no que diz respeito à diferenciação de pacientes com DP e pacientes com síndromes atípicas [9, 10]. Novas sequências ou novas variantes de sequências existentes serão utilizadas para detectar alterações subtis nas muito pequenas estruturas anatómicas afectadas na doença de Parkinson em fases iniciais. Por exemplo, utilizando a técnica PADRE (“phase difference enhanced imaging”; realizada numa RM 3T), foi demonstrado nos doentes de Parkinson [11], que não é detectável em sequências de RM convencionais.
Além disso, técnicas avançadas de análise estrutural da matéria cinzenta (“morfometria baseada em voxel”, VBM) e branca (“estatísticas espaciais baseadas no tracto”, TBSS) [12, 13] são utilizadas para detectar pequenas diferenças de sinal na RM que não são aparentes pela análise puramente visual.
Imagens pré-operatórias: Para além de excluir causas de parkinson que não a doença de Parkinson, as imagens transversais são úteis para a focalização pré-operatória (globus pallidus e especialmente o nervo subthalâmico) antes da implantação de eléctrodos para estimulação cerebral profunda.
Métodos de medicina nuclear
Os métodos da medicina nuclear permitem a detecção de uma perturbação do sistema dopaminérgico e são utilizados na rotina clínica como um teste diagnóstico adicional em casos pouco claros. Por exemplo, a disponibilidade de transportadores de dopamina pré-sinápticos (DaT) ou a actividade da dopa descaroboxilase pode ser investigada utilizando diferentes ligandos em SPECT ou PET. Em particular, o “DaT scan” (o [123I]FP-CIT-SPECT) tornou-se generalizado como um teste para as síndromes pouco claras de Parkinson. A doença de Parkinson mostra uma redução na ligação ligante(Fig. 4), o que torna possível distingui-la do tremor essencial (mas não com certeza das síndromes atípicas de Parkinson) [14].
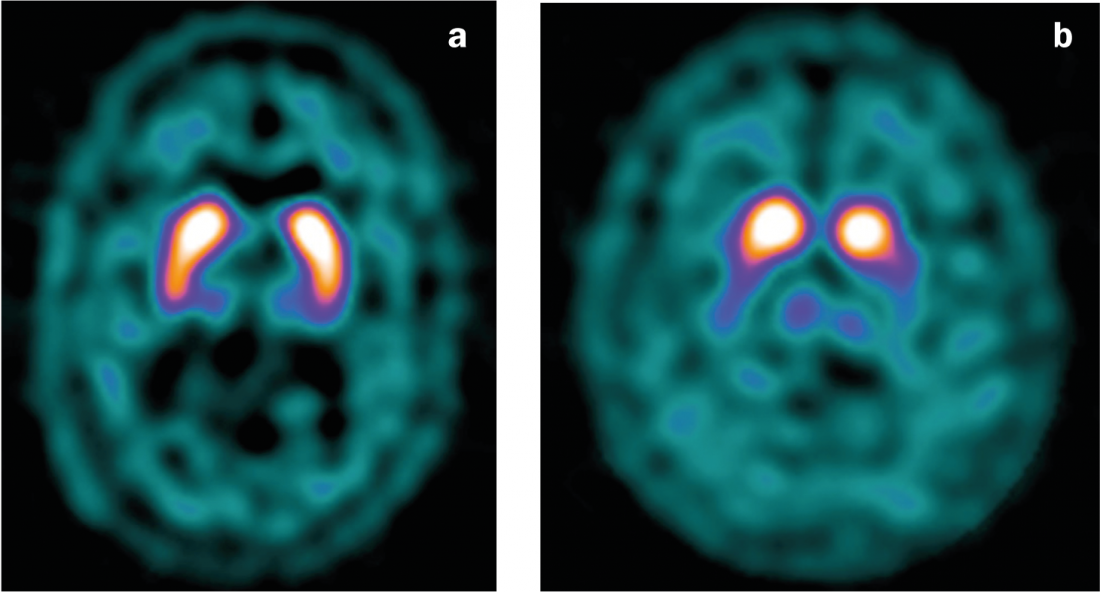
Fig. 4: DaT scan
a) Conclusões normais com ligação simétrica do ligando no estriado.
b) Redução da ligação ligante na doença de Parkinson, especialmente no lado esquerdo (com uma clínica predominantemente do lado direito).
Métodos de classificação
Para além das análises morfológicas acima descritas, as análises de classificação estão cada vez mais a ser realizadas para melhorar o diagnóstico em pacientes individuais. Estes não se baseiam, tal como os estudos de grupo, na ideia de comparar grupos de doentes com sujeitos de controlo saudáveis a fim de detectar alterações estruturais relacionadas com a doença [15], cujas diferenças podem ser significativas a nível do grupo mas não suficientemente pronunciadas a nível individual para permitir um diagnóstico na prática clínica diária. Pelo contrário, perseguem o objectivo de identificar ou classificar correctamente os pacientes individuais. Os estudos de classificação são realizados utilizando análises “máquina vectorial de suporte” de vários dados (por exemplo, sequências DTI ou SWI). Um classificador “máquina vectorial de suporte” é um método de análise que visa classificar os dados em dois ou mais grupos (por exemplo, a doença de Parkinson/o Parkinson atípico) com base no reconhecimento de padrões. Para este fim, numa primeira fase, as imagens processadas (ou seja, transferidas para um espaço padrão, por exemplo) são examinadas para as características mais discriminatórias utilizando vários algoritmos. Numa segunda fase, o classificador determinado é testado quanto à sensibilidade, especificidade e exactidão, utilizando um novo conjunto de dados [16]. Os resultados preliminares da análise dos dados do DTI e SWI mostraram uma elevada precisão na classificação dos pacientes com DP (vs. pacientes com sintomas atípicos de DP [12, 13]).
Bibliografia da editora
Sven Haller, MD
Isabelle Barnaure, MD











