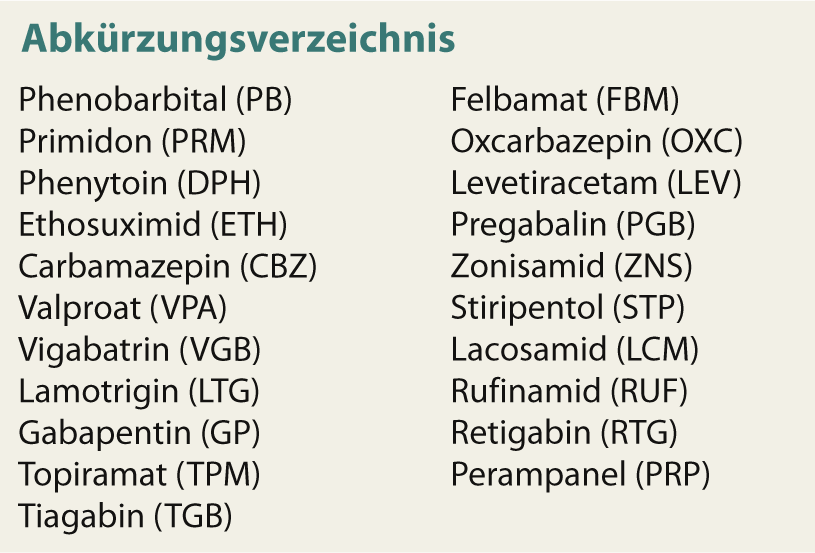
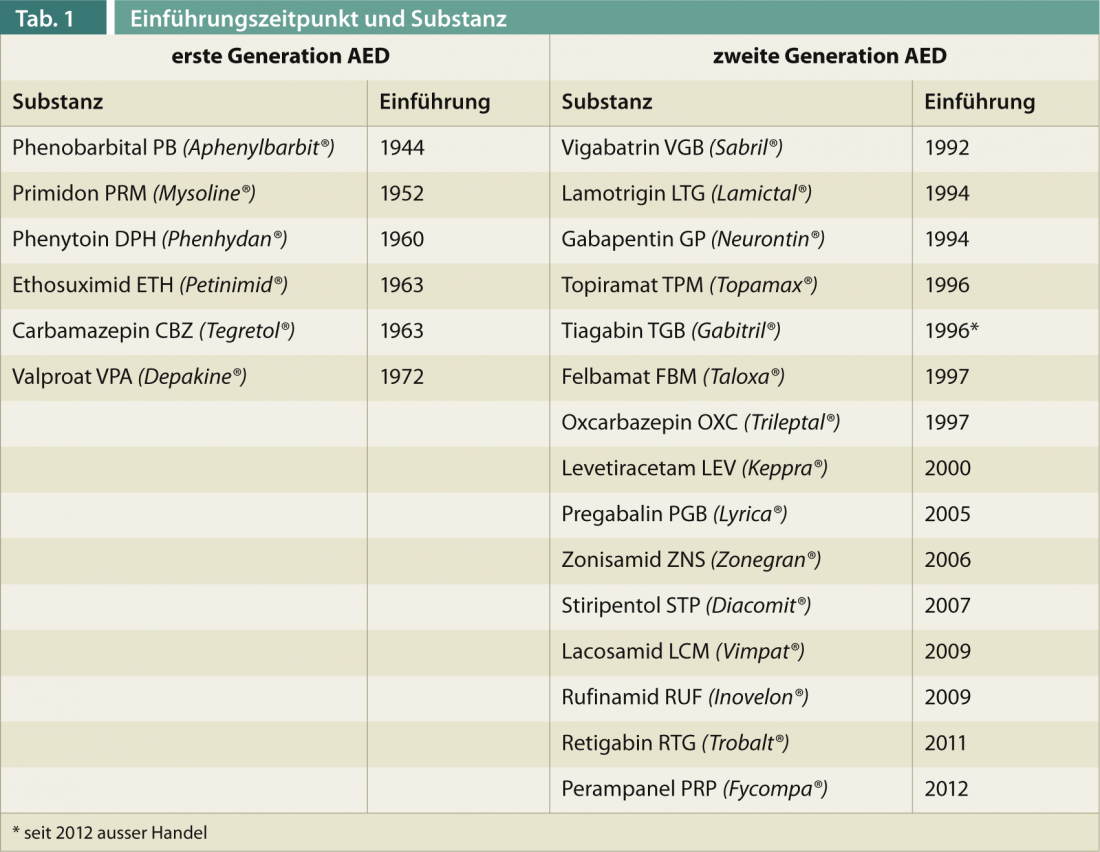
Os medicamentos antiepilépticos de primeira geração (DEA) (Tab. 1) – valproato foi licenciado pela última vez na Suíça em 1972 – caracterizam-se por uma farmacocinética complexa. Em particular, a indução e inibição de enzimas hepáticas, especialmente do tipo citocromo P, resulta em interacções medicamentosas potencialmente relevantes com o risco de perda de eficácia e overdoses indesejáveis no caso de alterações de medicamentos. Além disso, o espectro dos efeitos secundários, especialmente em termos de efeitos crónicos (osteoporose, polineuropatia, atrofia cerebelar, etc.), é por vezes grave. Os DEA de segunda geração têm sido utilizados na farmacoterapia da epilepsia desde os anos 90. Diferem dos acima mencionados principalmente por terem menos efeitos secundários e melhor farmacocinética, mas não por uma eficácia significativamente melhor. Ao contrário das esperanças iniciais, eles, tal como os antigos DEA, não têm efeito antiepiléptico, ou seja, não têm efeito comprovado na epilepsia como doença e continuam a agir apenas de forma sintomática para prevenir convulsões.
Os medicamentos aprovados nos últimos cinco a dez anos caracterizam-se em particular pelo seu efeito específico em síndromes especiais de epilepsia no sentido de medicamentos órfãos (RUF e FBM actuam sobre a síndrome de Lennox-Gastaut, STP sobre a síndrome de Dravet). Na opinião dos autores, contudo, não devem ser classificados como medicamentos de terceira geração porque, de acordo com os resultados obtidos até à data, não diferem significativamente dos medicamentos de segunda geração, quer em termos do seu espectro de acção, efeitos secundários ou interacção. A sua utilização em epilepsia resistente à terapia, após a falha de outros medicamentos complementares, pode ser útil, como em alguns casos estão presentes outros mecanismos de acção.
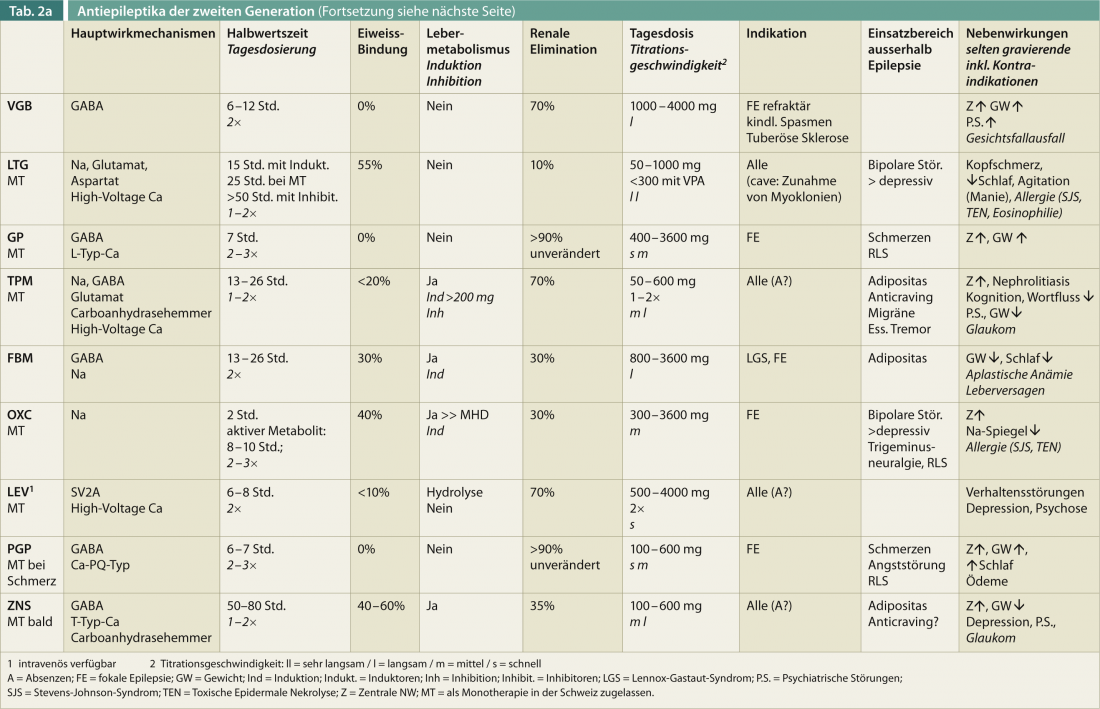
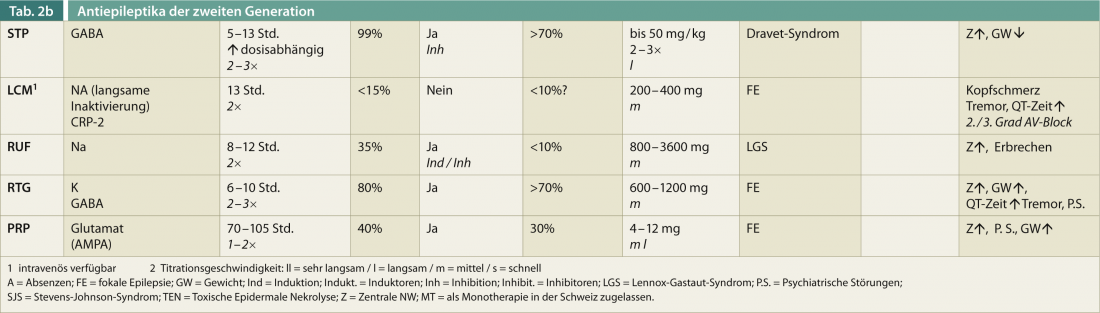
Uma visão geral das características relevantes para a terapia dos DEA de segunda geração (sem pretender estar completo) deverá ajudar a orientar-se rapidamente (Tab. 2). Idade, sexo, comedicação e efeito positivo sobre outras doenças são factores essenciais para a escolha óptima de um medicamento antiepiléptico.
No artigo seguinte, as benzodiazepinas que atacam o receptor GABA-A, tais como clonazepam (Rivotril®), clobazam (Urbanyl®), lorazepam (Temesta®) e midazolam (off-label na Suíça, por exemplo, como spray nasal) não são discutidas. Para além da sedação – especialmente no início – mostram mais frequentemente o desenvolvimento da tolerância, por vezes também a perda do efeito. São principalmente indicados como medicamentos de emergência e para episódios de convulsões previsíveis (infecção, menstruação, etc.), bem como na troca ou introdução de DEA.
Antigos e novos mecanismos de acção de medicamentos anticonvulsivos
Os mecanismos de acção típicos conhecidos dos medicamentos antiepilépticos são o bloqueio dos canais rápidos de sódio dependentes da tensão e de vários canais de cálcio, o reforço do efeito inibidor GABA através da inibição da degradação e da recaptação ou por um ataque directo aos receptores gaba, e a redução da acção sináptica do glutamato. O efeito dos DEA de segunda geração baseia-se em parte nos mesmos alvos farmacodinâmicos, mas também existem diferenças. Assim, o PRP reduz a libertação do glutamato neurotransmissor activador; em contraste com medicamentos mais antigos, um novo local de acção com farmacodinâmica não competitiva nos receptores é aqui descrito. LCM modula os canais celulares de Na, mas um subtipo específico que mostra tempos de abertura de canais mais longos. Novos mecanismos de acção, por exemplo no LEV, são a modulação de uma proteína vesicular (SV2) ou CRP2 no LCM. Geralmente, é favorável a combinar os DAE com diferentes mecanismos de acção. Combinações de DAE com o mesmo mecanismo de acção, especialmente bloqueadores de canais de sódio, podem levar a um aumento das intoxicações. Em epilepsia generalizada, deve ser lembrado que tipos específicos de convulsões podem aumentar e mesmo ocorrer com efeitos no GABA e no canal do sódio. Uma terapia de combinação farmacodinâmica sinérgica e eficaz é a de VPA e LTG, embora considerações farmacocinéticas devam ser aqui tidas em conta (ver abaixo).
Como as crises epilépticas são cada vez mais entendidas como uma “disfunção de rede”, os alvos e modos de acção dos DAE terão de ser reavaliados no futuro.
Farmacocinética normalmente menos problemática
Em princípio, os DEA de segunda geração mostram menos interacção com sistemas enzimáticos e medicamentos concomitantes. Assim, a ligação proteica é geralmente mais baixa e a fracção livre, não ligada a proteínas do DEA pode desempenhar um papel, especialmente com substâncias mais antigas como o DPH; se necessário, deve ser determinada em casos individuais. Deve ter-se em conta que os DAE com indução enzimática fraca, tais como OXC, RUF, FBM e TPM (apenas a partir de uma dose de mais de 200 mg) também podem enfraquecer o efeito da contracepção hormonal. Além disso, os níveis de lamotrigina podem baixar significativamente, ou seja, em mais de 50%, sob contracepção hormonal com estrogénios, bem como durante a gravidez. As verificações espelhadas são essenciais aqui.
Os efeitos inibitórios da medicação concomitante VPA também devem ser tidos em conta com os novos DEA, pelo que os níveis de LTG também podem aumentar significativamente, para além do aumento conhecido da epoxídica carbamazepina (metabolito da CBZ). Também são possíveis ligeiros aumentos para LEV, PRP, RUF, RTG e FBM. Para outros medicamentos como o TPM e o CNS, o impacto não é claro. Deve ter-se em conta que as intoxicações e uma diminuição do efeito anti-epiléptico também podem ocorrer com os DEA de segunda geração se um medicamento inibidor ou indutor de enzimas for alterado. Especialmente no caso dos indutores enzimáticos, os efeitos ainda podem ocorrer com latências de várias semanas. Além disso, deve notar-se que o estado estacionário ocorre normalmente após cinco meias-vidas no caso de alterações de dose.
Quase todos os DEA têm um mecanismo de absorção linear, ou seja, o aumento das doses do fármaco faz com que a concentração de soro sanguíneo do fármaco aumente por um factor da quantidade da dose. As excepções são o aumento exponencial do DPH, a absorção não linearmente reduzida do VPA em doses mais elevadas, e a absorção saturável do GP e do SNC em doses mais elevadas. O PRP é absorvido com um ligeiro atraso na ingestão de alimentos, ou seja, a relação temporal entre a ingestão de alimentos e a ingestão de medicamentos deve ser sempre a mesma.
Os DAE são geralmente tomados 2×/dia; o GP, RTG e o OXC não retardado precisam geralmente de ser divididos em três doses diárias. CNS, PRP e monoterapias de dose parcialmente baixa com LTG e TPM são possíveis como doses únicas. Em relação às doses diárias, deve ser lembrado que a dose total (especialmente para o LTG) e o número de doses deve ser determinado dependendo da combinação com inibidores enzimáticos ou indutores enzimáticos.
Efeitos secundários geralmente menos graves
Mais de 20% dos doentes interrompem a terapia antiepiléptica devido aos efeitos secundários, que são mais frequentemente centrais na natureza (fadiga, ataxia da marcha, visão dupla). Titulação mais rápida é geralmente ligeiramente melhor com LEV do que com VPA. Cerca de um terço dos pacientes permanecem refractários à terapia devido aos repetidos efeitos secundários do DEA. Em resumo, quase 90% experimentam algum tipo de efeito secundário, que pode ser mais ou menos grave. No quadro 2, os efeitos secundários relevantes dos DEA de segunda geração são apresentados sem que se reivindique que estão completos.
Os novos DEA parecem ter um risco relativamente baixo de teratogenicidade (apenas até às 12 semanas de gravidez). Contudo, o número global de casos a este respeito é bastante baixo; com o maior número de dados disponíveis para LEV – o melhor perfil a este respeito – e LTG. O VPA e as politerapias têm a maior teratogenicidade. O valproato também pode ter um efeito negativo sobre o desenvolvimento cognitivo dos filhos de mães que tomam valproato.
AED e a idade
Para a terapia de epilepsia em idosos, deve considerar-se que o levetiracetam é mais adequado devido ao seu perfil farmacológico e poucas interacções, também devido aos seus efeitos secundários centrais relativamente baixos e ao seu défice cognitivo. Além disso, o uso de gabapentina e lamotrigina é útil, especialmente se houver perturbações de comportamento potencialmente acentuadas ou comorbilidades psiquiátricas devidas ao LEV. Com o LTG, o tempo de início lento deve ser tido em conta, pelo que a adição de uma benzodiazepina (por exemplo, clobazam) pode ser útil.
Indicações do DEA
As indicações para os DAE são definidas com base nos estudos disponíveis para epilepsia focal e generalizada, bem como para síndromes especiais, e são concedidas pelas autoridades competentes. Deve ter-se em mente que certos medicamentos que funcionam principalmente para ataques focais – tais como VGB, GP, PGB, LCM – podem teoricamente piorar a epilepsia generalizada. A acentuação da mioclonia em epilepsia generalizada é possível no âmbito do LTG.
De acordo com várias directrizes, a APV, seguida de TPM e LTG, são a primeira escolha para a epilepsia idiopática generalizada. Em parte, também são feitas boas experiências com LEV e CNS. O uso de VPA – embora o agente mais potente em epilepsia idiopática e generalizada com convulsões tónico-clónicas generalizadas, ausências (comparáveis à ETH) e convulsões mioclónicas – deve ser sempre questionado criticamente nas mulheres com potencial de procriação (ver abaixo).
Para ataques focais, mesmo com generalização secundária, não existem diferenças tão significativas na eficácia entre os DEA.LTG ou LEV é recomendado como o agente de primeira linha para epilepsia focal. Também é possível utilizar OXC, TPM, VPA, GP, PGB e CNS. Em vez de reintroduzir a CBZ – na Suíça, recomenda-se o teste genético HLA-B*15:02 devido à potência alergénica (positivo em cerca de 10-15% nos asiáticos; <2% na população branca) – OXC também deve ser utilizado em casos de hiponatremia ligeiramente mais elevada.
O grande número de DEA também tem sido sistematicamente investigado no que diz respeito ao seu efeito sobre as doenças concomitantes. Estas comorbidades devem ser sempre tidas em conta ao seleccionar o DEA (Quadro 2) e contribuir significativamente para a decisão de tratamento.
Ajuste individual de medicamentos de forma centralizada
Com mais de 20 DAE disponíveis, deve notar-se que a escolha individual do medicamento ideal se tornou ainda mais importante. Assim, a idade, a situação médica e social, bem como as comorbilidades dos nossos pacientes devem ser sempre tidas em conta, para além do tipo de epilepsia . O conhecimento dos efeitos secundários nos efeitos negativos e concomitantes em termos positivos deve complementar as considerações farmacocinéticas. Os pacientes com uma elevada frequência de convulsões no início da epilepsia e uma etiologia sintomática têm um risco mais elevado de não poderem ser controlados com medicação. Em casos de resistência terapêutica, a cirurgia de epilepsia deve ser considerada após dois anos de terapia mal sucedida com dois medicamentos anti-epilépticos. No total, no entanto, quase dois terços dos pacientes (50% com o primeiro DEA mais 9% com o segundo) tornam-se livres de convulsões com normalmente poucos efeitos secundários agudos e a longo prazo.
Klaus Meyer, MD
Martinus Hauf, MD
Literatura:
- Brodie MJ, Barry SJ, et al: Western Infirmary, Glasgow. Comentário em Neurologia 2012 15 de Maio; 78(20): 1542-1543.
- Glauser T, Ben-Menachem E, et al: Actualização da revisão de provas do ILAE sobre a eficácia dos medicamentos antiepilépticos como monoterapia inicial para ataques epilépticos e síndromes. Epilepsia 2013; 54(3): 551-563.
- Marson AG, Al-Kharusi AM, et al: O estudo SANAD da eficácia da carbamazepina, gabapentina, lamotrigina, oxcarbazepina, ou topiramato para o tratamento da epilepsia parcial: um ensaio aleatório e controlado sem cegueira. Lancet 2007; 369(9566): 1000-1015.
- Marson AG, Al-Kharusi AM, et al: O estudo SANAD da eficácia do valproato, lamotrigina, ou topiramato para epilepsia generalizada e não classificável: um ensaio aleatório controlado sem cegueira. Lancet 2007; 369(9566): 1016-1026.
- Costa J, Fareleira F, et al: Comparabilidade clínica dos novos medicamentos antiepilépticos em epilepsia parcial refractária: Uma revisão sistemática e meta-análise. Epilepsia 2011; 52(7): 1280-1291.
- Perucca E, Tomson T: O tratamento farmacológico da epilepsia em adultos. Lancet Neurol 2011; 10: 446-456.