O cancro do pulmão é o cancro fatal mais comum em todo o mundo, e a sua incidência ainda está a aumentar nos tempos modernos. Apesar dos avanços no diagnóstico e na terapia, a letalidade do cancro do pulmão está à frente em ambos os sexos em comparação com todos os outros cancros. Basicamente, os carcinomas de pulmão de pequenas células distinguem-se dos carcinomas de pulmão de células não pequenas, o que é de importância central para o regime terapêutico e o prognóstico. Enquanto o cancro de pulmão de pequenas células é o domínio da quimioterapia e radioterapia, o cancro de pulmão de células não pequenas (NSCLC) é operado na fase localizada e pode ser alcançada uma cura. Neste artigo de revisão, apenas se discute o seguimento e prognóstico do NSCLC que foram operados com intenção curativa.
Uma vez que o cancro do pulmão é frequentemente apenas diagnosticado numa fase avançada e frequentemente já metástaseada, apenas cerca de 25-30% de todo o “cancro do pulmão de células não pequenas” (NSCLC) pode ser tratado com cirurgia [1]. O pré-requisito para um conceito de terapia cirúrgica é a possibilidade de ressecção radical, desde que o paciente seja operável [2]. Em regra, um procedimento cirúrgico, se necessário com quimioterapia (neo)adjuvante, deve ser dirigido para as fases I a IIIA. A taxa de sobrevivência de 5 anos correspondente às fases do tumor situa-se entre 24 e 73% neste grupo de doentes (Fig. 1) [2].

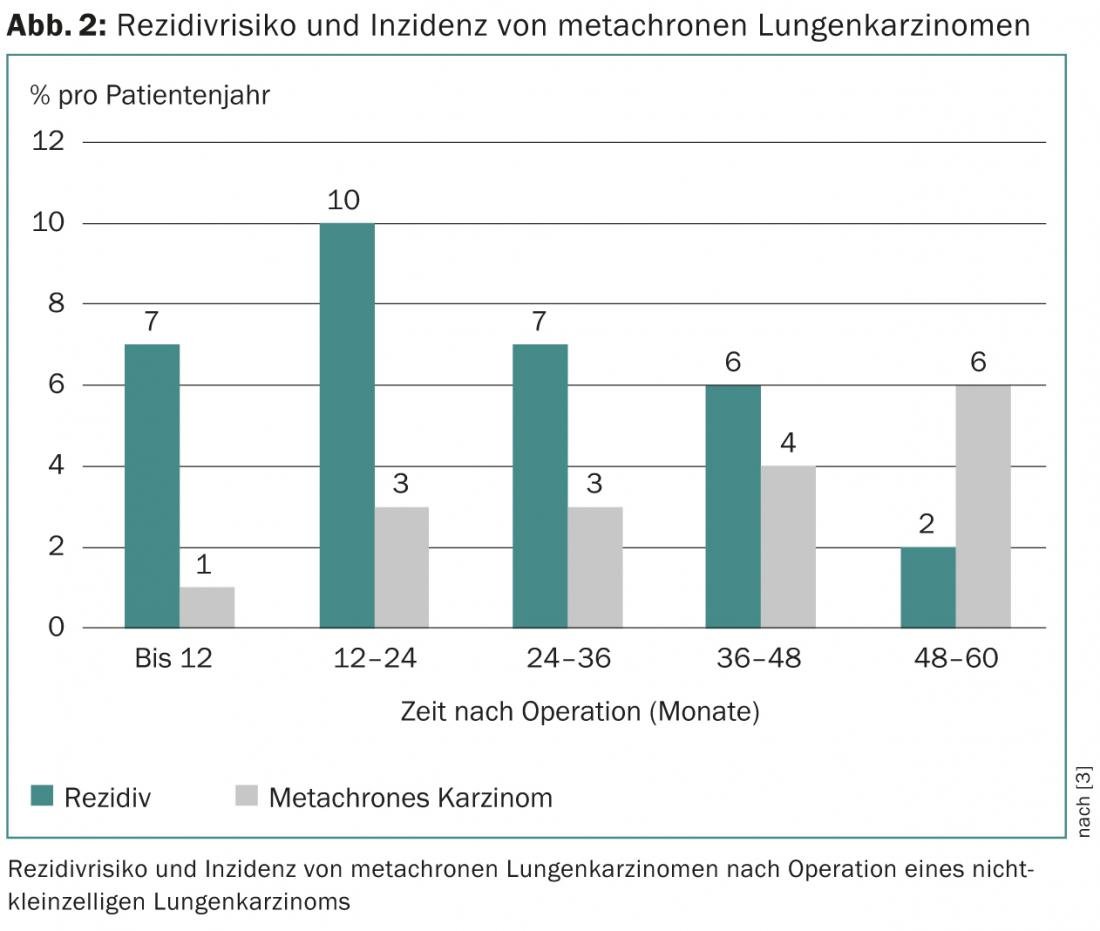
Recidiva e carcinoma metacrónico
A probabilidade de sobrevivência do paciente depende da fase do tumor e do risco correspondente de recidiva. Este último aumenta para um máximo de 10% por ano nos dois primeiros anos após a cirurgia e depois volta a diminuir lentamente [3]. Cumulativamente, 5-71% de todos os pacientes – dependendo da fase inicial do tumor – sofrem uma recidiva, que em metade dos casos ocorre nos primeiros dois anos de pós-operatório [4–7]. A recorrência de um carcinoma metacrónico (“segundo carcinoma primário”), cujo risco aumenta constantemente com o tempo após a operação, deve também ser distinguida da recorrência (Fig. 2).
Prós e contras dos cuidados de acompanhamento pós-operatório
Tendo em conta a taxa de recorrência e o risco de carcinoma metacrónico, parece razoável que estas neoplasias possam ser detectadas precocemente, ou seja, numa fase assintomática, através de uma vigilância pós-terapia estruturada – desde que uma intervenção terapêutica renovada melhore as hipóteses de sobrevivência e a qualidade de vida.
Infelizmente, os dados relativos ao valor do seguimento pós-operatório após a cirurgia do cancro do pulmão são bastante esparsos e por vezes até contraditórios. Uma vez que a taxa de recidivas locorregionais é relativamente baixa a 1-4%, não podem ser feitas afirmações fiáveis sobre o benefício do seguimento do tumor [7]. Os ensaios controlados aleatorizados que abordaram esta questão são completamente inexistentes. Num estudo prospectivo, não aleatório, foi demonstrado que o tempo médio de sobrevivência para recidivas assintomáticas é significativamente mais longo do que para recidivas sintomáticas [6]. Em contrapartida, outros autores não conseguiram encontrar qualquer influência de acompanhamento estruturado no tempo de sobrevivência ou qualidade de vida [8–10]. Contudo, numa meta-análise recente, apesar dos programas de acompanhamento heterogéneos utilizados nos estudos incluídos, o acompanhamento estruturado mostrou que as recidivas eram mais susceptíveis de serem diagnosticadas num estudo assintomático, melhorando significativamente a probabilidade de sobrevivência (hazard ratio 0,61, intervalo de confiança de 95% 0,50-0,74, p<0,01) [11]. No entanto, a relação custo-eficácia dos seguimentos pós-operatórios regulares, com cerca de 90 000 francos suíços por ano de doente, deve ser considerada [12, 13].
Infelizmente, nem a fase inicial do tumor nem a ressecabilidade de uma recorrência locorregional foram tidas em conta nos estudos anteriores que abordaram esta questão. Por esta razão, várias partes apelam a um programa de acompanhamento “individualizado”, ou seja, adaptado à fase do tumor e ao estado de saúde [7].
Métodos de cuidados de seguimento pós-operatório
Em princípio, várias modalidades podem ser utilizadas no acompanhamento pós-operatório, individualmente ou em combinação (raio-X, tomografia computorizada, tomografia por emissão de pósitrões [PET], broncoscopia, exame laboratorial e clínico).
Contudo, os programas de acompanhamento heterogéneos tornam difícil uma avaliação conclusiva dos seus benefícios e da sua relação custo-eficácia. Como já foi mencionado, há falta de ensaios aleatórios que tenham comparado as diferentes estratégias em pacientes com NSCLC que tenham sido submetidos a cirurgia. Não está actualmente claro qual o método de acompanhamento que deve ser utilizado e a que intervalos. A este respeito, as recomendações e opiniões de peritos das várias sociedades profissionais são também inconsistentes. Por outro lado, há acordo quanto à utilidade de exames regulares de seguimento (Tab. 1). Relativamente ao método, a tomografia computorizada parece ser o método de escolha devido à sua eficiência de custos, exposição relativamente baixa à radiação e sensibilidade relativamente boa (62-100%), embora o PET/CT seja superior em termos de sensibilidade (97-100%) [7].
Outra questão por resolver: Quem deve realizar os controlos de acompanhamento pós-operatórios? No entanto, num estudo retrospectivo de 245 pacientes, há provas de que não há diferença significativa na mortalidade quando o acompanhamento é feito pela equipa cirúrgica ou por um médico de clínica geral [14]. Parece mesmo razoável, segundo um estudo britânico, que enfermeiros com formação específica possam fornecer um acompanhamento comparável ao dos médicos em termos de satisfação dos pacientes e de custos [15]. No entanto, a influência nas taxas de mortalidade não foi considerada neste estudo.

Conclusão
Embora haja uma falta de dados claros relativamente ao benefício do acompanhamento pós-operatório estruturado no NSCLC, um programa de acompanhamento parece ser recomendável se puder ser oferecida uma abordagem terapêutica curativa. Uma vez que a frequência de recorrência é significativamente maior nos dois primeiros anos de pós-operatório do que nos anos seguintes, as visitas de acompanhamento devem ser mais frequentes (por exemplo, a cada 3-6 meses), especialmente durante este período. Ao mesmo tempo, contudo, deve ser salientado que o número de tomografias computorizadas, especialmente em pacientes mais jovens, deve ser tido em conta devido à exposição à radiação. No entanto, a tomografia computorizada parece ser o método de escolha no seguimento de tumores devido à sua alta sensibilidade e exposição relativamente baixa à radiação.
Conclusão para a prática
- O risco de recorrência após cancro do pulmão não pequeno operado curativamente é mais elevado nos dois primeiros anos de pós-operatório (7-10%/ano).
- Se uma recorrência for detectada precocemente numa fase assintomática, a mortalidade pode provavelmente ser reduzida, desde que uma abordagem terapêutica curativa possa ser oferecida. No entanto, a situação dos dados a este respeito é insuficiente.
- Não existem estudos aleatórios que tenham comparado diferentes programas de seguimento (modalidade, calendário e intervalo) em termos dos seus benefícios e custo-eficácia. Por conseguinte, as recomendações das diferentes sociedades profissionais são heterogéneas a este respeito.
- Devido à sua alta sensibilidade e exposição relativamente baixa à radiação, a TC é actualmente o método de escolha para detectar as recidivas precoces.
Daniel Franzen, MD
Literatura:
- Eur Respir Rev 2013; 22: 382-404.
- Peito 2009; 136: 260-271.
- J Thorac Cardiovasc Surg 2013; 145: 75-81; discussão 81-72.
- Cancer Res 1995; 55: 51-56.
- Ann Thorac Surg 1984; 38: 331-338.
- Ann Thorac Surg 2000; 70: 1185-1190.
- Ann Thorac Surg 2013; 95: 1112-1121.
- Peito 1999; 115: 1494-1499.
- J Thorac Cardiovasc Surg 1996; 112: 356-363.
- Ann Surg 1995; 222: 700-710.
- J Thorac Oncol 2011; 6: 1993-2004.
- Ann Thorac Surg 1995; 60: 1563-1570; discussão 1570-1562.
- Eur Respir J 2002; 19: 464-468.
- Ann Thorac Surg 2000; 69: 1696-1700.
- BMJ 2002; 325: 1145.
- J Clin Oncol 2004; 22: 330-353.
- Ann Oncol 2010; 21 Suppl 5: v103-115.
- Peito 2007; 132: 355S-367S.
- Radiologia 2000; 215 Suppl: 1363-1372.
- National Comprehensive Cancer Network (NCCN) Guidelines in Oncology: Non-Small Cell Carcinoma. Disponível em: www.nccn.org/professionals/physician_gls/PDF/nscl.pdf
InFo Oncologia & Hematologia 2013; 1(1): 22-24