No tratamento do cancro de pulmão de células não pequenas, muito foi conseguido num curto espaço de tempo. Manter-se a par de tantas inovações rápidas pode ser bastante difícil, mas vale a pena. Porque os pacientes já podem beneficiar enormemente das novas abordagens de tratamento.
Classicamente, existiam directrizes claras para a terapia do cancro do pulmão de células não pequenas, dependendo da fase de TNM. Estas estão actualmente a ser cada vez mais postas em causa pelo desenvolvimento de novas terapias orientadas, tais como os inibidores da tirosina quinase de 3ª geração ou imunoterapêuticas. Um exemplo disto é a nova recomendação de realizar uma terapia de manutenção com um inibidor de ponto de controlo durante um ano após a radiochemoterapia no caso da expressão PD-L1 na fase III [1].
Notícias em terapia neoadjuvante
Não só existem novas abordagens de tratamento para a terapia de manutenção na fase III, como também existem novas e excitantes opções em preparação para a terapia neoadjuvante. Por exemplo, descobriu-se recentemente que após apenas duas doses neoadjuvantes de um inibidor de PD-L1, muitos pacientes mostram uma proporção considerável de células tumorais mortas no ressecado, embora uma resposta não seja necessariamente detectável radiologicamente [2]. Uma vez que o risco de recorrência aumenta significativamente com a proporção de células tumorais vivas no tecido removido [3], esta descoberta é de grande relevância para a terapia e mostra que o bloqueio do ponto de controlo poderia ser, pelo menos, uma alternativa válida à quimioterapia também na terapia neoadjuvante. Vários medicamentos estão actualmente a ser testados para esta área de aplicação com resultados promissores até à data. Mesmo na fase IIIA, os efeitos positivos da imunoterapia perioperatória para além da quimioterapia neoadjuvante poderiam ser mostrados [4].
Diagnósticos moleculares
Considerando o potencial benefício do inibidor da tirosina quinase ou da imunoterapia mesmo em fases iniciais do tumor, as actuais directrizes para o diagnóstico molecular parecem bastante cautelosas. A análise da expressão PD-L1 é recomendada nas fases III e IV, teste das mutações comuns para as quais existem terapias específicas aprovadas, apenas na fase IV. (Tab. 1). Este conceito deve certamente ser questionado na situação actual dos dados, na qual, por exemplo, a utilização de inibidores da tirosina quinase, tais como o osimertinib como terapia adjuvante de tumores com mutação EGFR de fases inferiores, suscita esperanças justificadas [5, 6].
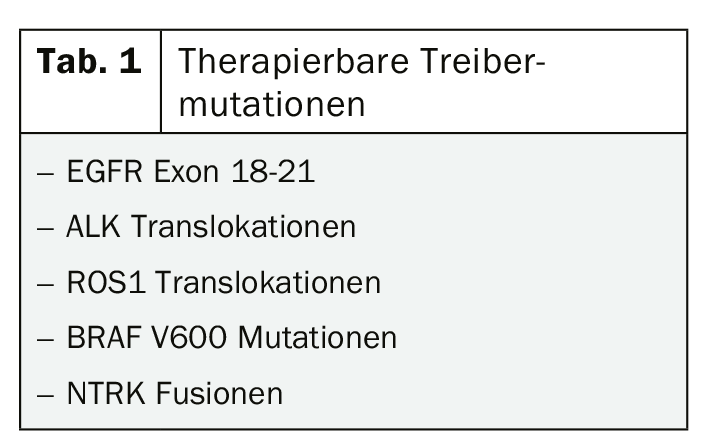
Embora as novas opções para o tratamento de NSCLC mutante em particular estejam a levar a uma certa euforia e os testes moleculares serão provavelmente expandidos num futuro próximo, é importante ter em mente que 80% dos NSCLC não têm uma mutação de condutor tratável. No entanto, para os pacientes em que uma mutação de carga pode ser detectada, a terapia orientada é a melhor escolha, pelo menos na fase IV. Consequentemente, muito aconteceu nesta área nos últimos meses com novas aprovações dos inibidores ALK brigatinib e lorlatinib, entre outros.
O que fazer se não houver mutação do condutor?
No caso mais comum de nenhuma mutação do condutor poder ser detectada na fase IV do NSCLC, existem infelizmente menos opções terapêuticas. No entanto, a imunoterapêutica está também a ser cada vez mais utilizada para estes tumores. No caso da expressão PD-L1 de mais de 50%, foram utilizados principalmente inibidores de pontos de controlo, que são claramente superiores à quimioterapia neste grupo de doentes. Independentemente da expressão da PD-L1, a combinação de imunoterapia e quimioterapia mostrou-se também mais eficaz do que apenas a quimioterapia [7].
Recentemente, surgiram também conceitos adicionais para o tratamento de NSCLC avançado sem uma mutação tratável do condutor, tais como a combinação de duas imunoterapias independentes do nível de expressão PD-L1 [8]. Esta abordagem parece ser claramente superior apenas à quimioterapia, mas ainda não foi comparada com a combinação de imunoterapia e quimioterapia. Dos dados até à data, parece que a expressão PD-L1 não é um requisito obrigatório para a resposta à imunoterapia, particularmente a imunoterapia intensificada com diferentes classes de medicamentos.
Para além de outras combinações terapêuticas, novos alvos tornaram-se recentemente conhecidos. Estes incluem o TIGIT (imunorreceptor de células T com imunoglobulina e domínio ITIM), que é frequentemente expresso em conjunto com o PD-L1. Um estudo que combinou um inibidor correspondente com o bloqueio PD-L1 deu os primeiros resultados promissores [9].
A tampa certa para o pote certo
Uma selecção correcta e mais eficiente dos pacientes para a multiplicidade de terapias disponíveis continua a ser um ponto de colagem. Terapias cada vez mais específicas e grupos-alvo mais pequenos contribuem para a importância de marcadores preditivos e diagnósticos genéticos moleculares fiáveis. Embora o gasoduto esteja a borbulhar, ainda faltam dados a longo prazo para muitas das novas substâncias e combinações. Surgem assim novas questões, obstáculos, mas também muitas mais possibilidades em cada curva. Em suma, só há uma coisa que ajuda – ficar atento!
Fonte: Fórum de Educação Médica Continuada (FOMF), Refresher, Immunoncologics and Targeted Therapies – Apresentação sobre “Non-Small Cell Lung Cancer”, Livestream 20.06.2020, PD Dr. Niels Reinmuth, Médico Oncologista Chefe da Clínica Asklepios
em Munique-Gauting (D).
Literatura:
- Antonia SJ, Villegas A, Daniel D, et al: Durvalumab após quimioradioterapia na Fase III Cancro do Pulmão Não-Pulmão de Pequenas Células. New England Journal of Medicine. 2017;377(20): 1919-1929.
- Forde PM, Chaft JE, Smith KN, et al: Neoadjuvant PD-1 Blockade in Resectable Lung Cancer. N Engl J Med. 2018;378(21): 1976-1986.
- Hellmann MD, Chaft JE, William WN, Jr, et al: Resposta patológica após quimioterapia neoadjuvante em cancros pulmonares não pequenos: proposta para a utilização da resposta patológica principal como um ponto de chegada substituto. Lancet Oncol. 2014;15(1): e42-50.
- Rothschild S, Zippelius A, Savic S, et al.: SAKK 16/14: Anti-PD-L1 anticorpo durvalumab (MEDI4736) para além da quimioterapia neoadjuvante em doentes com cancro do pulmão de fase IIIA(N2) não de pequenas células (NSCLC)- um ensaio multicêntrico fase II de um único braço. Journal of Clinical Oncology. 2016;34(15_suppl): TPS8573-TPS.
- Zhong WZ, Wang Q, Mao WM, et al: Gefitinib versus vinorelbine mais cisplatina como tratamento adjuvante para a fase II-IIIA (N1-N2) EGFR-mutant NSCLC (ADJUVANT/CTONG1104): um estudo aleatório, de rótulo aberto, fase 3. Lancet Oncol. 2018;19(1): 139-148.
- Wu YL, Herbst RS, Mann H, et al: ADAURA: Fase III, Duplo-cego, Estudo Aleatório de Osimertinib Versus Placebo em EGFR Mutação-positiva NSCLC de Fase Inicial após Ressecção Cirúrgica Completa. Clin Lung Cancer (Câncer de pulmão). 2018;19(4): e533-e536.
- Jotte RM, editor IMpower131: Primary PFS and safety analysis of a randomized phase III study of atezolizumab + carboplatin + paclitaxel or nab-paclitaxel vs carboplatin + nab-paclitaxel as 1L therapy in advanced squamous NSCLC2018; Reunião Anual da ASCO: American Society of Clinical Oncology.
- Hellmann MD, Paz-Ares L, Bernabe Caro R, et al: Nivolumab plus ipilimumab in Advanced Non-Small-Cell Lung Cancer. New England Journal of Medicine. 2019;381(21): 2020-2031.
- Rodriguez-Abreu D, Johnson ML, Hussein MA, et al: Análise primária de um estudo randomizado, duplo-cego, fase II do anticorpo antiTIGIT tiragolumab (tira) mais atezolizumab (atezo) versus placebo mais atezo como tratamento de primeira linha (1L) em doentes com NSCLC (CITYSCAPE) seleccionado PD-L1. Journal of Clinical Oncology. 2020;38(15_suppl): 9503.
InFo ONCOLOGY & HEMATOLOGY 2020; 8(4): 30-31 (publicado 20.9.20, antes da impressão).
InFo PNEUMOLOGIA & ALERGOLOGIA 2020, 2(3): 34-35