O artigo seguinte visa fornecer uma visão geral dos sintomas não-motores (EMN) mais comuns na DP, a forma como são diagnosticados e tratados, especialmente porque alguns são tratáveis e a sua melhoria tem um impacto significativo na qualidade de vida dos pacientes. A apatia pode responder à terapia dopaminérgica. Em caso de depressão, o tratamento deve ser principalmente com terapia dopaminérgica e depois de preferência com agonistas dopaminérgicos com afinidade com o receptor D3. A terapia para psicoses e distúrbios de controlo de impulsos envolve inicialmente a redução da medicação responsável. A demência pode ser positivamente influenciada pela terapia com inibidores da colinesterase. Uma vez que a dopamina desempenha um papel no ciclo sono-vigília, as perturbações do sono podem também responder à terapia dopaminérgica. A optimização e o uso de analgésicos ajudam na dor. A estimulação cerebral profunda também pode melhorar os sintomas não motores.
Os sintomas não motores (EMN) ocorrem no decurso da doença de Parkinson em quase todos os doentes [1]. É um amplo espectro de sintomas que frequentemente limitam mais a qualidade de vida do que os sintomas motores e muitas vezes não recebem atenção suficiente por parte da pessoa afectada, prestadores de cuidados e médicos [2, 3]. Como resultado, são também subdiagnosticados e subtratados, sendo alguns dos sintomas considerados um efeito adverso da terapia dopaminérgica.
Em geral, os sintomas não motores são mais comuns na DP avançada, mas alguns, tais como hiposmia, distúrbio do comportamento do sono REM, obstipação e depressão, podem preceder a DP motora por vários anos [4]. Está agora bem estabelecido que os EMN, tais como depressão ou distúrbios do sono, mas especialmente o número total de EMN, reduzem significativamente a qualidade de vida dos pacientes com DP [3, 4]. A fisiopatologia é complexa e pode ser feita uma distinção entre sintomas dopaminérgicos e não dopaminérgicos, as ligações serotonérgicas e noradrenérgicas são também susceptíveis de estar envolvidas. De acordo com o conceito de uma patologia corporal ascendente de Lewy em seis fases iniciada por Braak e colaboradores com base em autópsias [5], começando no bulbo olfactivo e núcleos inferiores do tronco cerebral, alguns dos EMN parecem ser explicados como sintomas pré-motores (Fig. 1).

A evidência histológica da α-sinucleína nos núcleos parassimpáticos sacrais, nos gânglios simpáticos e no plexo nervoso entérico também apoia a hipótese de uma patologia ascendente, mas também sistémica. A tríade clássica dos sintomas motores pode ser atribuída às fases três e quatro com o envolvimento da substantia nigra.
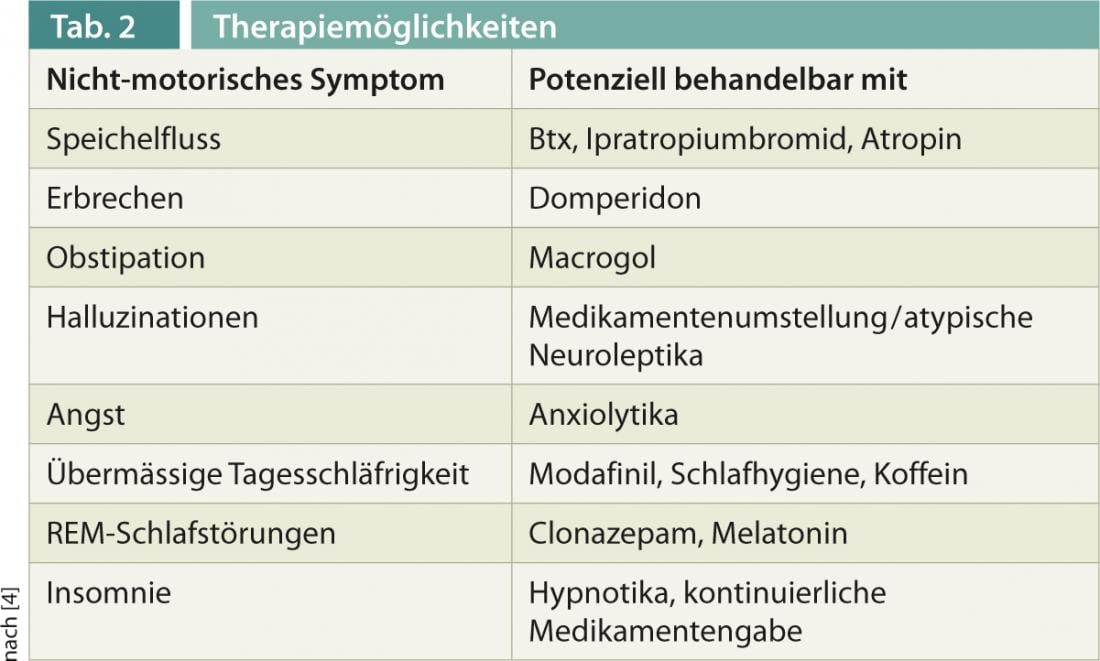
O Quadro 1 fornece uma visão geral do amplo espectro dos EMN.

Para a exploração e documentação do NMS, foram estabelecidas várias escalas nos últimos anos, tais como a Escala de Sintomas Não-Motores (NMSS), ou questionários para perguntas específicas, tais como a Escala de Sono da Doença de Parkinson (PDSS-2). Para alguns sintomas, existem agora terapias bem comprovadas, que são apresentadas abaixo e também no quadro 2 .
Apatia, depressão e psicoses
Os sintomas neuropsiquiátricos têm um impacto significativo na qualidade de vida, com os doentes com DP não dominantes pelo tremor a apresentarem um risco mais elevado de declínio cognitivo, depressão, apatia e alucinações [4].
A apatia é um problema específico na doença de Parkinson e pode responder à terapia dopaminérgica, especialmente a administração de agonistas dopaminérgicos.
A depressão pode preceder os sintomas motores e não há correlação entre a depressão e a gravidade da síndrome de Parkinson motora. Os agonistas dopaministas com uma clara afinidade com o receptor D3, aqui especialmente pramipexole e ropinirole, parecem ser superiores a outros agonistas dopaministas em termos do seu efeito antidepressivo. Como passo seguinte, podem ser utilizados os SSRIs e SNRIs bastante mais recentes, e os antidepressivos mais recentes tais como mirtazapina, reboxetina e venlafaxina também são aqui considerados, apesar das provas ainda limitadas [6].
A psicose é uma das complicações não-motoras mais incapacitantes da doença de Parkinson. As alucinações visuais podem preceder ou acompanhar a deterioração cognitiva e são consideradas um sinal de alerta para o desenvolvimento da demência na DP [4]. A terapia, após excluir outros factores desencadeantes como infecções ou perturbações metabólicas, consiste em primeiro lugar em reduzir ou descontinuar os medicamentos responsáveis (em ordem: Anticolinérgicos, antidepressivos, amantadinas, agonistas dopaminérgicos, inibidores da MAO-B e por último inibidores da COMT e levodopa) e depois a administração de neurolépticos atípicos como a clozapina ou também a quetiapina, em que apenas a clozapina é aprovada para esta indicação.
Demência, controlo de impulsos e Perturbações do sono
A prevalência de demência nos doentes com DP é de 30-40%. A idade é considerada o principal factor de risco para o desenvolvimento da demência, e não a duração da doença. Primeiro, as drogas que podem levar à deterioração cognitiva devem ser descontinuadas; num segundo passo, são utilizados inibidores da colinesterase, sendo os dados mais convincentes para a rivastigmina, que é aprovada para a demência de Parkinson leve a moderada [4].
Os distúrbios de controlo de impulsos como o jogo patológico, a alimentação, as compras ou mesmo a hipersexualidade não são normalmente relatados, também devido à vergonha, e ocorrem mais frequentemente em associação com agonistas dopaminérgicos, bem como nos homens. Os médicos que tratam devem perguntar activamente sobre estes sintomas, porque se os distúrbios de controlo de impulsos forem negligenciados, podem surgir problemas de relacionamento graves permanentes e também dificuldades financeiras. A terapia consiste na redução ou descontinuação imediata dos agonistas da dopamina, em particular.
As perturbações do sono podem apresentar-se de muitas maneiras (Tab. 1), são um problema muito comum e muitas vezes grave e podem ter várias causas. Como a dopamina desempenha um papel no ciclo sono-vigília, algumas perturbações do sono na DP podem responder a uma terapia dopaminérgica optimizada. Isto foi demonstrado, por exemplo, para a rotigotina transdérmica, o que levou a uma melhoria significativa tanto nas deficiências motoras matinais como nas perturbações do sono, registadas com o PDSS-2 [7]. Ao utilizar agonistas dopaminérgicos, deve prestar-se atenção aos possíveis efeitos secundários do aumento da sonolência diurna e dos ataques súbitos de adormecer, o que pode exigir uma redução da dose ou mesmo a sua interrupção [8]. O distúrbio do comportamento do sono REM caracteriza-se pela realização de sonhos (frequentemente pesadelos) devido à falta de atonia muscular durante o sono REM. A terapia medicamentosa consiste no uso de clonazepam à noite [9]. Para o tratamento da síndrome das pernas inquietas, os agonistas dopaministas são principalmente utilizados, alternativamente, dependendo da gravidade, gabapentina ou pré-gabalina, em casos graves também opiáceos [10]. Um componente importante no tratamento de todas as perturbações do sono continua sempre a ser a manutenção de uma boa higiene do sono (horas regulares de sono e vigília, tempo adequado na cama, ou seja, normalmente não mais de 8 horas). Outras causas tratáveis de distúrbios do sono, como a síndrome da apneia obstrutiva do sono, devem ser excluídas.
Dor
A dor é um sintoma comum em pacientes com DP e pode ter muitas causas diferentes (musculoesquelética, secundária à distonia, central, radicular, neuropática). O ajustamento da terapia dopaminérgica pode levar a melhorias, e numa próxima etapa deve ser considerada a utilização de analgésicos, dependendo da causa.
Para além das flutuações motoras, a estimulação cerebral profunda (THS) no núcleo subthalâmico melhora a gravidade e as flutuações dos sintomas não motores, tais como perturbações sensoriais, dor, urgência urinária, disautonomia e perturbações do sono. As queixas gastrintestinais são também atenuadas, levando a uma melhoria global notável da qualidade de vida um ano após a THS [11].
Relevância para as terapias neuroprotectoras
Especialmente no que diz respeito a possíveis terapias neuroprotectoras no futuro, o diagnóstico precoce tendo em conta os EMN acima mencionados poderia ser clinicamente muito relevante [10]. A atenção, investigação e terapia do EMN na doença de Parkinson tornar-se-á cada vez mais relevante.
Stephan Nitschke, MD
Prof. Dr. med. Barbara Tettenborn
Stefan Hägele-Link, MD
Literatura:
- Barone P, et al: O estudo PRIAMO: uma avaliação multicêntrica dos sintomas não motores e do seu impacto na qualidade de vida na doença de Parkinson. Mov Disord 2009; 24(11): 1641-1649.
- Chaudhuri KR, et al: A não declaração de sintomas não motores da doença de Parkinson aos profissionais de saúde: um estudo internacional utilizando o questionário de sintomas não motores. Mov Disord 2010; 25 (6): 704-709.
- Chaudhuri KR, et al: Parkinson’s disease: The non-motor issues. Parkinsonism Relat Disord 2011 Dez; 17(10): 717-723.
- Chaudhuri KR, et al: Handbook of Non-Motor Symptoms in Parkinson’s disease. Springer 2011.
- Braak H, et al: Encenação da patologia cerebral relacionada com a doença de Parkinson esporádica. Envelhecimento do Neurobiol 2003; 24 (2): 197-211.
- Directrizes da DGN, Setembro de 2012.
- Trenkwalder C, et al.: Efeitos da ratigotina na função motora matinal e no sono na doença de Parkinson: um estudo duplo-cego, aleatório e controlado por placebo (RECOVER). Mov Disord 2011, 26(1): 90-99.
- Maass A, et al: Sono e sintomas não motores na doença de Parkinson. J Transmissão Neural 2013 Abril; 120(4): 565-569.
- Aurora RN, et al: Guia de boas práticas para o tratamento do distúrbio do comportamento do sono REM (RBD). J Clin Sleep Med 2010; 6(1): 85-95.
- Garcia-Borreguero D, et al.: European guidelines on management of restless legs syndrome: relatório de uma task force conjunta da Federação Europeia de Sociedades Neurológicas, da Sociedade Neurológica Europeia e da Sociedade Europeia de Investigação do Sono. Eur J Neurol 2012; 19(11): 1385-1396.
- Steigerwald F, Volkmann J: Estimulação profunda do cérebro (THS) na doença de Parkinson: Verificar indicação de THS já nas primeiras flutuações de efeito. InFoNeurology&Psychiatry 2013; 15(5): 38-45.