A anticoagulação deve ser adaptada individualmente ao sistema de apoio e ao doente. Foi demonstrado que os pacientes com sistemas não pulsáteis adquiriram a síndrome de von Willebrand, o que aumenta o risco de complicações hemorrágicas. Os estudos com novos anticoagulantes orais ainda não foram realizados em doentes com dispositivos de assistência cardíaca. Por conseguinte, não há aprovação de novos anticoagulantes orais para doentes com LVAD.
Os dispositivos de assistência ventricular (VADs) são agora um tratamento estabelecido para a insuficiência cardíaca terminal. Por exemplo, em 2012 foram implantados mais dispositivos de assistência ventricular esquerda do que corações em todo o mundo. Na Suíça, no ano passado, foram realizados 33 transplantes cardíacos em comparação com 116 pacientes em lista de espera para transplante cardíaco. O tempo de espera para um coração doador foi de 179 dias em 2009. Isto explica a importância crescente dos sistemas de apoio que estão disponíveis sem limites.
Embora os dados a longo prazo de mais de dez anos ainda não estejam disponíveis, as taxas de sobrevivência de 1 e 2 anos após a implantação do DVA são muito promissoras, de modo que muitos sistemas são agora utilizados não só como ponte para o transplante cardíaco, mas também como solução definitiva.
Sistemas VAD na Suíça
No caso de sistemas de apoio cardíaco, deve ser feita uma distinção entre sistemas pulsáteis e não pulsáteis. As bombas não pulsáteis tornaram-se predominantes nos sistemas de assistência ventricular esquerda. As bombas pulsáteis são utilizadas principalmente para suporte cardíaco biventricular ou ventricular direito a longo prazo.
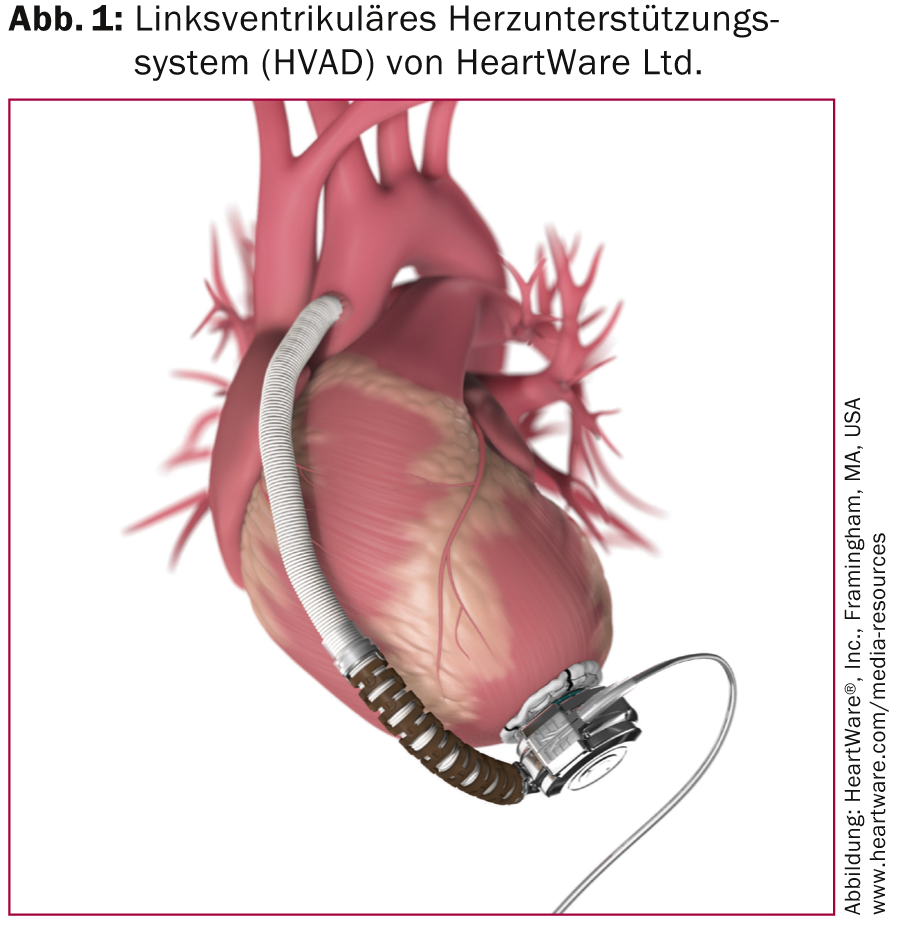
Os dispositivos de assistência ventricular esquerda mais frequentemente implantados são o HVAD (Fig. 1) e o HeartMate II (Fig. 2).

O Quadro 1 apresenta uma visão parcial dos sistemas no mercado.

Anticoagulação
No entanto, após a operação, a anticoagulação também deve ser adaptada individualmente ao paciente, dependendo da bomba.
Sistemas de apoio temporário: Os sistemas temporários são geralmente anticoagulados continuamente com heparina durante a curta duração. De acordo com a empresa, um ACT de >300 s deve estar presente na implantação. No curso seguinte, o ACT alvo está entre 160 e 180 s e o PTT alvo é um aumento de 1,5-1,8 vezes [1, 2].
Sistemas de apoio não pulsáteis a longo prazo: Na maioria dos casos, a implantação de um DVA é realizada com a utilização da máquina coração-pulmão, pelo que é necessária a administração de heparina com um ACT >400 s intra-operatoriamente. Se a implantação for realizada sem uma máquina coração-pulmão, deve ser atingido um ACT de >200 s durante a implantação. Após a paragem da máquina coração-pulmão ou no final da operação, a heparina é completamente antagonizada.
A anticoagulação adicional só deve ser iniciada após 24h. O PTT alvo situa-se entre 40 e 60 s no primeiro a segundo dia de pós-operatório.
Para bombas centrífugas, o PTT alvo deve ser aumentado para 60-80 s do segundo ao terceiro dia pós-operatório. Depois de mudar para warfarin, o INR recomendado situa-se entre 2,0 e 3,0. A agregação plaquetária adicional, por exemplo aspirina (81-325 mg/tgl.), pode ser iniciada a partir do primeiro dia pós-operatório e deve ser administrada o mais tardar após a remoção dos tubos torácicos.
Para a bomba axial HeartMate II, o PTT alvo é ligeiramente mais baixo do segundo ao terceiro dia pós-operatório (60-75 s) e o INR alvo após a mudança para warfarin está entre 2,0 e 3,0 (de acordo com os dados da empresa). Para agregação plaquetária, a aspirina é 81-325 mg/tgl. recomendado [3].
Após ajuste individual da dose de warfarin, a agregação plaquetária deve ser verificada adicionalmente por meio de um teste de agregação plaquetária ou, se for administrado clopidogrel, por meio de um teste VASP e ajustado individualmente.
Sistemas de apoio a longo prazo pulsáteis: Para o PVAD de Thoratec, a heparina, alvo PTT com 1,5 vezes mais, deve ser iniciada após redução da hemorragia para menos de 50 ml/h. Ao mudar para warfarin, o INR alvo é 2,5-3,5. Para agregação plaquetária, 100 mg de aspirina podem ser adicionados diariamente [4].
O excor requer uma INR de 3,0-3,5 em adultos e uma agregação plaquetária de pelo menos 75 mg por dia de aspirina e dipiridamol a um mínimo de 150 mg por dia, que deve ser igualada à contagem de plaquetas [5].
Para o acompanhamento ambulatório, cada paciente deve receber um Coagu-Check.
Perturbações de coagulação: A síndrome de von Willebrand adquirida tem sido demonstrada em alguns sistemas não pulsáteis. As forças de corte nas bombas axiais e centrífugas alteram a estrutura do factor von Willebrand para que este possa ser clivado pela metaloproteinase ADAMTS13 [6]. Por conseguinte, há uma ausência dos grandes multimers que são os principais responsáveis pela hemostasia primária (Fig. 3).

Além disso, não é inteiramente claro até que ponto uma mudança nas plaquetas ocorre em resultado das bombas de apoio. Por exemplo, danos nos receptores plaquetários (GPIb-V-IX) devido a tensão de corte [7], mas também redução da agregação plaquetária devido a produtos de clivagem do factor von Willebrand são discutidos [8, 9].
Os estudos com novos anticoagulantes orais ainda não foram realizados em doentes com dispositivos de assistência cardíaca. Um estudo com heparina de baixo peso molecular até à descontinuação com warfarina após o implante de um dispositivo de assistência ventricular esquerda [10] mostrou um aumento da taxa de AVC nos primeiros 30 dias após dedução do tempo perioperatório de 48 h com 2,5 vs. ≤0,7% [11,12].
Anticoagulação de complicações
Hemorragia: Os factores de risco multivariados para um aumento da taxa de hemorragia após a implantação do DVA são a idade, o sexo feminino, a cardiomiopatia isquémica e um hematócrito pré-operatório reduzido [13]. A medida em que a anticoagulação adaptada traz uma melhoria para estes subgrupos ainda precisa de ser investigada.
Em doentes com hemorragia gastrointestinal, um algoritmo de Suarez et al. [14, 15], segundo o qual a anticoagulação completa deve primeiro ser pausada. Se a fonte de hemorragia for identificada e tratada, a warfarina deve ser iniciada primeiro e a inibição da agregação plaquetária deve continuar a ser pausada. Se houver mais complicações hemorrágicas, o INR pode ser reduzido para 1,5-2,0.
Para parar a hemorragia quando a fonte da hemorragia não é identificada, recomenda-se a administração de factores de coagulação como concentrados de protrombina ou Haemate®, concentrados de plaquetas, octreotídeo e desmopressina.
Trombose da bomba: Em doentes com suspeita de trombose da bomba com parâmetros de hemólise elevados, a coagulação deve ser primeiro optimizada e, se necessário, deve ser administrada heparina contínua. Se a suspeita persistir, é recomendada a administração de inibidores de trombina. Se isto não resultar num tratamento bem sucedido, deve ser considerada a substituição do dispositivo de assistência ventricular ou a realização da terapia de lise [16]. Se curado, um INR elevado com a adição de um segundo agente antiplaquetário deve ser considerado no curso seguinte [17].
Anticoagulação durante a cirurgia: De acordo com as directrizes do American College of Chest Physicians, a warfarina deve ser descontinuada cinco a seis dias antes e um agente antiplaquetário sete dias antes de uma operação planeada com um risco acrescido de hemorragia e mudada para heparina [18]. No entanto, não existem directrizes para pacientes com DVA para cirurgia não-cardíaca num artigo de Morgan et al. mostrou que a mudança de warfarin e ASA para heparina com pausa perioperatória da heparina resultou em menos complicações hemorrágicas [19]. Em caso de cirurgia de emergência ou urgente, podem ser administrados FFP, concentrados de protombina ou vitamina K [3]. Para cirurgias menores tais como extracção de dentes ou cirurgia da pele, recomenda-se a anticoagulação contínua com warfarina e ASA para pacientes que não sejam da LVAD. Um enxaguamento oral com ácido tranexâmico e hemostasia local com esponjas de colagénio e cola de fibrina, bem como a utilização de uma tala dentária, podem prevenir adicionalmente a hemorragia [20].
Anna L. Meyer, MD
Literatura:
- Oliver WC: Anticoagulação e gestão da coagulação para EMCO. Semin Cardiothorac Vasc Anesth 2009; 13(3): 154-175.
- http://columbialvad.org/pdf/centrimag.pdf.
- Feldmann D, et al: The 2013 International Society for Heart and Lung Transplantation Guidelines for mechanical circulatory support: executive summary. J Transplante de pulmão de coração 2013; 32(2): 157-187.
- www.thoratec.com/_assets/download-tracker/15579-A.pdf.
- www.berlinheart.de/UserFiles/Downloaddokumente/Medical_Professionals_Distributoren/Non_US/EXCOR_Parakorporales_Herzunterstuetzungssystem/Gebrauchsanweisungen/EXCOR_VAD_Ikus_Antrieb/Ikus_Rev_2_1_Software_3_40/Gebrau3.40AMRev80en.pdf.
- Tsai HM: A clivagem fisiológica do factor von Willebrand por uma protease de plasma depende da sua conformação e requer o ião de cálcio. Sangue 1996; 87(10): 4235-4244.
- Himmelfarb J, et al: Elevação dos níveis de plasmaglycocalicina e diminuição da aglutinação plaquetária induzida por ristocetina em doentes em hemodiálise. Am J Kidney Dis 1998; 32(1): 132-138.
- Sugimoto M, et al.: Modulação funcional do domínio isolado de ligação da glicoproteína Ib do factor von Willebrand expresso em Escherichia coli. Bioquímica 1991; 30(21): 5202-5209.
- Alevriadou BR, et al.: Análise em tempo real da formação de trombos dependentes do cisalhamento e do seu bloqueio por inibidores do factor von Willebrand que se ligam às plaquetas. Sangue 1993; 81(5): 1263-1276.
- Sandner SE, et al: Heparina de baixo peso molecular para anti-coagulação após implante de dispositivo de assistência ventricular esquerda. J Tranplante Pulmonar de Coração 2014; 33(1): 88-93.
- Starling RC, et al: Resultados do estudo de aprovação pós-U.S. Food and Drug Administration – com um dispositivo de assistência ventricular esquerda de fluxo contínuo como ponte para o transplante cardíaco: um estudo prospectivo utilizando o INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support). J Am Coll Cardiol 2011; 57(19): 1890-1898.
- Miller LW, et al: Utilização de um dispositivo de fluxo contínuo em pacientes que aguardam transplante cardíaco. N Engl J Med 2007; 357(9): 885-896.
- Boyle AJ, et al: Pre-Operative Risk Factors of Bleeding and Stroke During Left Ventricular Assist Device Support: An Analysis of More than 900 HeartMate II Outpatients . J Am Coll Cardiol 2014; 63(9): 880-888.
- Suarez J, et al: Mecanismos de sangramento e abordagem a pacientes com dispositivos de assistência ventricular esquerda de fluxo axial. Circ Heart Fail 2011; 4(6): 779-784.
- Tamez D, et al: Early Feasibility Testing and Engineering Development of the Transapical Approach for the HeartWare MVAD Ventricular Assist System. ASAIO J 2014; 60(2): 170-177.
- Schlendorf K, et al: Terapia trombolítica para trombose de dispositivos de assistência ventricular de fluxo contínuo. J Card Fail 2014; 20(2): 92-97.
- Goldstein DJ, et al: Algoritmo para o diagnóstico e gestão de suspeitas de trombos de bomba. J Transplante de pulmão de coração 2013; 32(7): 667-670.
- Douketis JD, et al: Perioperative management of antithombotic therapy: Antithrombotic Therapy and Prevention of Thrombosis,9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Peito 2012; 141(2 Suppl): e326S-350S.
- Morgan JA, et al: Cirurgia não-cardíaca em pacientes em suporte de dispositivo de assistência ventricular esquerda a longo prazo. J Heart Lung Transplant 2012; 31(7): 757-763.
- Lund JP, et al: Gestão cirúrgica oral de pacientes com apoio circulatório mecânico. Int J Oral Maxillofac Surg 2002; 31(6): 629-633.
CARDIOVASC 2014; 13(2): 18-20