Alguns estudos importantes e interessantes no campo da reumatologia do último ano são resumidos. Como em todos os campos, as possibilidades técnicas e analíticas estão a acelerar exponencialmente na investigação básica. Como resultado, o número de estudos publicados anualmente em reumatologia está também a aumentar constantemente, e mais investigação e publicações estão a ser realizadas em todas as áreas da reumatologia do que nunca.
O artigo seguinte resume alguns estudos importantes e interessantes no campo da reumatologia do ano passado. É de notar que a selecção de estudos é, por um lado, completamente subjectiva e, por outro, naturalmente incompleta. Como em todos os campos, as possibilidades técnicas e analíticas estão a acelerar exponencialmente na investigação básica. Como resultado, o número de estudos publicados anualmente em reumatologia está também a aumentar constantemente, e mais investigação e publicações estão a ser realizadas em todas as áreas da reumatologia do que nunca. (Fig. 1). Contudo, só o tempo dirá quantos destes resultados terão realmente um impacto a longo prazo na nossa compreensão das doenças reumatológicas.
Biópsias guiadas por ultra-sons e análises unicelulares
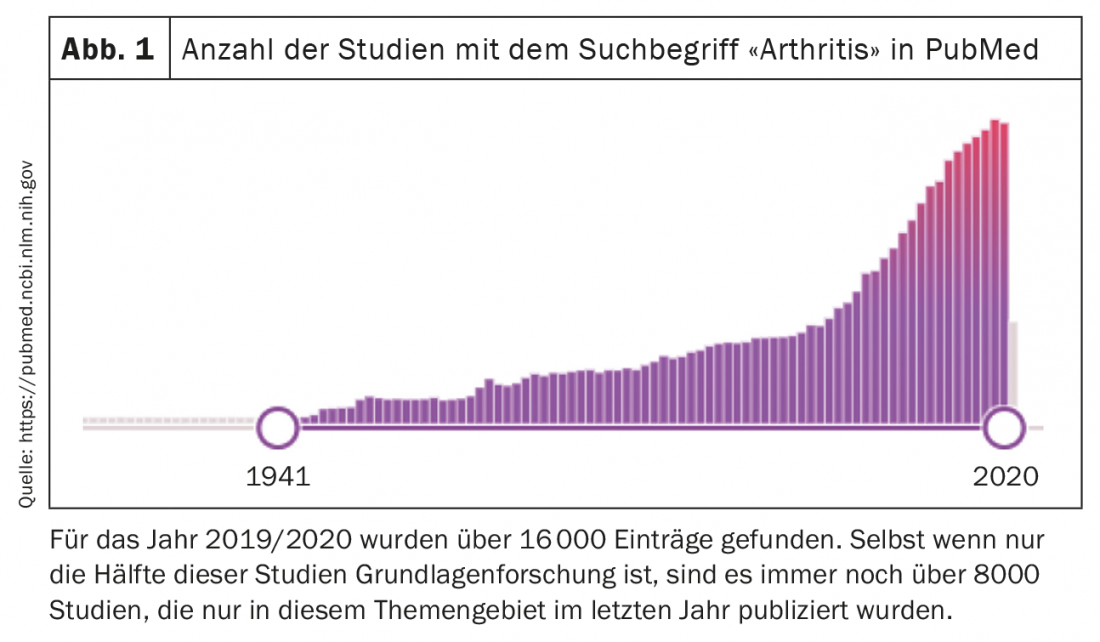
Na análise das causas patogénicas, os estudos de tecido sinovial tornaram-se cada vez mais importantes nos últimos anos, especialmente na análise da artrite reumatóide (AR), para além de estudos de células sanguíneas e anticorpos. Por um lado, a realização de biópsias sinoviais guiadas por ultra-sons está a tornar-se cada vez mais aceite e é rotineiramente realizada em muitos locais. Por outro lado, os avanços no desenvolvimento de tecnologias de análise de células únicas estão a abrir novas possibilidades para a investigação diferenciada das mudanças nas populações de células individuais na articulação. Com estas análises de célula única, a expressão genética, o chamado transcriptoma, bem como a expressão proteica e mesmo as alterações na cromatina podem ser medidas separadamente em cada célula individual. A maioria dos estudos realizados até à data utilizaram medições do transcriptoma para definir populações celulares e analisar alterações na sua composição e expressão genética em doentes. Contudo, à medida que o desenvolvimento progride e o campo se torna mais rentável, é provável que haja cada vez mais estudos que medem simultaneamente as mudanças na cromatina, transcriptoma e expressão proteica em células individuais. A análise monocelular de tecidos complexos permite caracterizar os tipos celulares, subtipos celulares e fenótipos celulares num tecido e assim identificar as células que são activadas numa doença e que têm assim um papel-chave potencial na patogénese (Fig. 2) .
A chamada Accelerated Medicine Partnership (AMP) dos EUA está a liderar nesta área. Este consórcio, que é parcialmente financiado industrialmente e parcialmente pelo Estado, já foi capaz de apresentar vários estudos em que tipos de células imunitárias, mas também células estromais em vários tecidos-alvo e várias doenças reumáticas poderiam ser caracterizadas. No sinovium, já foram descritos novos tipos de células imunitárias relevantes para a AR e definidos diferentes subtipos de fibroblastos [1]. Estes dados foram completados no ano passado e a formação e função das diferentes populações de fibroblastos pôde ser melhor analisada.
Interacções entre endotélio e fibroblastos em sinovium RA
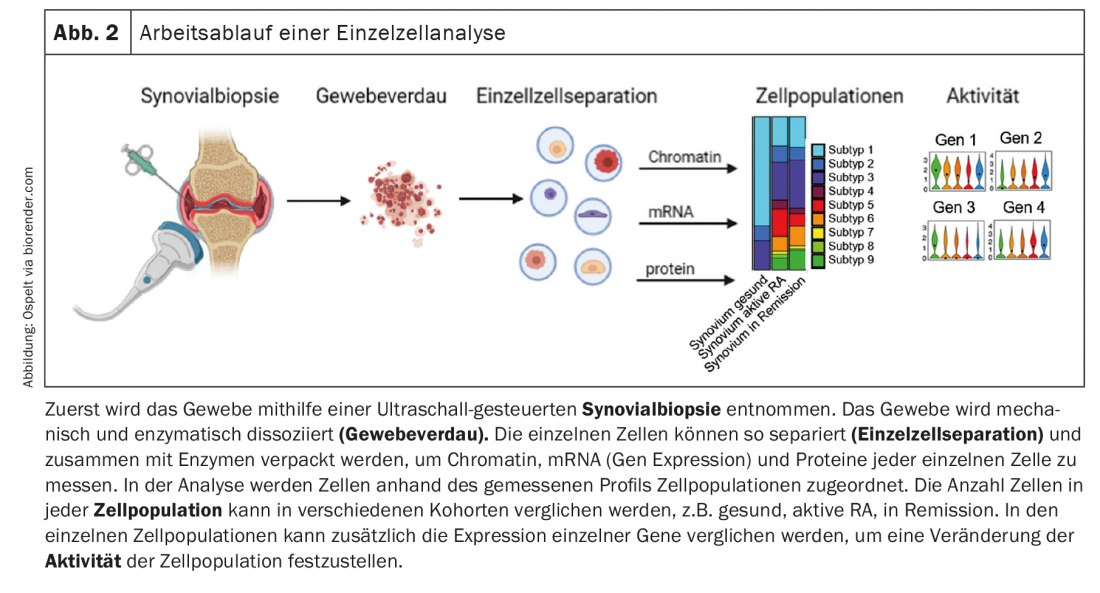
Na sua primeira publicação, os autores identificaram diferentes subtipos de fibroblastos sinoviais no tecido [1]. Em particular, os fibroblastos sinoviais CD90-negativos, que se encontram no revestimento sinovial, e os fibroblastos sinoviais CD90-positivos, que se encontram no subline, poderiam ser distinguidos. Os autores prosseguiram agora com a hipótese de se estabelecer um gradiente no tecido sinovial que suporta a formação destes diferentes subtipos de fibroblastos [2]. De facto, as análises dos receptores ligand demonstraram que as células endoteliais estabilizam o subtipo CD90-fibroblasto positivo através da activação do caminho de sinalização Notch. Esta activação foi mais forte no tecido RA do que no tecido OA. Utilizando modelos de rato com ratos Notch3 knock-out, ou inibição farmacológica da via de sinalização Notch, os autores conseguiram mostrar que a inibição Notch é um novo alvo potencial para a terapia da AR, uma vez que a artrite em ratos foi significativamente influenciada positivamente por ela [2]. Globalmente, este estudo enquadra-se elegantemente em estudos anteriores que demonstraram que na AR são principalmente os fibroblastos CD90 positivos que se expandem [1] e que os fibroblastos no revestimento são mais responsáveis pela invasão e os fibroblastos no subline são mais responsáveis pela resposta inflamatória [3]. Este novo estudo sugere agora que a activação do endotélio leva à mobilização de populações de fibroblastos locais na AR, que então mantém a inflamação. Em resumo, a via de sinalização Notch é aqui de interesse como potencial alvo terapêutico, por um lado, e o papel da activação endotelial na AR, por outro, que certamente precisa de ser mais investigado no futuro (Fig. 3).
Nova população de macrófagos em tecido sinovial
O nosso conhecimento das populações de macrófagos em tecido sinovial também foi grandemente expandido no último ano. Culeman e colegas estudaram diferentes populações de marrowrofagos na articulação em ratos e o seu comportamento durante o desenvolvimento da artrite [4]. Entre outras coisas, foram encontrados macrófagos no revestimento sinovial (CX3CR1+), que parecem selar o sinovial do interior da articulação com a sua disposição e os contactos célula-célula. Quando a artrite foi induzida em ratos, esta arquitectura do forro mudou. Os macrófagos abrem os seus contactos celular-células e agora formam paliçadas. Os fibroblastos de revestimento, que se encontravam sob esta camada de macrófagos na articulação saudável, agora virtualmente apertados entre eles e tiveram mais contacto com o interior da articulação. Estes macrófagos não proliferam por divisão, mas são provavelmente alimentados por um conjunto de macrófagos CX3CR1-negativos proliferantes no revestimento que se diferenciam nesta população CX3CR1-positiva. É importante notar que esta alteração morfológica nos macrófagos também foi encontrada no revestimento sinovial dos pacientes de AR, mas não nos pacientes com AIO. Em OA, ou seja, sinovium relativamente saudável, estes macrófagos são TREM2 positivos, que é um marcador para uma subpopulação anti-inflamatória da medula. Quando esta população de macrófagos se esgotava em ratos, a progressão da artrite era mais rápida e mais severa. Esta população especializada de macrófagos parece assim ter uma importante função de barreira na articulação. (Fig. 3). A estabilização desta barreira, por exemplo com o imatinibe, que estabiliza as junções estreitas na barreira hemato-encefálica e também teve um efeito positivo na ocorrência de artrite em ratos neste estudo, poderia, portanto, ser também uma nova abordagem terapêutica para os pacientes de AR.
Outro estudo centrou-se intensivamente nas populações de macrófagos na articulação. Aqui, o tecido sinovial de pacientes com AR em remissão clínica foi comparado com pacientes com AR activa [5]. Mais uma vez, foi encontrada uma variedade de diferentes populações de macrófagos no tecido sinovial. Em pacientes com AR activa, foram encontradas populações de macrófagos chamados MerTK-negativos, que exibiam um perfil de expressão pró-inflamatório. Nos doentes RA em remissão, especialmente os macrófagos positivos MerTK, que podem exprimir adicionalmente TREM2, foram altamente enriquecidos. Estes macrófagos MerTK positivos encontrados no revestimento sinovial são provavelmente os macrófagos de barreira TREM2 positivos no revestimento já descrito no estudo acima mencionado em ratos e em doentes com AIO. Em experiências de co-cultura com macrófagos e fibroblastos sinoviais positivos MerTK, foi demonstrado que os fibroblastos produziram menos factores pró-inflamatórios e destruidores das articulações devido à presença destes macrófagos [5]. Pelo contrário, os fibroblastos sinoviais foram capazes de influenciar a expressão deste fenótipo anti-inflamatório de macrófagos. Portanto, parece haver uma estreita interacção entre fibroblastos e macrófagos no sinovium, que podem influenciar e moldar-se mutuamente nas diferentes fases da AR. No futuro, seria interessante ver se a presença de macrófagos positivos MerTK no sinovium é um biomarcador de prognóstico para uma maior probabilidade de remissão sem drogas, e se seria possível começar cedo a reduzir a terapia nestes pacientes sem correr o risco de uma recaída da doença.
Previsão de recaídas de doenças em doentes com AR
O prognóstico das recaídas em doentes com AR foi objecto de um estudo publicado no New England Journal of Medicine [6]. Aqui, uma gota de sangue foi retirada semanalmente da ponta dos dedos de 4 pacientes durante um período de 1 a 4 anos e foram feitas medições mensais da actividade da doença. O sangue destas gotas de sangue foi sequenciado para encontrar um padrão de expressão genética antes ou durante um episódio de doença. De facto, puderam ser identificados dois grupos de genes que eram sempre mensuráveis no sangue antes de uma recaída. Com base nos genes que eram regulados nestes aglomerados, era possível adivinhar que um provavelmente provinha de células imunitárias. O outro, no entanto, assemelhava-se mais a um perfil conhecido dos fibroblastos sinoviais. Foi possível isolar estas “células mesenquimais pré-inflamatórias” (PRIME) do sangue em doentes adicionais de AR e mostrar que estas células PRIME são de facto a população celular que produz a assinatura genética que procuramos. Estes dados podem, portanto, significar que antes de uma recaída, células mesenquimais, por exemplo fibroblastos sinoviais das articulações, vazam para o sangue, e este processo é um prenúncio da recaída ou desencadeia a recaída. No entanto, a origem e o papel destas células na AR é ainda completamente obscura e será certamente abordada em futuros estudos.
Novos conhecimentos sobre o desenvolvimento do Lúpus eritematoso sistémico (LES)
Sabe-se há algum tempo que uma subpopulação especial de granulócitos denominada granulócitos de baixa densidade (LDG) está presente no sangue dos doentes com LES e sugeriu-se que estes desempenham um papel no desenvolvimento da assinatura de interferão no LES. Numa nova análise, poder-se-ia agora demonstrar que os monócitos, por um lado, e estes LDGs, por outro, são de facto responsáveis pela elevada produção de genes de resposta de interferão em doentes com LES [7]. Além disso, o estudo conseguiu demonstrar com a ajuda de análises de células únicas que esta subpopulação LDG também pode ser novamente subdividida e que estes diferentes fenótipos se correlacionam com diferentes parâmetros clínicos. Em particular, foram distinguidos dois subtipos de LDG, os que são CD10-positivos e os que são CD10-negativos. Uma vez que o CD10 é um marcador de maturação para granulócitos neutrófilos, os LDGs CD10-negativos são provavelmente um precursor imaturo. Estes granulócitos neutrófilos imaturos não conseguiram fazer armadilhas extracelulares nucleares (NET) in vitro, mostraram menos actividade quimiotática e fagocitótica do que os granulócitos CD10 positivos, mas produziram mais mieloperoxidase, indicando uma maior capacidade de desgranulação. Consequentemente, especialmente o CD10-positivo, LDG maduro correlacionado com parâmetros clínicos, tais como danos de órgãos e taxa de filtração glomerular. Isto sugere que as próprias funções que os LDGs CD10-positivos maduros desempenham, tais como a formação de redes, quimiotaxia e fagocitose, desempenham um papel na patogénese destes sintomas.
Um grupo de investigadores de Bethesda, EUA [8] apresentou uma nova abordagem para clarificar como esta formação da NET poderia ser desencadeada no LES. Este grupo foi capaz de mostrar que os canais aniónicos dependentes de tensão (VDAC) oligomerizam e, estabilizados por ADN mitocondrial livre, formam um canal na membrana mitocondrial a partir do qual o ADN mitocondrial pode sair para o citoplasma. Este ADN mitocondrial desencadeou uma resposta de interferão no citoplasma, por um lado, e levou à formação de uma rede nos LDGs já mencionados acima, por outro. Em células sanguíneas de doentes com LES, estes canais mitocondriais foram encontrados com maior abundância e num modelo de lúpus de rato, bloqueando a formação deste canal nas mitocôndrias resultou em menos ADN mitocondrial no citoplasma, menos produção de interferon, menos formação de NET e melhores parâmetros clínicos. A formação de NET também poderia ser reduzida em granulócitos de doentes com LES com este tratamento. O bloqueio desta proteína de canal poderia, portanto, ser uma abordagem nova e promissora na terapia do LES.
A análise de células B permite obter conhecimentos sobre o desenvolvimento de doenças imuno-mediadas
As novas tecnologias também ajudaram a analisar em detalhe as células B e os seus receptores em diferentes doenças imuno-mediadas [9]. Células B de doentes com vasculite associada à ANCA (AAV), SLE, Mb. Crohn’s, Mb. Doença de Behçet, granulomatose eosinofílica com poliangite (EGPA, antiga síndrome de Churg-Strauss) e vasculite de IgA. O estudo analisou os isótipos, os genes do locus IGHV, ou seja, a cadeia pesada do receptor de células B, e a clonalidade do repertório de células B e descobriu algumas coisas interessantes. Os anticorpos IgA estavam sobre-representados em todas as doenças estudadas excepto AAV e EGPA. Uma vez que a secreção IgA é estimulada principalmente através do sistema imunitário da mucosa, por exemplo, no intestino, era de esperar que em doentes com Mb. Crohn’s, o conteúdo de IgA é elevado. No entanto, foi surpreendente que níveis muito elevados de IgA também tenham sido medidos em doentes com LES. Isto poderia também indicar a estimulação da mucosa, por exemplo, no intestino, no LES. A análise dos genes que codificam a região variável da cadeia pesada da imunoglobulina revelou também diferenças interessantes. A expressão dos genes IGHV6 e IGHV4 era particularmente elevada em SLE, EGPA e Mb. Crohn está a aumentar. Estes genes foram anteriormente ligados à auto-reactividade. A alta expressão dos genes IGHV1 nas células B de pacientes com Mb. Behçet, uma vez que a sobreprodução destes genes está principalmente associada a infecções. Isto apoia a hipótese de que a infecção pode preceder o início da Mb. Behçet poderia estar subjacente. A investigação da clonalidade das células B nas diferentes doenças mostrou que em doentes com LES e Mb. Crohn’s, a expansão dos clones, bem como a diversidade dos clones das células B, foi aumentada. Embora isto fosse de esperar, mostra inversamente que nas outras doenças, apesar da forte activação do sistema imunitário, a clonalidade das células B é normal. Além disso, este estudo também investigou mudanças no repertório de células B após a terapia, mostrando que diferentes tratamentos imunossupressores têm efeitos diferentes sobre o repertório de células B. O tratamento com micofenolato mofetil resultou num aumento da proporção de células B produtoras de IgM e IgD e, portanto, numa redução do número de células B que foram submetidas a uma mudança de isótipo. Em contraste, após a terapia rituximab, o número de células B circulantes diminuiu acentuadamente, mas as células B persistentes tinham sobretudo alterado o seu isótipo e expandido clonalmente. Em AAV, as células B produtoras de IgA foram predominantemente encontradas após rituximab, em SLE IgG1 ou IgG2.
Resumo
Em resumo, pode dizer-se que especialmente os métodos analíticos mais recentes com base numa única célula levaram a novos conhecimentos sobre a função de certos subtipos celulares em tecidos saudáveis, bem como doentes. Podemos assim diferenciar os processos patológicos nas várias doenças reumáticas de forma cada vez mais precisa, o que, esperamos, conduzirá também a novas terapias para as doenças individuais no futuro. Na reumatologia em particular, o passo da investigação básica para novos métodos de tratamento já foi dado muitas vezes com sucesso.
Mensagens Take-Home
- Biópsias sinoviais guiadas por ultra-sons e análises unicelulares tornaram-se uma parte importante da investigação translacional.
- A inibição do entalhe farmacológico e a estabilização das junções estanques de macrófagos no revestimento sinovial são novos alvos terapêuticos para a AR.
- A formação e produção de genes de interferão no LES por um subtipo específico de granulócitos neutrófilos correlaciona-se com sintomas clínicos.
- A inibição da formação de canais de membrana mitocondrial é um novo alvo terapêutico no LES.
Literatura:
- Zhang F, et al: Definição dos estados celulares inflamatórios na artrite reumatóide dos tecidos sinoviais das articulações integrando a transcriptómica de uma única célula e a citometria de massa. Nat Immunol 2019; 20: 928-942.
- Wei K, et al: Notch signalling drives synovial fibroblast identity and arthritis pathology. Natureza 2020; 582: 259-264.
- Croft AP, et al: Os subconjuntos distintos de fibroblastos provocam inflamação e danos na artrite. Natureza 2019; 570: 246-251.
- Culemann S, et al: Macrófagos sinoviais residentes localmente renovados proporcionam uma barreira protectora para a articulação. Natureza 2019; 572: 670-675.
- Alivernini S, et al: Subgrupos distintos de macrófagos de tecido sinovial regulam a inflamação e a remissão na artrite reumatóide. Nat Med 2020; 26: 1295-1306.
- Orange DE, et al: Identificação de Três Subtipos de Doenças da Artrite Reumatóide por Integração de Características Histológicas Sinoviais e Dados de Sequenciação de RNA. Artrite Rheumatol 2018; 70: 690-701.
- Mistry P, et al: As análises transcriptómicas, epigenéticas e funcionais implicam a diversidade neutrofílica na patogénese do lúpus eritematoso sistémico. Proc Natl Acad Sci USA 2019; 116: 25222-25228.
- Kim J, et al: Os oligómeros VDAC formam poros mitocondriais para libertar fragmentos de mtDNA e promover doença tipo lúpus. Ciência 2019; 366: 1531-1536.
- Bashford-Rogers RJM, et al: Análise do repertório de receptores de células B em seis doenças imuno-mediadas. Natureza 2019; 574: 122-126.
InFo DOR & GERIATURA 2021; 3(1): 6-9