Existem 400 milhões de portadores de DPOC em todo o mundo. É a quarta principal causa de mortalidade global. Na actualização da Medicina Interna Refresher 2017 em Zurique, foram apresentadas as últimas descobertas para o diagnóstico e terapia baseados em provas.
Existem 400 milhões de portadores de DPOC em todo o mundo. É a quarta causa principal de mortalidade global [1]. Há 300 000 pessoas afectadas na Suíça, com uma prevalência de 2,5% em crianças dos 30-39 anos e 8% em crianças dos 70 anos >. Para além do tabagismo, os factores de risco incluem a exposição a partículas de pó (por exemplo, na agricultura) e a exposição a partículas de fumo provenientes de aquecedores a lenha. Para o tratamento mais específico possível, adaptado às necessidades individuais, as orientações diagnósticas e terapêuticas foram adaptadas ao estado actual da investigação. A importância dos broncodilatadores (LAMA = anticolinérgicos de acção prolongada/LABA = agonistas de acção prolongada β-2) aumentou consideravelmente nos últimos anos, enquanto que os esteróides inalados (ICS) são utilizados com menos frequência do que anteriormente, informou o Prof. Robert Thurnheer, MD, Chefe de Diagnóstico Médico do Hospital Cantonal de Münsterlingen.
Fenotipagem de acordo com a Iniciativa Global para a Doença Pulmonar Obstrutiva Crónica (GOLD)
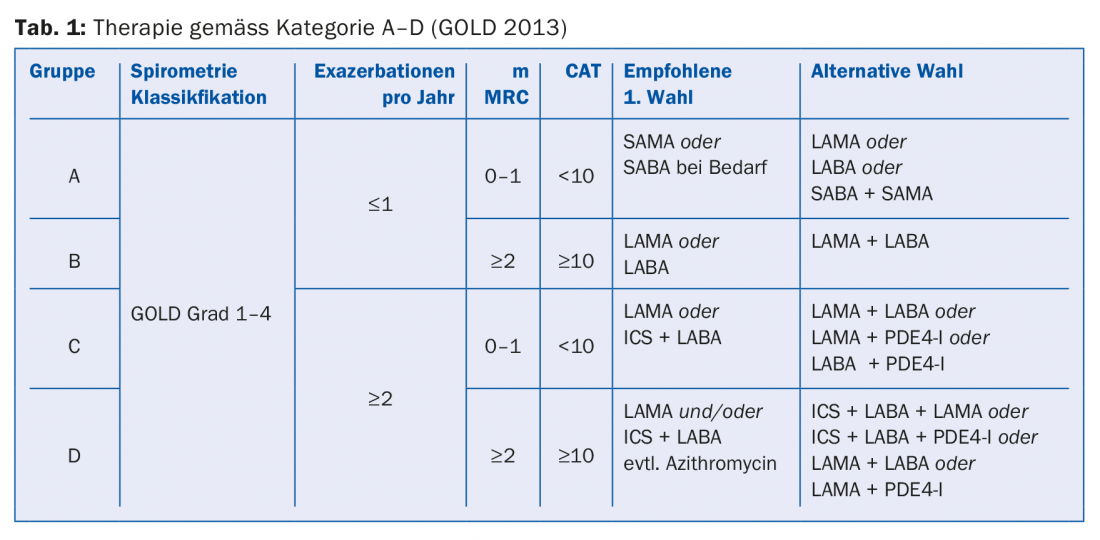
A classificação actualmente válida A-D (tab. 1) já não se baseia na função pulmonar mas sim nos sintomas e no risco de exacerbação e serve de base para uma terapia baseada em provas. Os questionários “CAT” (COPD Assessment Test) e “mMRC” (Dyspnoea Screening) são utilizados como instrumentos de diagnóstico. Para pacientes do grupo A (poucos sintomas, sem exacerbações), pode ser utilizado um broncodilatador (LABA ou LAMA). Nos doentes do grupo B (sintomas mas sem exacerbações), deve também ser utilizado um broncodilatador. Se os sintomas persistirem, mudar para uma preparação combinada (Anoro® ou Spiolto® ou Ultibro®). Se as exacerbações forem mais frequentes, recomenda-se a combinação com um esteróide inalado (ICS) de acordo com as directrizes GOLD. Nos doentes do grupo C (exacerbações), a primeira escolha é a monoterapia com LAMA. Se as exacerbações continuarem, mudar para a terapia combinada: LABA e LAMA ou LABA e ICS. A terapia do grupo D também pode ser realizada de acordo com um esquema graduado (Tab. 1), em que o Professor Thurnheer aconselhou cautela quanto ao uso profilático de macrolídeos devido a riscos de efeitos secundários (por exemplo, perda auditiva neurossensorial, síndromes de QT longo, resistências, falta de dados a longo prazo).
Broncodilatação: Qual é o benefício terapêutico e como conseguir os melhores efeitos?
Em resumo, os seguintes argumentos apoiam a eficácia da broncodilatação (LAMA, LABA): melhoria da função pulmonar [2], diminuição da hiperinflação [3], melhoria dos sintomas [4], diminuição da taxa de exacerbação [4]. Para os grupos A e B, não importa se a LABA ou a LAMA são utilizadas primeiro. Para os grupos C e D, recomenda-se utilizar primeiro o LAMA. No estudo POET, LAMA (Spiriva®) foi superior ao salmeterol (Serevent®) na prevenção de exacerbações [5].
De acordo com novas descobertas, o início da terapia o mais cedo possível (ou seja, na fase funcional pulmonar 2 = meta FEV1 50-80%) tem um efeito positivo; por exemplo, estudos demonstraram que o uso do tiotropio (Spiriva®) a diminuição do VEF1 (Volume Expiratório Forçado no primeiro segundo da exalação) após dois anos é menos pronunciada do que na condição de placebo [6] e os pacientes são também menos afectados pela “hiperinflação” (sobreinflação dinâmica) numa fase precoce durante o exercício.
Vários estudos clínicos [7,8] mostraram que os preparados combinados de LAMA e LABA (Anoro®, Spiolto®, Ultibro®) são superiores à monoterapia (LAMA ou LABA) no que diz respeito aos seguintes alvos: melhor função pulmonar, menos sintomas, redução da taxa de exacerbação. No estudo SPARK, por exemplo, foi demonstrado que Ultibro® conseguia melhores efeitos do que os respectivos agentes individuais [7]. O uso de um medicamento combinado é recomendado principalmente para pacientes com DPOC com resposta insuficiente à monoterapia de baixa dose com LAMA ou LABA [9] e para pacientes com sintomas graves de DPOC e dispneia [10,11].
De acordo com o compêndio, a monoterapia deve ser sempre utilizada em primeiro lugar e uma preparação combinada só deve ser utilizada se houver falta de efeito, mas de acordo com as directrizes, o tratamento primário com uma preparação combinada também é permitido. Além da eficácia, a manipulação pode também desempenhar um papel na decisão sobre qual das três preparações combinadas (Anoro®, Ultibro®, Spiolto®) é utilizada.
Corticosteróides inalados (ICS): controvérsia sobre o benefício terapêutico
Ao contrário da asma, onde os esteróides inalados (ICS) são o tratamento básico, o uso de ICS na DPOC é controverso.
No estudo da FLAME [12], os broncodilatadores combinados (LABA+LAMA) conseguiram uma redução significativamente maior das exacerbações em comparação com a LABA+ICS. No estudo da WISDOM [8], a omissão da ICS não aumentou a frequência das exacerbações, embora os pacientes sem ICS tenham apresentado um agravamento nos valores de VEF1 a longo prazo [8]. Num subgrupo de doentes com DPOC com eosinofilia (>2% de eosinofilia sanguínea) e aumento do risco de exacerbação, a ICS reduziu a taxa de exacerbação [13,14]. Segundo o estudo SUMMIT (n=16 485, 43 países), a utilização de SCI em pacientes com DPOC com risco cardiovascular aumentado não reduziu a mortalidade, mas reduziu ligeiramente a taxa de declínio da função pulmonar [15].
Os efeitos da utilização combinada de broncodilatadores e ICS (“triple therapy”) podem ser resumidos da seguinte forma, de acordo com a investigação actual [16]: nenhum efeito sobre a mortalidade e pontos terminais cardiovasculares, quase nenhum efeito sobre a função pulmonar, alguma redução de exacerbação [17,18], mas significativamente mais pneumonias (efeito secundário da ICS).
Terapia de DPOC avançada: “Traços tratáveis” e medidas comportamentais
A preparação Prolastin® pode ser utilizada como substituto no caso de uma deficiência de α-1-antitripsina (inibidor de protease), em que até agora só foram demonstrados efeitos positivos para critérios estruturais pulmonares. Daxas® (ingrediente activo: roflumilast) leva a uma ligeira melhoria da função pulmonar e a uma ligeira diminuição significativa da taxa de exacerbações, embora também possam ocorrer efeitos secundários: Perda de peso, aumento do risco de distúrbios do sono, alterações de humor [19]. O Mepolizumab (por exemplo, Nucala®) já é utilizado com sucesso para asmáticos com eosinofilia e também podem ser alcançados efeitos positivos na DPOC e eosinofilia no que diz respeito à redução da taxa de exacerbação, embora a preparação ainda não esteja aprovada para pacientes com DPOC para esta indicação [20].
Relativamente à oxigenoterapia na hipoxemia grave, o Professor Thurnheer mencionou que uma vantagem de sobrevivência só se torna significativa após cerca de quatro anos de terapia e que não foram demonstrados efeitos apenas com uma ligeira hipoxemia no que respeita à qualidade de vida subjectiva, risco de hospitalização e exacerbação [21].
No que respeita a medidas médicas comportamentais, a fisioterapia e o aconselhamento nutricional (frequentemente desnutrição calórica devido a enfisema e desperdício muscular) revelaram-se eficazes, para além do apoio à cessação do tabagismo. Em caso de exacerbações, recomenda-se a criação de um plano de acção. Por exemplo, esteróides sistémicos (cinco doses diárias de 40 mg cada) [22] devem ser tomados durante as viagens e os antibióticos (por exemplo, co-amoxicilina, tetraciclina, etc.) devem ser mantidos em reserva em caso de sintomas brônquicos. Outras medidas mencionadas são o controlo da técnica de inalação, a vacinação anual contra a gripe e a vacinação única pneumocócica (Prevenar-13® em crianças).
Fonte: Actualização de Medicina Interna Refresher, 5-9 Dezembro 2017, Zurique
Literatura:
- Bridevaux P-O, et al: Prevalência de obstrução do fluxo de ar em fumadores e nunca-fumadores na Suíça. Revista Respiratória Europeia 2010; 36: 1259-1269.
- Tashkin DP, et al: Bronchodilator responsividade em pacientes com DPOC. Jornal Respiratório Europeu 2008; 31: 742-750.
- Dellaca RL, et al: Efeito da broncodilatação na limitação do fluxo expiratório e na mecânica pulmonar em repouso no COPD. Revista Respiratória Europeia 2009; 33: 1329-1337.
- Jones PW, et al: Correlating changes in lung function with patient outcomes in chronic obstructive pulmonary disease: a pooled analysis. Respir Res 2011; 12: 161.
- Vogelmeier C, et al: Tiotropium versus salmeterol para a prevenção de exacerbações da COPD (POET). N Engl J Med 2011; 364: 1093-1103.
- Zhou Y, et al: Tiotropium em Doença Pulmonar Obstrutiva Crónica em Estágio Inicial. N Engl J Med 2017; 377: 923-935.
- Wedzicha JA, et al: Análise de exacerbações de doenças pulmonares obstrutivas crónicas com o duplo broncodilatador QVA149 em comparação com glicopirrónio e tiotrópio (SPARK): um estudo aleatório, duplo-cego, em grupo paralelo. Lancet Respir Med 2013; 1: 199-209.
- Magnussen H, et al: Retirada de glucocorticoides inalados e exacerbações da DPOC. N Eng J Med 2014; 371: 1285-1294.
- Donohue JF, et al: Eficácia e segurança de umeclidínio/vilanterol 62,5/25 mcg no COPD. Respir Med 2013; 107(10): 1538-1546.
- Kessler R, et al: Variabilidade dos sintomas em pacientes com DPOC grave; um estudo pan-europeu de corte transversal. Eur Respir J 2011; 37: 264-272.
- Price D, et al: Impact of night-time symptoms in COPD, um estudo do mundo real em cinco países europeus. Int J Chron Obstruct Pulmon Dis 2013; 8: 595-603.
- Wedzicha JA, et al: Indacaterol-glycopyrronium versus salmeterol-fluticasone para COPD. N Engl J Med 2016; 374(23): 2222-2234.
- Vedel-Krogh S, et al: Eosinófilos sanguíneos e Exacerbações na Doença Pulmonar Obstrutiva Crónica. O Estudo Geral da População de Copenhaga. AJRCCM 2016; 93(9): 965-974.
- Pascoe S, et al: Contagem de eosinófilos sanguíneos, exacerbações, e resposta à adição de furoato de fluticasona inalado ao vilanterol em doentes com doença pulmonar obstrutiva crónica: uma análise secundária dos dados de dois ensaios controlados aleatorizados paralelos. Lancet Respir Med 2015; 3: 435-442.
- Vestbo J, et al: Fluticasone furoate e vilanterol e sobrevivência em doença pulmonar obstrutiva crónica com risco cardiovascular aumentado (SUMMIT): um ensaio aleatório controlado duplo-cego. Lancet 2016; 387: 1817-1826.
- Vogelmeier CF, et al: Global Strategy for the Diagnosis, Management and Prevention of Chronic and Obstructive Lung Disease 2017 Report : GOLD Executive Summary. Eur Respir J 2017; 49: 1700214.
- Vestbo J, et al: Terapia de inalação única extrafina tripla versus terapia antagonista muscarínica de acção prolongada para doença pulmonar obstrutiva crónica (TRINITY). Lancet 2017; 389: 1919-1929.
- Singh D, et al: Terapia de inalação única tripla versus corticosteróide inalado mais terapia de acção prolongada β2-agonista para doença pulmonar obstrutiva crónica (TRILOGIA): um grupo duplo cego, paralelo, ensaio controlado aleatório. Lancet 2016; 388: 936-973.
- Chong J, Leung B, Poole P, Black PN: Inibidores da fosfodiesterase 4 para doença pulmonar obstrutiva crónica. Cochrane Database Syst Rev 2011; (5): CD002309.
- Pavord ID, et al: Mepolizumab para Doença Pulmonar Crónica Obstrutiva Eosinófila. N Engl J Med 2017; 377: 1613-1629.
- LTOT Trial Research Group: A Randomized Trial of Long-Term Oxygen for COPD with Moderate Desaturation. N Engl J Med 2016; 375(17): 1617-1627.
- Leuppi JD, et al: terapia de curto prazo versus terapia convencional com glucocorticóides em exacerbações agudas de doença pulmonar obstrutiva crónica: o ensaio clínico aleatório REDUCE. JAMA 2013; 309(21):2223-2231.
PRÁTICA DO GP 2018; 13(1): 41-43











