A artrite psoriásica (PsA) coloca um grande fardo sobre os doentes e muitos deles não respondem de forma satisfatória aos tratamentos disponíveis até à data [2]. Agora os doentes com psA moderada a grave podem beneficiar de uma opção adicional de terapia biológica eficaz e tolerável [1].
Dos 1 a 3% de pessoas que sofrem de psoríase na Suíça, cerca de uma em cada três é também afectada pela PsA [2, 3]. As manifestações clínicas típicas da doença inflamatória sistémica crónica incluem artrite, entesite, dactilite, queixas axiais, e psoríase cutânea e das unhas [4]. Se a PsA progredir sem controlo, pode levar à destruição das articulações e consequente incapacidade e aumento do risco de mortalidade. As doenças concomitantes frequentes, tais como doenças cardiovasculares, síndrome metabólica, obesidade, diabetes ou perturbações psiquiátricas, prejudicam ainda mais a funcionalidade física e a qualidade de vida das pessoas afectadas [2]. Desde 17 de Março de 2022, o risankizumab (Skyrizi®) oferece uma opção terapêutica adicional [1].
Indicação de expansão do risankizumab [1]
Quase três anos após a sua aprovação na psoríase em placa moderada a grave em Abril de 2019, o risankizumab (150 mg) pode agora ser utilizado como monoterapia ou em combinação com medicamentos anti-reumáticos modificadores de doenças não-biológicas (DMARD) para tratar adultos com psoríase activa que tiveram uma resposta inadequada ou são intolerantes a um ou mais DMARD [1, 5]. O inibidor selectivo de IL-23 caracteriza-se, entre outras coisas, por um intervalo de tratamento de 3 meses amigável ao paciente após 2 injecções iniciais em semanas 0 e 4 [1, 6]. A sua eficácia a longo prazo e o seu perfil de segurança benéfico e estável na psoríase têm sido demonstrados em vários estudos da fase III [6-9]. Os resultados dos estudos aleatórios, controlados por placebo, fase III KEEPsAKE 1 e 2 [2, 4] mostram que o risankizumab também pode influenciar positivamente o curso da doença em doentes com PsA activa.
Eficácia comprovada e boa tolerabilidade em PsA [2, 4]
Em KEEPsAKE 1 e 2, um total de 1408 doentes adultos com psA com resposta inadequada ou intolerância aos DMARD (cs) sintéticos convencionais (KEEPsAKE 1) e/ou biológicos (b) DMARDs (KEEPsAKE 2) aleatorizado a 24 semanas de tratamento duplo-cego com risankizumab (150 mg) ou placebo. Na subsequente extensão do rótulo aberto (OLE), todos os doentes receberam risankizumab. Após 24 semanas, um número significativamente maior de pacientes atingiu o ponto final primário de uma resposta de 20% de acordo com os critérios do American College of Rheumatology (ACR 20) com risankizumab do que com placebo em ambos os estudos(tabela). Foram também alcançados resultados significativamente melhores no braço risankizumab em termos de resposta ACR 50 e ACR 70 e melhoria na entesite, dactilites, fadiga e funcionalidade física [2, 4]. De acordo com os últimos dados apresentados no Congresso EADV de 2021, a eficácia do risankizumab em OLE continuou a aumentar numericamente. Por exemplo, a taxa de resposta ACR 20 em pacientes tratados continuamente com risankizumab às 52 semanas foi de 70,0% em KEEPsAKE 1 e 58,5% em KEEPsAKE 2, que também incluiu pacientes com resposta inadequada a bDMARDs anteriores [10]. Em geral, o risankizumab foi bem tolerado e o perfil de segurança foi comparável ao observado em doentes com psoríase [2, 4].
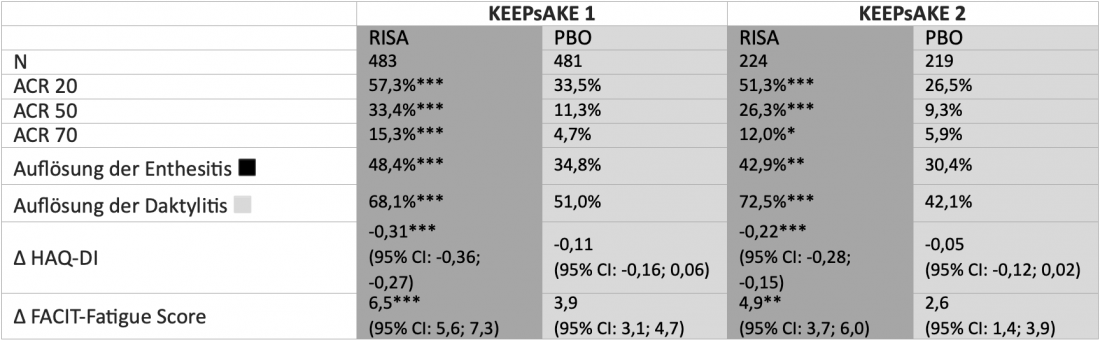
Tabela: Resposta de pacientes com artrite psoriásica activa que tomam RISA após 24 semanas nos ensaios KEEPsAKE 1 e 2 fase III controlados por PBO e aleatorizados. Os pacientes em KEEPsAKE 1 tinham anteriormente respondido de forma inadequada ou não tolerada ≥ 1 csDMARDs. Os pacientes no KEEPsAKE 2 tinham anteriormente respondido inadequadamente ou não tinham tolerado ≤ 2 bDMARDs e/ou ≥ 1 csDMARD. Imputação de não-resposta (NRI) com imputações múltiplas se faltarem dados devido à COVID-19, ou NRI se não faltarem dados devido à COVID-19. *p<0,05; **p<0,01; ***p< 0,001.
◾ Definido como Leeds Enthesitis Index (LEI)=0 em doentes com LEI>0 na linha de base . ◽ Definido como Índice de Dactilites de Leeds (LDI)=0 em pacientes com LDI>0 na linha de base. RISA: 150 mg risankizumab nas semanas 0, 4 e 16; PBO: placebo; ACR 20/50/70: melhoria de 20/50/70% nos critérios do American College of Rheumatology; HAQ-DI: Questionário de Avaliação de Saúde – Índice de Deficiência; FACIT-Fatiga: Avaliação Funcional do Questionário de Fadiga Terapêutica de Doenças Crónicas. Adaptado de [2, 4]
Conclusão
A expansão da indicação de risankizumab em Março de 2022 permite agora aos pacientes adultos com PsA activo beneficiarem desta opção de tratamento eficaz a longo prazo com um perfil de segurança estável e de uso amigável para o paciente [1, 6]. Como os resultados do KEEPsAKE 1 e 2 mostram, o tratamento com o inibidor da IL-23 pode aliviar significativamente os sintomas associados à PsA [2, 4].
Literatura
As referências podem ser solicitadas por profissionais em medinfo.ch@abbvie.com.
Com o apoio financeiro da AbbVie AG, Alte Steinhauserstrasse 14, 6330 Cham.
Breve informação técnica Skyrizi®
CH-SKZD-220042_03/2022