Os carcinomas brônquicos são a causa mais comum de mortes relacionadas com o cancro em todo o mundo. Com o desenvolvimento dos inibidores do ponto de controlo imunitário, o panorama terapêutico mudou significativamente.
O diagnóstico e terapia do carcinoma brônquico é um campo em rápida mutação e de considerável interesse clínico devido à elevada incidência e mortalidade destes tumores em todo o mundo. O rápido aumento dos conhecimentos em biologia molecular e imunologia e os avanços no diagnóstico molecular são factores impulsionadores no desenvolvimento do tratamento personalizado de tumores (“medicina de precisão”). Este desenvolvimento está longe de estar completo.
Neste artigo, concentramo-nos nas inovações actuais no tratamento do carcinoma brônquico com ênfase na terapia de sistemas de fases avançadas do tumor na primeira linha de terapia. Estas são abordagens de tratamento que estamos actualmente a seguir na nossa instituição. Não fazemos nenhuma reivindicação de completude ou validade absoluta.
Noções básicas
Em 2018, os carcinomas brônquicos tiveram a maior incidência (11,6%) e a maior mortalidade (18,4%) de todas as doenças tumorais a nível mundial – ao nível dos tumores mamários [1]. No período de 2011 a 2015, os carcinomas brônquicos estavam em terceiro lugar na Suíça em termos de incidência (aproximadamente 4300 novos casos por ano), e em primeiro lugar entre as causas de morte relacionadas com o cancro [2]. A taxa de sobrevivência relativa de 5 anos para o cancro do pulmão na Suíça foi de 15% para os homens e de 19% para as mulheres [3]. O tabagismo continua a ser a principal causa do cancro do pulmão [4]. Cerca de 20% dos carcinomas brônquicos ocorrem em “nunca fumadores” (<100 cigarros no total). A principal razão para isto é a exposição a substâncias nocivas inaladas (por exemplo, rádon, amianto, vapor de alcatrão) [5].
Carcinoma pulmonar de pequenas células
10-15% dos carcinomas brônquicos recentemente diagnosticados são cancros de pequenas células pulmonares (SCLC). A distinção entre doença limitada LD (fase I-III) e doença extensiva ED (fase IV) é relevante do ponto de vista terapêutico. Esta última é muito mais comum devido à biologia agressiva dos tumores. A mediana da sobrevivência global (OS) é de 15-20 meses para LD-SCLC e 8-13 meses para ED-SCLC [6]. A maioria dos SCLC têm mutações inactivadoras dos genes supressores do tumor TP53 e RB1, enquanto que as mutações “tratáveis” de tirosina kinases receptoras estão normalmente ausentes (em contraste com os carcinomas de pulmão de células não pequenas, NSCLC). As actuais normas terapêuticas dependentes do estádio podem ser resumidas como se segue:
Fase I: Para além da cirurgia, a quimioterapia adjuvante à base de platina proporciona um benefício OS na fase I (66,0 vs. 42,1 meses) [7].
Fase II, III: Cirurgia mais quimioterapia é uma opção na fase II; alternativamente, a cirurgia pode ser omitida e a radio-quimioterapia definitiva pode ser administrada. Este é também o tratamento de escolha na fase III e deve – se possível – ser efectuado simultaneamente [8,9].
Etapa IV: A terapia sistémica paliativa é o tratamento de escolha para ED-SCLC. Apesar de uma resposta inicialmente muito boa à terapia, a mediana de sobrevivência global é de apenas 10 meses. Os protocolos padrão são cisplatina e etoposida ou carboplatina e etoposida [10]. Os protocolos diferem principalmente em termos de efeitos secundários, menos em termos de efeitos tumorais [11]. A radiação do tumor residual torácico não é um padrão, mas uma opção individual em caso de resposta muito boa à quimioterapia, bem como a remissão completa das metástases extratorácicas [12].
O Atezolizumab, um inibidor programado de morte ligand 1 (PD-L1) (inibidor do ponto de controlo imunitário, ICI), combinado com quimioterapia e subsequentemente utilizado como terapia de manutenção, proporciona um benefício de sobrevivência na primeira linha de terapia em comparação com a quimioterapia isolada (12,3 vs. 10,3 meses, HR 0,7, 95% CI 0,54-0,91), como demonstrado no ensaio fase III IMpower133. [13]. O ensaio fase III CASPIAN com durvalumab e quimioterapia também foi positivo, como o fabricante relatou recentemente [14]. Assim, o ED-SCLC tem agora duas novas abordagens para a quimioterapia combinada, desde que os preparados ainda sejam aprovados pelas autoridades farmacêuticas para esta indicação.
A irradiação profiláctica do cérebro inteiro (ICP) é considerada “padrão” em muitas directrizes na fase II-IV, após uma boa resposta à quimioterapia [15,16]. Um estudo japonês questiona esta norma, no entanto, uma vez que não mostrou qualquer benefício de sobrevivência para a ICP em comparação com as ressonâncias magnéticas (MRI), apenas para a ressonância magnética do crânio [17]. Estes dados já parecem estar a conduzir a um afastamento parcial da norma anterior na prática clínica diária [18]. A influência da imunoterapia na indicação da ICP ainda não é clara.
Muitos pacientes com recaída ou progresso de SCLC dentro de 6-12 meses. A razão para tal é provavelmente a presença de “células estaminais cancerosas” resistentes à cisplatina [19]. O tratamento posterior depende do estado do doente, da extensão da recorrência do tumor, da terapia anterior e do intervalo sem tratamento [15–17]. Se houver uma situação refratária ou uma recaída resistente à platina, o topotecano é superior apenas aos cuidados de apoio [20] e equivalente à terapia múltipla (ciclofosfamida, doxorubicina e vincristina) em termos de taxa de resposta global (ORR), sobrevivência sem progressão (PFS) e SO, mas melhor tolerada [21]. A topoteca administrada por via intravenosa e peroral é aproximadamente equivalente em termos de eficácia e tolerabilidade [22]. Os doentes em bom estado geral (ECOG 0-2) com uma “recaída sensível à platina” podem ser tratados novamente com cisplatina/carboplatina e etoposídio [23].
Na nossa opinião, o uso de inibidores do ponto de controlo imunitário após falha da quimioterapia não é (ainda) padrão hoje em dia. Os melhores dados até agora são para pembrolizumab (para tumores PDL1-positivos) [24] e para nivolumab [25].
Cancro do pulmão de células não pequenas
O cancro do pulmão de células não pequenas (NSCLC, aproximadamente 85-90% de todos os carcinomas brônquicos) é um termo clínico colectivo para adenocarcinomas (50-60%), carcinomas escamosos de células (20-25%), carcinomas de células grandes, carcinomas adenosquâmicos, carcinomas neuroendócrinos (dos quais se exclui o carcinoma pulmonar de células pequenas) e carcinomas sarcomatóides.
Fase I/II: A terapia de escolha nas fases I e II é a cirurgia radical de acordo com padrões oncológicos (geralmente uma lobectomia com dissecção sistemática dos gânglios linfáticos mediastinais). A partir de um diâmetro do tumor de 4 cm, é indicada a quimioterapia adjuvante com 4 ciclos de uma combinação contendo platina. Se houver uma contra-indicação à cirurgia, a radiação estereotáxica é uma alternativa.
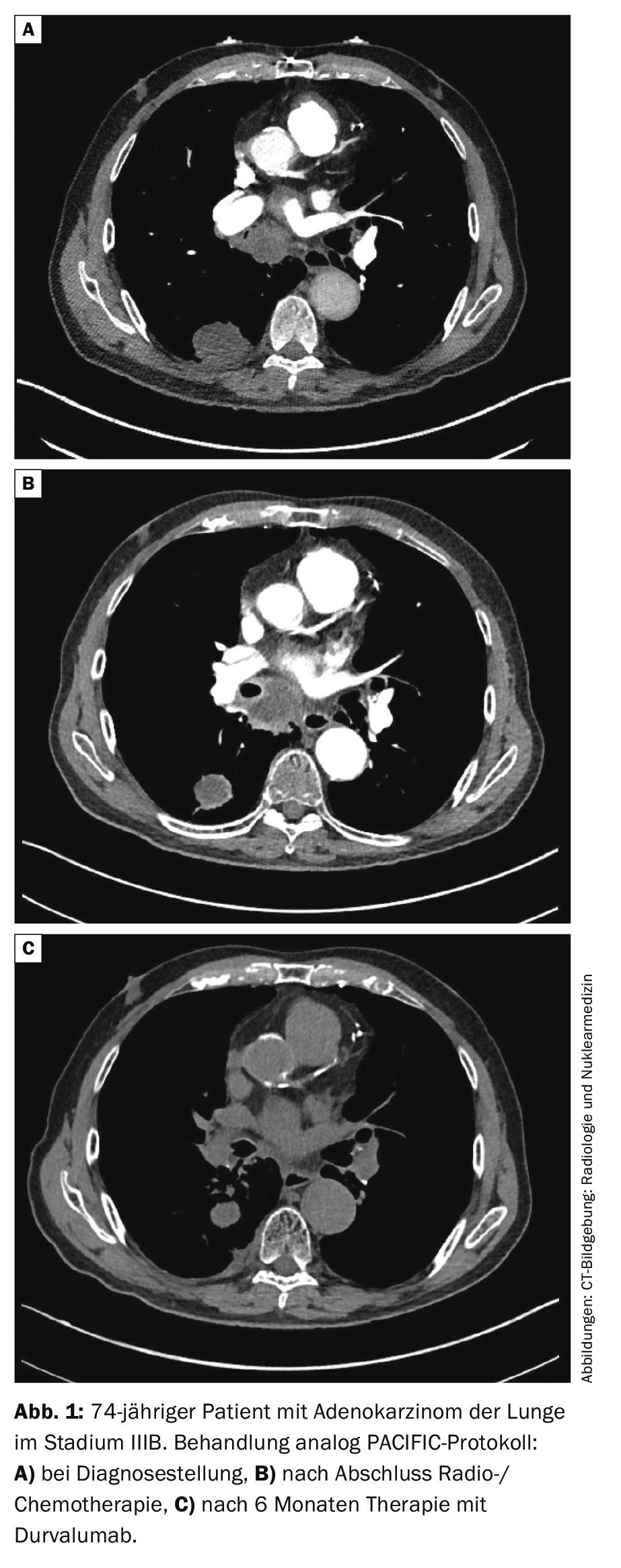
Fase III: Para tumores ressecáveis na fase III, a quimioterapia é indicada para além da cirurgia. Isto pode ser feito antes (neoadjuvant) ou depois (adjuvant) da cirurgia. O benefício de radioterapia adicional (“terapia trimodal”) é controverso. O ensaio suíço fase III SAKK16/00 foi negativo em relação à irradiação pré-operatória [26]. A radioterapia pós-operatória (PORT) não mostrou nenhum benefício claro numa meta-análise retrospectiva [27], os dados do ensaio LungART aleatório ainda estão pendentes. O NSCLC, fase III, não regenerável, é radio-quimioterapêutico seguido de um ano de imunoterapia “consolidadora” com o anticorpo PD-L1 durvalumab. A base é o estudo prospectivo da fase III aleatorizado PACIFIC [28, 29]. No estudo, a sobrevivência de 2 anos foi de 66,3% com durvalumab e 55,6% com placebo (HR 0,68, 99,73% CI 0,47-0,997, p=0,0025). O PFS mediano foi significativamente prolongado com durvalumab em comparação com placebo (17,2 versus 5,6 meses, HR 0,51, IC 95% 0,41-0,63, p<0,001). A consolidação com durvalumab é, portanto, considerada hoje como a norma (Fig. 1).
Fase IV: Para além das chamadas fases “oligometásticas”, onde a cirurgia e a radioterapia podem ser utilizadas com intenção curativa, a maioria das fases IV NSCLC é tratada com intenção puramente paliativa. É feita uma distinção entre quimioterapia, terapia orientada e imunoterapia. A escolha da terapia depende do subtipo histológico, da presença de mutações do condutor (em tumores não sequenciados) e da expressão PD-L1 do tumor. O trabalho patológico molecular é a base para uma terapia óptima (Fig. 2).
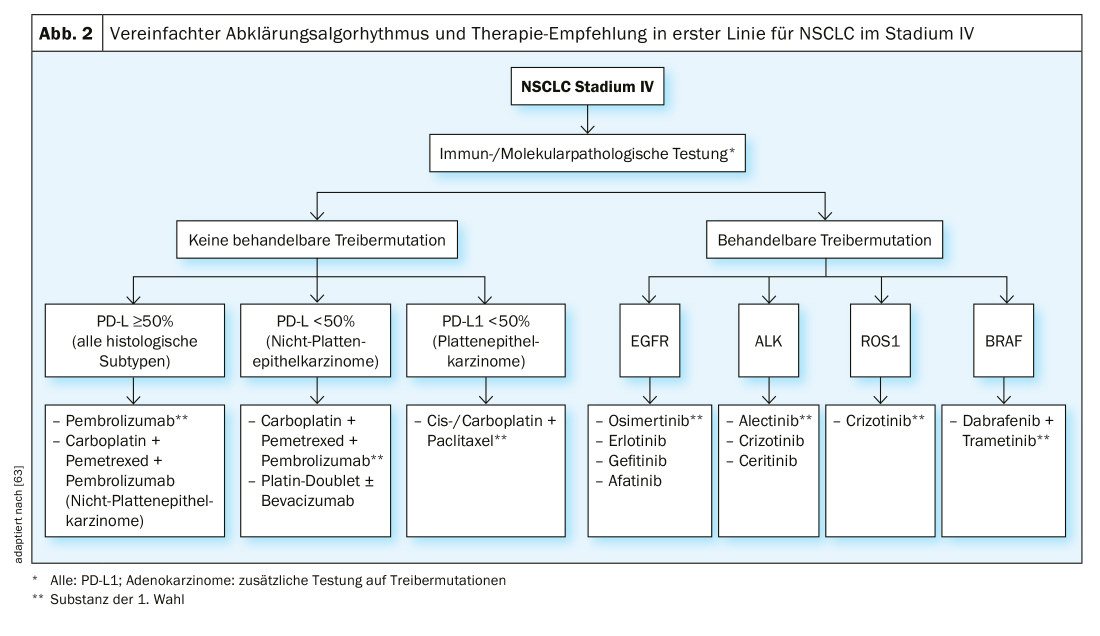
Se não houver “mutações de condutor” tratáveis, o tratamento é baseado principalmente no estatuto de expressão PD-L1. Para NSCLC (independentemente do subtipo histológico) com uma expressão PD-L1 de ≥50%, o tratamento com o inibidor pembrolizumab PD-L1 é superior à quimioterapia convencional em termos de SO e PFS de acordo com o estudo KEYNOTE 024 [30]. Para adenocarcinomas do pulmão com uma expressão PD-L1 de ≤ 50%, uma combinação de quimioterapia e pembrolizumabe é preferível à quimioterapia isolada, análoga ao estudo KEYNOTE 189 [31]. A taxa de resposta ao tratamento no estudo com a adição de pembrolizumab foi de 48%, sem pembrolizumab 19%. A taxa de sobrevivência de 12 meses foi de 69% para o pembrolizumab + quimioterapia e 49% apenas para o grupo de quimioterapia. Uma alternativa é o Atezolizumab anticorpo PD-L1 em combinação com carboplatina, paclitaxel e bevacizumab, com base nos resultados dos ensaios IMpower130 e -150 [32,33].
Para carcinomas de células escamosas com uma expressão PD-L1 de ≤50%, uma combinação de pembrolizumabe com quimioterapia está associada a um benefício OS e PFS de acordo com o estudo KEYNOTE 407 [34].
Se na primeira linha de terapia não foi utilizado nenhum inibidor do ponto de controlo imunitário, a sua utilização é indicada na segunda linha. O uso de nivolumab está associado a um benefício estatisticamente significativo ORR, OS e PFS em comparação com o docetaxel, independentemente da expressão PD-L1 nas células tumorais [35].
O tratamento de segunda linha com atezolizumabe foi comparado contra o docetaxel, e foi encontrado um benefício de SO a favor do atezolizumabe, independentemente da histologia do NSCLC [36,37]. Pembrolizumab foi estudado para tumores com expressão PD-L1 de pelo menos 1%, mostrando um benefício significativo de OS contra docetaxel [38]. O tratamento com inibidores do ponto de controlo imunitário deve ser dado desde que seja demonstrada uma resposta ou desde que o paciente tolere o tratamento sem efeitos secundários graves.
Mutações do condutor: Num número significativo de NSCLC, é encontrada uma mutação de um protooncogene para um oncogene, que codifica um receptor activador de tirosina quinase (RTK). Esta mutação provoca um aumento da proliferação celular, resistência à apoptose, angiogénese e metástase. Tais mutações são chamadas mutações de condutor. Estas são geralmente mutações somáticas e não mutações em linha germinal [39]. Estas descobertas levaram ao desenvolvimento de inibidores orais de tirosina cinase (TKIs), cujo efeito se baseia numa inibição mais ou menos selectiva da via de transdução de sinal correspondente. Tendo em conta a probabilidade de pré-teste, os testes para a presença de mutações são actualmente obrigatórios para o NSCLC não-químico da fase IV, mas não para o carcinoma espinocelular e o SCLC. Devido a restrições de tempo, testamos em duas etapas na nossa instituição. O primeiro passo inclui testes rápidos para EGFR, ALK, ROS1, KRAS e BRAF. Se negativo, testamos HER2, MET, RET, NTRK1-3 e outros marcadores num segundo passo. A seguir, discutimos o tratamento orientado da fase IV do NSCLC com as mutações clássicas do condutor.
EGFR: A activação das mutações do protooncogene “receptor do factor de crescimento epidérmico” (EGFR) encontra-se em 13-15% dos adenocarcinomas pulmonares na Europa Central, agrupados em não fumadores (prevalência superior a 50%, dependendo do estudo) [40]. Cerca de 90% dos casos são ou uma exon 19 eliminação ou uma exon 21 L858R mutação pontual [41]. A terapia padrão na primeira linha é um EGFR TKI. Esta terapia está associada a um benefício PFS estatisticamente significativo em comparação com a quimioterapia à base de platina [42]. Os TKIs disponíveis são gefitinib e erlotinib (primeira geração), afatinib e dacomtinib (segunda geração) e osimertinib (terceira geração). Com EGFR TKIs de primeira geração, a resistência ao tratamento ocorre em média após 10-14 meses, em 50-60% dos casos devido a uma segunda mutação EGFR (T790M) [43]. Osimertinib, um TKI com boa disponibilidade e eficácia do SNC na presença de uma mutação EGFR T790M, foi avaliado contra o gefitinib e o erlotinib no ensaio FLAURA. Os dados publicados em 2017 demonstraram um benefício PFS estatisticamente significativo a favor do osimertinibe (18,9 meses com osimertinibe versus 10,2 meses com gefitinibe e erlotinibe, respectivamente, (HR 0,46; 95% CI 0,37-0,57; p<0,001) [44]. Osimertinib tem demonstrado ser mais eficaz contra as metástases cerebrais e melhor tolerado. Os últimos dados do ensaio da FLAURA, que serão apresentados no Congresso Anual da OMPE de 2019 em Setembro, mostram pela primeira vez um benefício de sobrevivência estatisticamente significativo do osimertinib após [45]. Osimertinib irá assim estabelecer-se definitivamente como terapia de primeira linha para todos os pacientes com NSCLC alterado por EGFR, independentemente de T790M ou metástases cerebrais. A combinação de um EGFR TKI com quimioterapia principalmente em EGFR-mutated NSCLC não é actualmente considerada padrão, mas tem sido investigada em vários estudos. O ensaio japonês fase III NEJ009 comparou gefitinibe com gefitinib + quimioterapia (carboplatina e pemetrexa), mostrando um benefício PFS estatisticamente significativo (21 vs. 11 meses; HR 0,49, 95% CI 0,39-0,63) e benefício OS (52 vs. 39 meses; HR 0,70, 95% CI 0,52-0,93), mas acompanhado por uma taxa mais elevada de grau 3 Toxicidade (65% vs. 31%) [46]. Outros estudos (com erlotinibe e gefitinibe) confirmam estes resultados. A combinação do EGFR TKI erlotinibe com o anticorpo VEGFR bevacizumab produziu um PFS mas não um benefício OS em comparação com a monoterapia de erlotinibe [47].
ALK: Translocações do linfoma cinase anaplásico (ALK) proto-oncogene são encontradas em 3-5% dos adenocarcinomas pulmonares [48], novamente agrupados em não-fumadores [49]. Os ALK-TKIs disponíveis são crizotinibe, ceritinibe, alectinibe, brigatinibe e lorlatininibe. O agente de primeira linha de escolha é o alectinib, devido à sua boa mobilidade do SNC e superioridade ao crizotinib no estudo ALEX [50,51]. A escolha de ALK-TKIs em outras linhas depende em particular da disponibilidade, infestação cerebral e mutações de resistência [52].
ROS1: As translocações do ROS proto-oncogene 1 (ROS1) são encontradas em 1-2% dos adenocarcinomas pulmonares, também em não-fumadores. Devido à semelhança estrutural das kinases ALK e ROS1, muitos outros inibidores ALK além do alectinibe são também adequados para inibir a ROS1. O tratamento de tumores pulmonares mutantes ROS1 com crizotinibe é a terapia de escolha [53]. Lorlatinib mostrou uma eficácia muito boa num estudo de fase II, especialmente em casos de resistência ao crizotinibe [54]. Ceritinibe, entrectinibe e repotrectinibe são outros potentes inibidores da ROS1.
BRAF: A mutação pontual BRAF é encontrada em 1-2% dos adenocarcinomas pulmonares, tanto em fumadores como em não fumadores. Em cerca de dois terços dos casos, está presente uma mutação V600E típica e tratável. Aqui, um tratamento combinado com dabrafenib e trametinib é a terapia de escolha, tanto em pacientes ingénuos como em pacientes pré-tratados [55,56]. No entanto, NSCLC com BRAF V600E também responde à quimioterapia e imunoterapia. Para mutações BRAF que não a V600E, não é actualmente recomendada a terapia orientada fora dos ensaios.
KRAS: Se uma mutação activadora do proto-oncogene Kirsten ras (KRAS) estiver presente, estes NSCLC não eram anteriormente considerados como tratáveis especificamente e eram submetidos a quimioterapia-imunoterapia. O KRAS foi testado de qualquer forma porque um resultado positivo tornou supérflua a procura de mais mutações do condutor. Em 2019, os primeiros resultados de um ensaio clínico com o inibidor específico KRAS G12C AMG510 foram relatados [57]. Estes resultados são muito encorajadores e estão agora a ser abertos estudos de acompanhamento em muitos centros para o recrutamento de um grande número de pacientes. Outros inibidores do KRAS estão também em desenvolvimento.
RET: As translocações rearranjadas durante a transfecção (RET) são encontradas em cerca de 1-2% dos adenocarcinomas pulmonares. Os TKIs menos selectivos, como o cabozantinib, mostraram algum efeito, embora muito limitado no tempo [58]. Os inibidores altamente selectivos de RET, tais como LOXO-292 e BLU-667 representam, portanto, um grande avanço no tratamento de tumores pulmonares com mutação de RET. LOXO-292 está a ser estudado no ensaio LIBRETTO-001 (NCT03157128). Os resultados iniciais mostraram uma taxa de resposta de 65%, com muito boa tolerabilidade [59]. Novos dados serão apresentados no congresso anual da IASLC em Setembro de 2019. Os centros participantes incluem Lucerna (CH) e Colónia (DE). O inibidor RET BLU-667 está a ser estudado no ensaio ARROW (NCT03037385). A taxa de resposta pré-primária foi de 56% [60]. Os centros participantes incluem Heidelberg (DE).
NTRK: As fusões de um dos proto-oncogenes “receptor neurotrófico da timosina quinase 1-3” (NTRK 1-3) são encontradas em 1% do NSCLC. O larotrectinibe inibidor TRK (LOXO-101) mostrou até agora um ORR de 75% em ensaios da fase I-II com resposta sustentada e muito boa tolerabilidade [61]. Até agora aprovada nos EUA, a aprovação para a Europa e Suíça ainda está pendente. O Entrectinib (RXDX-101), outro inibidor TRK mostrou um ORR de 57% em tumores sólidos com fusão NTRK comprovada na análise combinada de três estudos fase I-II, também com muito boa tolerabilidade [62].
Conclusão
Os actuais desenvolvimentos em imunoterapia e terapia orientada mostram que o potencial destas abordagens no carcinoma brônquico está longe de estar esgotado. O benefício destas terapias em paliação é indiscutível e os ensaios clínicos estão também em curso na situação adjuvante. Independentemente disto, devem também ser feitos maiores esforços nas áreas da prevenção e detecção precoce, para que se possa conseguir uma diminuição dos carcinomas brônquicos (especialmente as fases metástases).
Mensagens Take-Home
- Os carcinomas brônquicos são a causa mais comum de mortes relacionadas com o cancro em todo o mundo e o tabagismo é a principal causa.
- O novo padrão de cuidados para o cancro do pulmão de pequenas células da fase IV (SCLC) é a combinação da quimioterapia (carboplatina e
- etoposida) com o inibidor do ponto de controlo imunitário atezolizumab.
- Os doentes com cancro de pulmão de fase III não pequeno (NSCLC) beneficiam da consolidação da imunoterapia com durvalumab após radio/chemoterapia definitiva.
- O teste de NSCLC em fase avançada não sequencial para a presença de mutações do condutor (EGFR, ALK, ROS1 e BRAF) e o nível de expressão PD-L1 está a orientar a escolha da terapia.
- NSCLC com mutações tratáveis são principalmente visados; o tratamento de NSCLC sem evidência de uma mutação de condutor tratável é principalmente baseado no estatuto de expressão PD-L1.
Literatura:
- Bray F, et al: Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin, 2018. 68(6): p. 394-424.
- www.bfs.admin.ch/bfs/de/home/statistiken/kataloge-datenbanken/tabellen.assetdetail.6466432.html.
- Arndt V: Swiss Cancer Report 2015: Status and Developments. 2016: Office féderal de la statistique (OFS).
- Forman D, et al: O fardo global e regional do cancro. Relatório mundial sobre o cancro, 2014. 2014: 16-53.
- Sun S, Schiller JH, Gazdar AF: Cancro do pulmão em nunca fumadores – uma doença diferente. Nat Rev Cancer, 2007. 7(10): 778-790.
- van Meerbeeck JP, Fennell DA, De Ruysscher DK: Cancro do pulmão de pequenas células. Lancet, 2011. 378(9804): 1741-1755.
- Yang CF, et al: Papel da terapia adjuvante numa coorte populacional de pacientes com cancro do pulmão de pequenas células em fase inicial. J Clin Oncol, 2016. 34(10): 1057-1064.
- Warde P, Payne D: A irradiação torácica melhora a sobrevivência e o controlo local no carcinoma de pequenas células do pulmão em fase limitada? Uma meta-análise. J Clin Oncol, 1992. 10(6): 890-895.
- Pignon JP, et al: A Meta-Análise da Radioterapia Torácica para o Cancro do Pulmão de Pequenas Células. New England Journal of Medicine, 1992. 327(23): 1618-1624.
- Mascaux C., et al.: Uma revisão sistemática do papel do etoposídio e da cisplatina na quimioterapia do cancro do pulmão de pequenas células com avaliação metodológica e meta-análise. Lung Cancer, 2000. 30(1): 23-36.
- Rossi A, et al: Quimioterapia baseada em carboplatina ou cisplatina no tratamento de primeira linha do cancro do pulmão de pequenas células: a meta-análise COCIS dos dados individuais do doente. J Clin Oncol, 2012. 30(14): 1692-1698.
- Slotman BJ, et al: Utilização de radioterapia torácica para cancro do pulmão de pequenas células em fase extensiva: um ensaio aleatório controlado de fase 3. Lancet, 2015. 385(9962): 36-42.
- Horn L, et al: atezolizumab de primeira linha mais quimioterapia no cancro do pulmão de pequenas células em fase extensiva. N Engl J Med, 2018. 379(23): 2220-2229.
- www.astrazeneca.com/media-centre/press-releases/2019/imfinzi-improves-overall-survival-at-interim-analysis-in-the-phase-iii-caspian-trial-in-1st-line-extensive-stage-small-cell-lung-cancer-27062019.html.
- Auperin A, et al: Irradiação craniana profiláctica para doentes com cancro do pulmão de pequenas células em remissão completa. Grupo Colaborativo de Irradiação Craniana Profiláctica. N Engl J Med, 1999. 341(7): 476-484.
- Slotman B, et al: Irradiação craniana profiláctica no cancro extensivo do pulmão de pequenas células. N Engl J Med, 2007. 357(7): 664-672.
- Takahashi T, et al: irradiação craniana profiláctica versus observação em doentes com cancro do pulmão de pequenas células de doença extensiva: um ensaio multicêntrico, aleatorizado, com rótulo aberto, fase 3. Lancet Oncol, 2017. 18(5): 663-671.
- Gjyshi O, et al: Evolving Practice Patterns in the Use of Prophylactic Cranial Irradiation for Extensive-Stage Small Cell Lung CancerProphylactic Cranial Cranial Irradiation for Extensive-Stage Small Cell Lung Cancer. JAMA Network Open, 2019. 2(8): e199135-e199135.
- Böttger F, et al.: A Heterogeneidade Tumoral está subjacente à Sensibilidade Cisplatina Diferencial em Modelos de Rato de Cancro do Pulmão de Pequenas Células. Relatórios celulares, 2019. 27(11): 3345-3358. e4.
- O’Brien ME, et al: Ensaio de Fase III comparando cuidados de apoio apenas com cuidados de apoio com topotecan oral em doentes com cancro do pulmão de pequenas células recaídas. J Clin Oncol, 2006. 24(34): 5441-5447.
- von Pawel J, et al: Topotecan versus ciclofosfamida, doxorubicina, e vincristina para o tratamento do cancro recorrente do pulmão de pequenas células. J Clin Oncol, 1999. 17(2): 658-667.
- Eckardt JR, et al: Estudo aberto, multicêntrico, randomizado, fase III comparando topotecan/cisplatina oral versus etoposídeo/cisplatina como tratamento para doentes ingénuos com cancro do pulmão de pequenas células de doença extensiva. J Clin Oncol, 2006. 24(13): 2044-2051.
- Garassino MC, et al: Resultados de doentes com cancro do pulmão de pequenas células tratados com quimioterapia de segunda linha: uma análise retrospectiva multi-institucional. Lung Cancer, 2011. 72(3): 378-83.
- Chung HC, et al: Abstract CT073: Pembrolizumab após duas ou mais linhas de terapia prévia em doentes com cancro do pulmão de pequenas células avançado (SCLC): Resultados dos estudos KEYNOTE-028 e KEYNOTE-158. Cancer Research, 2019. 79(13 Suplemento): CT073-CT073.
- Ready N, et al: Terceira linha de monoterapia nivolumab em SCLC recorrente: CheckMate 032. J Thorac Oncol, 2019. 14(2): 237-244.
- Pless M., et al: Induction chemoradiation in stage IIIA/N2 non-small-cell lung cancer: a phase 3 randomised trial. The Lancet, 2015. 386(9998): 1049-1056.
- Burdett S, et al: Radioterapia pós-operatória para o cancro do pulmão de células não pequenas. Base de dados Cochrane de revisões sistemáticas, 2016(10).
- Antonia SJ, et al: Durvalumab após Quimioradioterapia na Fase III Câncer de Pulmão Não-Pulmão de Células Pequenas. N Engl J Med, 2017. 377(20): 1919-1929.
- Antonia SJ, et al: Sobrevivência Global com Durvalumab após Quimioradioterapia na Fase III do NSCLC. N Engl J Med, 2018. 379(24): 2342-2350.
- Reck M, et al: Pembrolizumab versus quimioterapia para o cancro do pulmão PD-L1-positivo de células não pequenas. N Engl J Med, 2016. 375(19): 1823-1833.
- Gandhi L, et al: Pembrolizumab mais Quimioterapia em Cancro Pulmonar Metástático Não-Pulmonar de Células Pequenas. N Engl J Med, 2018. 378(22): 2078-2092.
- Socinski, M.A., et al: Atezolizumab para o Tratamento de Primeira Linha do NSCLC Metástático Não Quimérico. N Engl J Med, 2018. 378(24): 2288-2301.
- West H., et al: Atezolizumab em combinação com carboplatina mais quimioterapia nab-paclitaxel em comparação com a quimioterapia apenas como tratamento de primeira linha para o cancro do pulmão metastático não-químico não pequeno (IMpower130): um ensaio multicêntrico, aleatorizado, com rótulo aberto, fase 3. Lancet Oncol, 2019. 20(7): 924-937.
- Paz-Ares L, et al: Pembrolizumab mais Quimioterapia para o Cancro do Pulmão Squamous Non-Small-Cell. N Engl J Med, 2018. 379(21): 2040-2051.
- Vokes EE, et al: Nivolumab versus docetaxel em cancro de pulmão avançado não de pequenas células previamente tratado (CheckMate 017 e CheckMate 057): actualização de 3 anos e resultados em doentes com metástases hepáticas. Ann Oncol, 2018. 29(4): 959-965.
- Rittmeyer A, et al: Atezolizumab versus docetaxel em doentes com cancro do pulmão não-celular (OAK) previamente tratado: uma fase 3, rótulo aberto, ensaio multicêntrico randomizado e controlado. Lancet, 2017. 389(10066): 255-265.
- Fehrenbacher L, et al: Updated Efficacy Analysis Including Secondary Population Results for OAK: A Randomized Phase III Study of Atezolizumab versus Docetaxel in Patients with Previously Treated Advanced Non-Small Cell Lung Cancer. J Thorac Oncol, 2018. 13(8): 1156-1170.
- Herbst RS, et al: Pembrolizumab versus docetaxel para cancro do pulmão previamente tratado, PD-L1-positivo, cancro do pulmão avançado não de pequenas células (KEYNOTE-010): um ensaio controlado aleatório. Lancet, 2016. 387(10027): 1540-1550.
- Alexandrov LB, et al: Assinaturas de processos mutacionais no cancro humano. Natureza, 2013. 500(7463): 415.
- Shi Y, et al: Um estudo prospectivo de epidemiologia molecular de mutações EGFR em doentes asiáticos com cancro do pulmão avançado de células não pequenas de histologia do adenocarcinoma (PIONEER). J Thorac Oncol, 2014. 9(2): 154-162.
- Mitsudomi T, Yatabe Y: receptor do factor de crescimento epidérmico em relação ao desenvolvimento tumoral: gene EGFR e cancro. A revista FEBS, 2010. 277(2): 301-308.
- Lee CK, et al: Impacto do inibidor EGFR no cancro do pulmão de células não pequenas na sobrevivência global e sem progressão: uma meta-análise. J Natl Cancer Inst, 2013. 105(9): 595-605.
- Wu SG, Shih J-Y, Gestão da resistência adquirida à terapia orientada para EGFR TKI em cancro do pulmão avançado de células não pequenas. Cancro Molecular, 2018. 17(1): 38.
- Soria JC, et al: Osimertinib em cancro do pulmão avançado não pequeno de células EGFR não tratado. New England journal of medicine, 2018. 378(2): 113-125.
- O Tagrisso melhora significativamente a sobrevivência global no ensaio FLAURA fase III para o cancro do pulmão de 1ª linha com EGFR-mutated nonsmall cell lung cancer [press release]. Wilmington, DE: AstraZeneca; 9 de Agosto de 2019. https://bit.ly/2ZGF7gZ.
- Nakamura A, et al: Estudo de Fase III comparando a monoterapia com gefitinibe (G) à terapia combinada com gefitinibe, carboplatina, e pemetrexed (GCP) para pacientes não tratados (pts) com cancro de pulmão avançado de células não pequenas (NSCLC) com mutações EGFR (NEJ009). Journal of Clinical Oncology, 2018. 36(15_suppl): 9005-9005.
- Saito H, et al: Erlotinib mais bevacizumab versus erlotinibe sozinho em doentes com cancro do pulmão avançado não-químico e não-químico com EGFR-positivo (NEJ026): análise provisória de um ensaio aberto, randomizado, multicêntrico, fase 3. Lancet Oncol, 2019. 20(5): 625-635.
- Soda M, et al: Identificação do gene transformador da fusão EML4-ALK no cancro do pulmão de células não pequenas. Natureza, 2007. 448(7153): 561.
- Shaw AT, et al: Características clínicas e resultados de pacientes com cancro do pulmão não pequeno que albergam EML4-ALK. Journal of clinical oncology, 2009. 27(26): 4247.
- Peters S, et al: Alectinib versus crizotinib em Câncer de Pulmão Não-Positivo de Pequenas-Células ALK não tratado. N Engl J Med, 2017. 377(9): 829-838.
- Hida T, et al: Alectinib versus crizotinibe em doentes com cancro do pulmão não-positivo de pequenas células ALK (J-ALEX): um ensaio de fase 3 aberto e aleatorizado. Lancet, 2017. 390(10089): 29-39.
- Ryser CO, Diebold J, Gautschi O: Tratamento do cancro do pulmão por linfoma anaplásico kinase-positivo não pequeno: actualização e perspectivas. Curr Opinião Oncol, 2019. 31(1): 8-12.
- Shaw AT, et al: Crizotinib em ROS1 – cancro de pulmão de células não pequenas. New England Journal of Medicine, 2014. 371(21): 1963-1971.
- Ou S, et al: OA02. 03 Actividade Clínica de Lorlatinib em Pacientes com Cancro Pulmonar Não-Pulmonar Avançado ROS1+: Coorte de Estudo de Fase 2 EXP-6. Journal of Thoracic Oncology, 2018. 13(10): S322-S323.
- Planchard D, et al: Dabrafenib mais trametinib em doentes com BRAF(V600E)-câncer de pulmão metastático não pequeno de células: um ensaio de fase 2 multicêntrico e aberto. Lancet Oncol, 2016. 17(7): 984-993.
- Planchard D, et al: Dabrafenib mais trametinib em doentes com BRAF(V600E)-câncer de pulmão metastático não pequeno de células: um rótulo aberto, ensaio fase 2. Lancet Oncol, 2017. 18(10): 1307-1316.
- Fakih M, et al: Estudo de fase 1 avaliando a segurança, tolerabilidade, farmacocinética (PK), e eficácia do AMG 510, um novo inibidor de pequenas moléculas KRASG12C, em tumores sólidos avançados. Journal of Clinical Oncology, 2019. 37(15_suppl): 3003-3003.
- Gautschi O, et al: Targeting RET in Patients With RET-Rearranged Lung Cancers: Results From the Global, Multicenter RET Registry. J Clin Oncol, 2017. 35(13): 1403-1410.
- Drilon AE, et al: Um estudo de fase 1 de LOXO-292, um potente e altamente selectivo inibidor de RET, em doentes com cancros alterados por RET. Journal of Clinical Oncology, 2018. 36(15_suppl): 102-102.
- Gainor JF, et al: Actividade clínica e tolerabilidade do BLU-667, um inibidor de RET altamente potente e selectivo, em doentes (pts) com cancro de pulmão de RET-fusion+ não pequeno (NSCLC) avançado. Journal of Clinical Oncology, 2019. 37(15_suppl): 9008-9008.
- Drilon A, et al: Eficácia do larotrectinibe em cancros de fusão TRK positivos em adultos e crianças. New England Journal of Medicine, 2018. 378(8): 731-739.
- Demetri GD, et al: LBA17Efficacy and safety of entrectinib in patients with NTRK fusion-positive (NTRK-fp) tumours: pooled analysis of STARTRK-2, STARTRK-1 and ALKA-372-001. Annals of Oncology, 2018. 29(suppl_8).
- “DeVita”, Hellman e Rosenberg’s Cancer: Principles & Practice of Oncology, 11ª edição; Wolters Kluwer, 2019.
InFo ONCOLOGY & HEMATOLOGY 2019; 7(4): 12-17.