Os anticorpos monoclonais casirivimab/imdevimab e sotrovimab receberam aprovação Swissmedic em Dezembro passado e em Janeiro deste ano, respectivamente. Outro medicamento promissor para o tratamento de doentes com Covid 19 está prestes a ser lançado na Suíça. O Molnupiravir é um antiviral administrado oralmente que deve ser utilizado na fase inicial da covide 19 symptomatology, dados de ensaios recentes mostram.
A vacinação é o instrumento mais importante para a protecção contra infecções, cursos severos e hospitalizações [1]. No entanto, para aqueles que se tornam infectados, uma terapêutica covid-19 segura e eficaz é crucial. Os candidatos prometedores a medicamentos contribuem em particular para a redução da necessidade de hospitalização e contrabalançam os cursos severos no hospital. De acordo com as revisões correspondentes, as três categorias de medicamentos seguintes cumprem estes critérios: anticorpos monoclonais antivirais, substâncias orais antivirais e imunomoduladores [1]. Enquanto os primeiros se destinam a impedir que os vírus entrem ou se multipliquem nas células do corpo, os imunomoduladores são utilizados nas fases avançadas da doença para amortecer as reacções de defesa do corpo [2]. A FOPH troca regularmente informações com o grupo de trabalho científico sobre terapias existentes e novas contra a covid-19. Os pedidos de autorização de introdução no mercado actualmente a ser avaliados pelo Swissmedic são apresentados no quadro 1 [3,15].
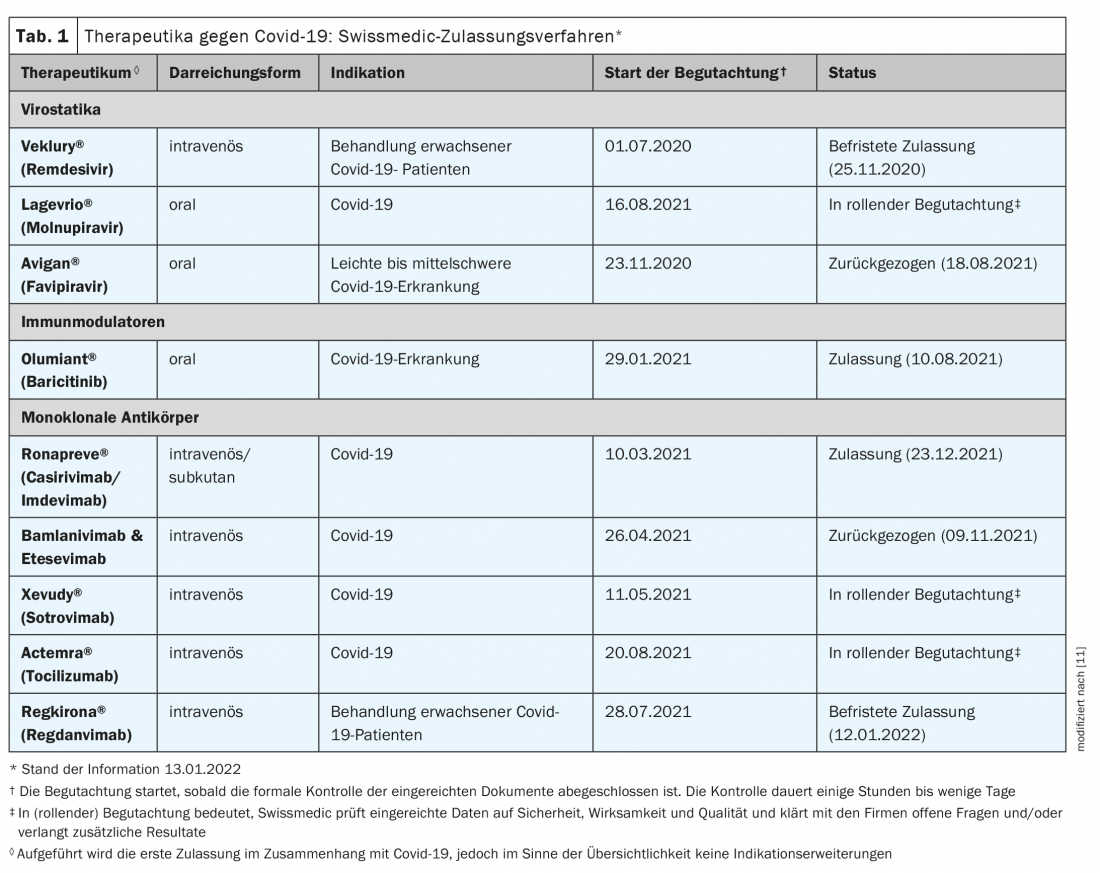
Primeiro medicamento oral para o tratamento de pacientes externos
O Gabinete Federal de Saúde Pública celebrou um contrato para a reserva do medicamento antiviral Molnupiravir (Lagevrio®) por recomendação do grupo de trabalho científico Covid 19. O Molnupiravir, que está disponível em comprimidos, é um inibidor de RNA polimerase e é um dos agentes antivirais. O medicamento já foi aprovado no Reino Unido desde Novembro de 2021, e uma aprovação de emergência foi solicitada nos EUA no mesmo período [2]. Num ensaio clínico, a eficácia foi demonstrada em doentes covid-19 não hospitalizados com elevado risco de progressão grave da doença, onde a janela temporal parece ser crítica para o sucesso do tratamento [4,5] (Caixa). O medicamento já pode ser utilizado na Suíça durante o actual procedimento de autorização de comercialização após a adaptação do Regulamento 3 da Covid 19 (estado da informação: 15.01.2022). O governo federal cobrirá os custos de tratamento no sector ambulatório até ser reembolsado pelo seguro de saúde obrigatório [3].

Sotrovimab e casirivimab/imdevimab agora oficialmente aprovados
Para Xevudy® (sotrovimab), a aprovação oficial Swissmedic foi concedida em 14.1.2022 e para Ronapreve® (casirivimab e imdevimab) em 23.12.2021 [6]. Ambos são anticorpos monoclonais intravenosos indicados para adultos e adolescentes com 12 anos ou mais (peso corporal de pelo menos 40 kg) para o tratamento da covid-19 quando não é necessária oxigenoterapia ou hospitalização e existe um elevado risco de desenvolver um curso severo de covid-19. Ronapreve® é também indicado – como o único medicamento aprovado na Suíça até à data – para a prevenção da Covid-19 quando não é possível uma resposta imunológica adequada à vacinação Covid-19 devido a outras doenças ou terapias. No momento da aprovação, contudo, não havia informação disponível sobre a eficácia com a variante ómicron [6].
Remdesivir – O que há de novo?
O Remdesivir (Veklury®) já está disponível na Suíça desde 2020 para o tratamento da covid-19. Tem havido e continua a haver um debate controverso sobre os benefícios do ingrediente activo originalmente desenvolvido para tratar os vírus do Ébola. Uma publicação de Dezembro de 2021 de novos dados de ensaios no New England Journal of Medicine mostra que em doentes não hospitalizados com elevado risco de progressão para o covid-19, três dias de tratamento com remdesivir estão associados a um risco inferior de hospitalização ou morte em comparação com placebo [7]. O estudo incluiu pacientes não hospitalizados com covid-19 que tinham experimentado sintomas nos últimos sete dias e tinham pelo menos um factor de risco para a progressão da doença. Os pacientes foram aleatoriamente afectados a tratamento com remdesivir (n=279) ou placebo (n=283). Remdesivir foi administrado por via intravenosa numa dose de 200 mg no dia 1 e 100 mg nos dias 2 e 3. As hospitalizações ou mortes relacionadas com a Covid-19 ocorreram em dois pacientes no grupo remdesivir e em 15 no grupo placebo (0,7% vs. 5,3%; razão de perigo: 0,13). No dia 28, 1,6% e 8,3% dos pacientes dos grupos remdesivir e placebo, respectivamente, tiveram uma visita médica relacionada com o Covid 19 (hazard ratio: 0,19). Não houve mortes até ao 28º dia. Os acontecimentos adversos ocorreram em 42,3% e 46,3% dos doentes nos grupos verum e placebo, respectivamente.
E quanto ao Paxlovid®?
Utilizado numa fase inicial da doença de Covid, este fármaco administrado oralmente pode atenuar significativamente o curso da doença, de acordo com as descobertas actuais. Em estudos, Paxlovid® (nirmatrelvir mais ritonavir) reduziu o risco de hospitalização e morte em 89% em doentes adultos não hospitalizados de alto risco covid 19 quando foram tratados com ela durante cinco dias no prazo de três dias após o início dos sintomas [8]. A US Food and Drug Administration (FDA) concedeu aprovação de emergência para Paxlovid® no final de Dezembro de 2021 para a indicação de pacientes corona positivos com 12 anos ou mais com sintomas ligeiros a moderados e um elevado risco de progressão grave [10]. A Agência Europeia de Medicamentos (EMA) apoia a utilização de Paxlovid® para o tratamento de adultos com covid-19 que não necessitam de oxigénio suplementar e que correm um risco acrescido de progressão grave da doença [9].
Literatura:
- “Questions and answers on the list of ten COVID-19 therapeutic candidates”, 22.10.2021, https://ec.europa.eu (último acesso: 15.01.2022).
- “Therapeutic drugs against coronavirus infection Covid-19”, 11.01.2022, www.vfa.de/de/arzneimittel-forschung (último acesso 15.01.2022).
- “Coronavírus: Confederação assina contrato para reservar um medicamento”, www.bag.admin.ch, (último acesso 15.01.2022)
- Jayk Bernal A, et al; MOVe-OUT Study Group. Molnupiravir para Tratamento Oral de Covid-19 em Pacientes Não Hospitalizados. N Engl J Med. 2021 Dez 16: NEJMoa2116044.
- “Estudo da fase 3 confirma a eficácia do molnupiravir em doentes não hospitalizados com COVID-19”, Sociedade Alemã de Neurologia, 07.01.2022, https://dgn.org/neuronews (último acesso 15.01.2022).
- “Swissmedic aprova “Ronapreve(R)” para doentes de Covid 19″. , 27.12.2021, (último acesso: 15.01.2022)
- Gottlieb RL, et al; GS-US-540-9012 (PINETREE) Investigadores. Remdesivir precoce para prevenir a progressão para a Covid-19 severa em pacientes externos. N Engl J Med. 2021 Dez 22. doi: 10.1056/NEJMoa2116846.
- “Um milhão de pacotes do medicamento Covid 19 da Pfizer: governo federal compra Paxlovid”, www.deutsche-apotheker-zeitung.de (último acesso 15.01.2022)
- “EMA apoia a utilização de Paxlovid para emergências”, www.aerzteblatt.de/, (último acesso em 15.01.2022)
- “Pfizer Recebe Autorização de Uso de Emergência da FDA dos EUA para Novo Tratamento Antiviral Oral COVID-19,” www.pfizer.com/news (último acesso em 15 de Janeiro de 2022).
- “Status of approvals for the control of Covid-19”, www.swissmedic.ch (último acesso: 15.01.2022)
- “BIO COVID-19 Therapeutic Development Tracker”, www.bio.org (último acesso: 15.01.2022).
- Whitley R: Molnupiravir – Um passo em direcção a Terapias Oralmente Biodisponíveis para Covid-19. N Engl J Med. 2021 Dez 16: NEJMe2117814.
PRÁTICA DO GP 2022; 17(1): 40-41
InFo PNEUMOLOGIA & ALERGOLOGIA 2022; 4(1): 34-35
CARDIOVASC 2022; 21(1): 34-35












