Diroximel fumarate/DRF é um novo fumarato oral para pacientes com esclerose múltipla recorrente (RRMS) que foi aprovado para reembolso na Suíça em 1 de Novembro de 2021 e que está disponível desde então [3,4]. Numa comparação directa com o fumarato de dimetilo/DMF, o DRF demonstrou ser significativamente mais tolerável.
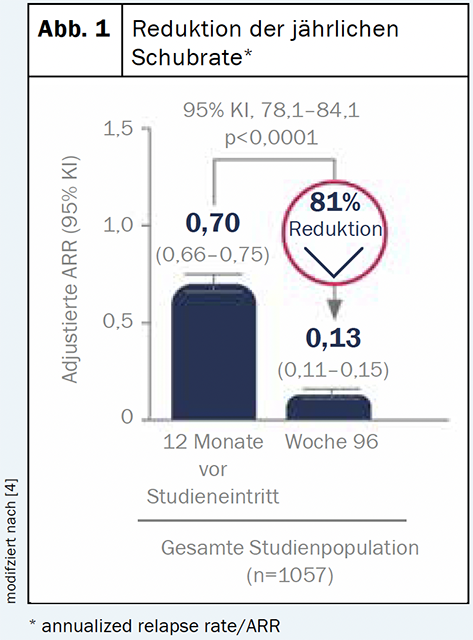
O diroximumarato (Vumerity™) é uma substância que é convertida no corpo para o metabolito activo fumarato monometílico. Isto corresponde ao mesmo metabolito activo que no fumarato de dimetilo (Tecfidera®) [4]. Por conseguinte, é de esperar que os perfis de benefício e segurança das duas substâncias sejam semelhantes [4]. Uma análise provisória do ensaio em curso da fase III do EVOLVEMS-1 mostrou um perfil de risco-benefício consistente com as conclusões anteriores: Após dois anos, as medições clínicas e radiológicas foram significativamente reduzidas a partir da linha de base [2] (Fig. 1). A baixa taxa (<1%) de interrupção do tratamento devido à gastroenterologia também sugere que DRF é uma opção mais bem tolerada do ponto de vista gastroenterológico [5].
Melhoria do perfil de tolerabilidade gastrointestinal
Isto foi confirmado no estudo EVOLVE-MS-2, numa comparação directa [1,2]. O objectivo do estudo da fase III duplo-cego era investigar a tolerabilidade gastrointestinal dos DRF e DMF durante 5 semanas em doentes com esclerose múltipla recorrente-remitente. Para tal, 462 mg DRF ou 240 mg DMF – as duas doses bioequivalentes – foram administradas duas vezes por dia a doentes com esclerose múltipla recorrente. O ponto final primário foi o número de dias com uma pontuação de intensidade IGISIS (Individual Gastrointestinal Symptom and Impact Scale) ≥2. Outros pontos finais foram a gravidade dos sintomas gastrointestinais, tal como medidos pelo IGISIS/GGISIS (Global Gastrointestinal Symptom and Impact Scale) e a avaliação da segurança/tolerabilidade. Foi demonstrado que houve uma redução estatisticamente significativa (46%) no número de dias com eventos gastrointestinais graves em doentes tratados com DRF em comparação com DMF. Foram observadas taxas mais baixas de efeitos secundários gastrointestinais (incluindo diarreia, náuseas, vómitos e dores abdominais) (34,8% vs. 49,0%). Isto também resultou na interrupção do tratamento por menos pacientes devido a eventos adversos (1,6% vs. 5,6%) e efeitos secundários gastrointestinais (0,8% vs. 4,8%). Pensa-se que a estrutura química diferente do DRF causa menos irritação no tracto gastrointestinal do que o DMF devido à menor produção de metanol (um componente pro-componente irritante do GI) e menor reactividade com proteínas ou receptores pré-sistémicos fora do alvo [1,6].
Doenças em foco
Uma análise post-hoc [7] prestou especial atenção à área dos distúrbios de rubor. Apresentar a frequência, gravidade e duração dos eventos adversos de descarga e relacionados com a descarga sob DRF, em comparação com DMF, durante 5 semanas. O mecanismo de descarga induzida por DMF não é totalmente compreendido, mas pode ser mediado, pelo menos em parte, pela prostaglandina D2 (PGD2). Durante o estudo da fase III EVOLVE-MS-2, a incidência de descarga foi menor com DRF do que com DMF (46% vs. 55%). Todas as descargas foram leves ou moderadas em DRF, e as descargas graves ocorreram em 5 doentes (2%) em DMF . No estudo investigado, nenhum paciente suspendeu o tratamento sob DRF (Vumerity
TM
), nenhum paciente suspendeu o tratamento devido à descarga. No ensaio EVOLVEMS-1 em curso, a taxa de desistências devido à descarga de água foi de <1%. Isto contrasta com os 4% de doentes tratados com DMF que relataram a descontinuação da lavagem como uma interrupção do tratamento nos ensaios DEFINE/CONFIRM [8–10].
Literatura:
- Naismith RT, et al: Diroximel Fumarate Demonstra um Perfil de Tolerabilidade Gastrointestinal Melhorado em Comparação com o Fumarate Dimetil em Pacientes com Esclerose Múltipla Recorrente: Resultados do Estudo Randomizado, Duplo-Blind, Fase III EVOLVEMS-2. CNS Drugs 2020; 34: 185-196.
- Wundes A, et al: O perfil gastrointestinal melhorado com fumarato de diroximel está associado a um impacto positivo na qualidade de vida em comparação com o fumarato de dimetilo: resultados do estudo aleatório, duplo-cego, fase III EVOLVE-MS-2. Ther Adv Neurol Disord 2021; 14: 1-14.
- Piehl F, et al: Terapias modulatórias de doenças actuais e emergentes e objectivos de tratamento para esclerose múltipla, J Intern Med 2021; 289(6): 771 – 791.
- Informação técnica Vumerity™, em: Agosto de 2021. www.swissmedicinfo.ch
- Wray S, et al: Diroximel Fumarate in Patients With Relapsing-Remitting Multiple Sclerosis: Interim Safety and Efficacy Results from the Phase 3 EVOLVE-MS-1 Study. 37º Congresso do Comité Europeu de Tratamento e Investigação em Esclerose Múltipla | 13-15 de Outubro de 2021. Cartaz: P739.
- Palte MJ, et al. Melhoria da Tolerabilidade Gastrointestinal dos Ésteres Ácidos Fumáricos: Conclusões precoces sobre Eventos Gastrointestinais com Fumarato de Diroximel em Pacientes com Esclerose Múltipla Remotora da Fase 3, Estudo EVOLVE-MS-1 com rótulo aberto. Erw Ther 2019; 36(11): 3154-3165.
- Singer BA, et al. Flushing and Flushing-Related Adverse Events With Diroximel Fumarate in Patients With Relapsing-Remitting Multiple Sclerosis: Results From the Phase 3 EVOLVE-MS-2 Study. 37º Congresso do Comité Europeu de Tratamento e Investigação em Esclerose Múltipla | 13-15 de Outubro de 2021. Cartaz: P673
- Phillips JT, et al: Clinical Significance of Gastrointestinal and Flushing Events in Patients with Multiple Sclerose Treated with Delayed-Release Dimethyl Fumarate Int J MS Care. 2015; 17: 236-243.
- Fox RJ, et al: Estudo da Fase 3 Controlada por Placebo do BG-12 Oral ou Glatiramer em Esclerose Múltipla. N Engl J Med. 2012; 367: 1087-1097.
- Gold R, et al: Estudo da Fase 3 Controlada por Placebo do BG-12 Oral para Relapsing Multiple Sclerosis. N Engl J Med. 2012; 367: 1098-1107.
Impressão
Texto/Editorial: Leoni Burggraf
Fonte: 37
th
Congresso do Comité Europeu de Tratamento e Investigação em Esclerose Múltipla (ECTRIMS), 13-15.10.2021
Este artigo foi escrito com o apoio financeiro da Biogen Switzerland AG, Baar.
© Prime Public Media AG, Zurique 2021
Biogen-144226_12.2021
™
▼This medicina está sujeita a observação adicional. Para mais informações, ver o folheto da Vumerity em
™
em www.swissmedicinfo.ch. Z: Cápsulas com micro-mesas revestidas com entérico de 231mg de fumarato de diroximel. I: Tratamento de pacientes com esclerose múltipla recorrente (RRMS) para reduzir a frequência de recaídas. D: Dose inicial 231mg duas vezes por dia, depois aumentando para 462mg (administrada como duas cápsulas de 231mg) duas vezes por dia. Uso oral. Pode ser tomado com ou sem refeições. Não esmagar, dividir, chupar ou mastigar as cápsulas. KI: Hipersensibilidade ao fumarato de diroximel, fumarato de dimetilo ou excipientes. Deficiência da função hepática e função renal moderada ou gravemente afectada. Infecção com o vírus HI (HIV). Infecções crónicas graves, bem como infecções crónicas activas. Perturbações gastrointestinais (IG) graves. Leukopenia < 3.0×10
9
/l, linfopenia < 0,5×109/l. Leucoencefalopatia multifocal progressiva (LPM) ou suspeita de LPM. Idade < 18 anos. Iniciar o tratamento durante a gravidez (S). VM: Nenhum tratamento concomitante com outros derivados do ácido fumárico. Foram relatados casos de anafilaxia durante o tratamento com fumarato de dimetilo. Laboratório: CBC com Diff-BB: Obrigatório. antes de iniciar o tratamento, recomendado nos primeiros 1,5 anos, no mínimo. de 3 em 3 meses e, posteriormente, pelo menos de 6 em 6-12 meses e quando clinicamente indicado. Em doentes com leucopenia < 3.0×10
9
/l ou linfopenia < 0,5×10
9
/l pausar a terapia. Avaliação de risco-benefício em doentes com contagem de linfócitos de ≥ 0,5×10
9
/l e < 0,8×10
9
/l durante > 6 meses. O tempo médio para a normalização dos linfócitos após a interrupção do tratamento com fumarato de dimetilo em doentes sem linfopenia grave prolongada está estimado em 4,7 semanas. Com fumarato de dimetilo e outros medicamentos contendo fumarato, ocorreram casos de LPM principalmente em doentes com linfopenia (< 0,91×10
9
/l), ocorreram casos de LPM. Nos primeiros sinais/sintomas de LPM, a Vumeridade deve ser descontinuada e os testes de diagnóstico devem ser realizados. Os pacientes devem informar os seus confidentes ou prestadores de cuidados sobre o tratamento com Vumerity, pois podem notar sintomas que não são notados pelo paciente. As infecções graves por herpes zoster (HZI) podem ocorrer em qualquer altura com Vumeridade. Devem ser tomadas medidas apropriadas se a HZI for confirmada. Função renal/hepática: Recomendado antes e 6 meses após o início da terapia, depois a cada 6-12 meses, e em contextos clínicos apropriados. A quantidade pode causar lesões hepáticas induzidas por drogas, incluindo a elevação da enzima hepática (≥ 3x ULN) e a elevação total da bilirrubina (≥ 2x ULN). Utilizar apenas com cautela na insuficiência renal ligeira e na comedicação nefrotóxica. Em caso de infecções graves, considerar a possibilidade de interromper a terapia. Ao passar da terapia modificadora de doenças e/ou imunossupressores (IS) para a Vumeridade, efectuar um acompanhamento clínico de malha estreita em relação a infecções oportunistas durante os primeiros meses de tratamento. S: A contracepção é obrigatória em idade fértil. Não recomendado durante o S; se recomendado, apenas se clinicamente necessário e se o benefício para o paciente superar o risco para o feto. Decisão individual de interromper o aleitamento materno ou o tratamento com Vumerity. Os benefícios da amamentação para a criança e os benefícios da terapia para a mãe devem ser tidos em conta. UW: Gastroenterite, linfopenia, leucopenia, sensação de ardor, rubor, rubor, distúrbios gastrointestinais (diarreia, náuseas, dores superiores/abdominais, vómitos, dispepsia, gastrite, perturbação gastrointestinal), prurido, erupção cutânea, eritema, proteinúria, rubor, cetonúria, elevação de AST e ALT. IA: Aumento do risco de infecção com tratamento concomitante com SI. Em caso de pré-tratamento com SI, a imunocompetência deve ser restaurada antes de se iniciar a terapia. Nenhuma influência de 325mg de ASA no perfil PK. Lista B. A informação profissional completa é publicada em www.swissmedicinfo.ch. Biogen Switzerland AG, Neuhofstrasse 30, CH-6340 Baar. Estado da informação: Agosto de 2021. Biogen-129742_09.2021