A interleucina-23 e a interleucina-17A desempenham um papel importante no processo inflamatório da psoríase em placas. Uma comparação de dois agentes dirigidos contra estes alvos na psoríase de placa moderada a grave conduziu a resultados interessantes.
Voltar a “Notícias sobre dermatite atópica e psoríase”.
Como a empresa farmacêutica AbbVie Inc., a AbbVie Inc. num comunicado de imprensa, o inibidor risankizumab IL23 (Skyrizi™) [1] provou ser superior ao inibidor secukinumab IL17A (Cosentyx®) [2] neste estudo multicêntrico duplo-cego, aleatorizado, controlado activamente e com rótulo aberto fase III em relação a vários pontos finais primários e secundários após um período de tratamento de 52 semanas [3]. Os sujeitos foram aleatorizados 1:1 para a condição Skyrizi™ 150 mg* (n=164) ou Cosentyx® 300 mg** (n=163) como injecções subcutâneas. Os dois pontos finais primários foram definidos como não-inferioridade na semana 16 e superioridade na semana 52 em relação ao PASI90. Os parâmetros secundários foram os valores dos seguintes parâmetros na semana 52: PASI 100, sPGA 0/1 e PASI 75.
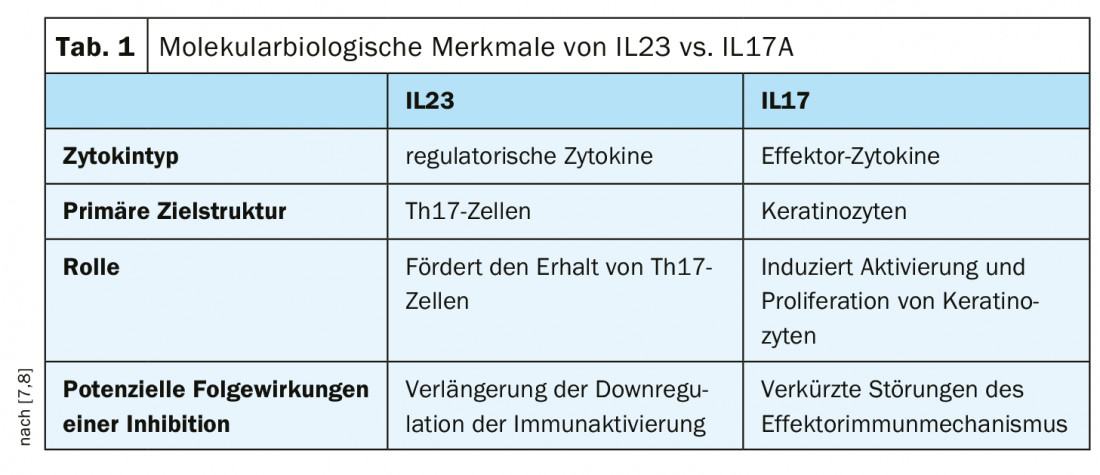
Em tratamento com risankizumab, uma proporção de 74% dos doentes atingiu PASI90 na semana 16, em comparação com apenas 66% na condição de secukinumab [3]. Risankizumab também atingiu o segundo parâmetro primário (87% de resposta PASI 90 vs. 57% com secukinumab, p<0,001) [3]. O inibidor risankizumab IL23 também se revelou superior ao inibidor secukinumab IL17A em todos os parâmetros secundários medidos neste estudo, incluindo o PASI 100, PASI 75, e sPGA 0/1 na semana 52 (p<0,001) [3]. O perfil de segurança de Skyrizi™ foi consistente com o de estudos anteriores, não tendo sido comunicados novos sinais de segurança durante o período de estudo de 52 semanas (4-6). Os biólogos Skyrizi™ (risankizumab) [1] e Cosentyx® (secukinumab) [2] são aprovados na Suíça para o tratamento da psoríase de placa moderada a grave em adultos. Estas são duas das opções de tratamento interleucina-antagonista sucessivamente expandidas para doentes com psoríase nos últimos anos. As duas citocinas IL-23 e IL17A diferem no que respeita a várias características biológicas moleculares (Tab. 1).
* Condição Skyrizi™ 150 mg: 2 injecções subcutâneas de 75 mg cada uma às semanas 0, 4 e 12; posteriormente a intervalos de 12 semanas.
** Condição Cosentyx® 300 mg: 2 injecções subcutâneas de 150 mg cada na semana 0,1,2,3,4; posteriormente a intervalos de 4 semanas.
Fonte: AbbVie Inc.
Literatura:
- Skyrizi [Summary of Product Characteristics]. AbbVie Ltd. Disponível em: .
- Cosentyx: https://compendium.ch, último acesso 12.02.2020
- Comunicado de imprensa da AbbVie: https://news.abbvie.com/news/press-releases/new-head-to-head-phase-3-data-show-skyrizi-risankizumab-superior-to-cosentyx-secukinumab-across-primary-and-all-ranked-secondary-endpoints-in-adults-with-moderate-to-severe-plaque-psoriasis-at-52-weeks.htm
- Gordon K, et al: Eficácia e segurança do risankizumab em psoríase de placa moderada a severa (UltIMMa-1 e UltIMMa-2): resultados de dois ensaios de fase 3 duplo-cego, aleatorizados, controlados por placebo e controlados por ustekinumab. The Lancet 2018; 25; 392(10148): 650-661.
- Reich K, et al: Risankizumab comparado com adalimumab em doentes com psoríase em placa moderada a grave (IMMvent): um ensaio fase 3 aleatorizado, duplo-cego, controlado por comparadores activos. Lancet 2019; 394(10198): 576-586.
- Blauvelt A, et al: Eficácia e Segurança do Tratamento Contínuo Q12W Risankizumab Versus Retirada: Resultados de 2 Anos Duplo-Blinded do Ensaio da Fase 3 IMMhance. Poster #478. 24º Congresso Mundial de Dermatologia. 2019.
- Gooderham MJ, et al: Shifting the focus – o papel principal da IL-23 na psoríase e outras perturbações inflamatórias. J Eur Acad Dermatol Venereol 2018; 32: 1111-1119.
- Girolomoni G, et al: O papel da IL-23 e do eixo imunitário da IL-23/TH17 na patogénese e no tratamento da psoríase. J Eur Acad Dermatol Venereol 2017; 31: 1616-1626.
DERMATOLOGIE PRAXIS 2020; 30(1): 27 (publicado 22.2.20, antes da impressão).











