A coagulação inibidora é uma importante pedra angular da terapia da síndrome coronária aguda. Os inibidores de agregação plaquetária que visam a síntese de tromboxano, o receptor ADP, o receptor de glicoproteína IIb/IIIa e o receptor de trombina PAR 1 estão em uso clínico para este fim, juntamente com os inibidores da coagulação plasmática. Os representantes mais potentes de substâncias individuais, bem como a sua combinação, prometem uma eficácia antitrombótica melhorada, mas podem ter de ser ponderados contra o risco de hemorragia numa base individual.
O caminho desde a primeira descrição da angina de peito por John Warren como “estrangulamento do peito” na primeira edição do New England Journal of Medicine em 1812 [1] até à compreensão actual da doença coronária a nível genético e molecular tem sido forrado com grandes descobertas, inovações e avanços terapêuticos notáveis.
Enquanto até 1961 os pacientes com SCA tinham de descansar o mais tranquilos possível e morreram em 30% dos casos, hoje são monitorizados continuamente em unidades de cuidados coronários, o que, juntamente com as opções de intervenção terapêutica alargada, levou a uma redução da mortalidade hospitalar para 6-7%.
Para além da cirurgia de bypass aortocoronário, que celebrou o seu 50º aniversário em 2014, as opções de intervenção terapêutica incluem a intervenção coronária percutânea (PCI), que foi lançada em 1977 por Andreas Grüntzig em Zurique. Esta é agora uma das intervenções mais comuns na medicina moderna [2], com taxas anuais de implantação de cerca de 500.000 stents de segunda geração (DES) nos Estados Unidos [3]. Dado o mecanismo patogenéticamente essencial da formação de trombos locais, a terapia anticoagulante é da maior importância. Isto é composto pela inibição da hemostasia primária e da coagulação plasmática. A inibição terapêutica da adesão/activação plaquetária e agregação ocorre através da inibição da síntese de tromboxano, bloqueio do receptor ADP e inibição do receptor GP IIb/IIIa. A inibição de vários factores da cascata de coagulação assegura a anticoagulação plasmática, que no caso da ICP é aplicada por heparina, heparinas de baixo peso molecular e inibidores selectivos de factores específicos (bivalirudina para inibição da trombina; fondaparinux para inibição da FXa mediada por antitrombina).
Esta revisão discutirá os mecanismos de acção e as indicações para o uso dos medicamentos antiplaquetários em uso hoje em dia. Por razões de clareza, a anticoagulação igualmente importante no PCI não é discutida aqui e pode ser lida sobre outros sítios [4,5].
Fisiologia das plaquetas
As plaquetas são células anucleares responsáveis pela hemostasia primária através da adesão, agregação, secreção e interacção com factores de coagulação. A lesão da integridade vascular com a exposição da matriz subendotelial leva à activação imediata das plaquetas. Isto é inicialmente mediado pelo contacto das plaquetas circulantes com colagénio, factor von Willebrand e fibrinogénio através dos receptores de glicoproteína VI, Ib e IIb/IIIa, e é reforçado pela secreção de, entre outros, tromboxano e ADP, no sentido de um ciclo de feedback positivo. O receptor heterodimérico de glicoproteína GP IIb/IIIa, que está presente em grande número (aproximadamente 80.000/P) e tem uma menor afinidade pelos seus ligandos em plaquetas em repouso, sofre uma alteração conformacional através de mecanismos de sinalização intracelular que leva a uma exposição do local de ligação de ligandos como o fibrinogénio, vWF e a fibronectina. Isto medeia a agregação plaquetária e a aderência firme.
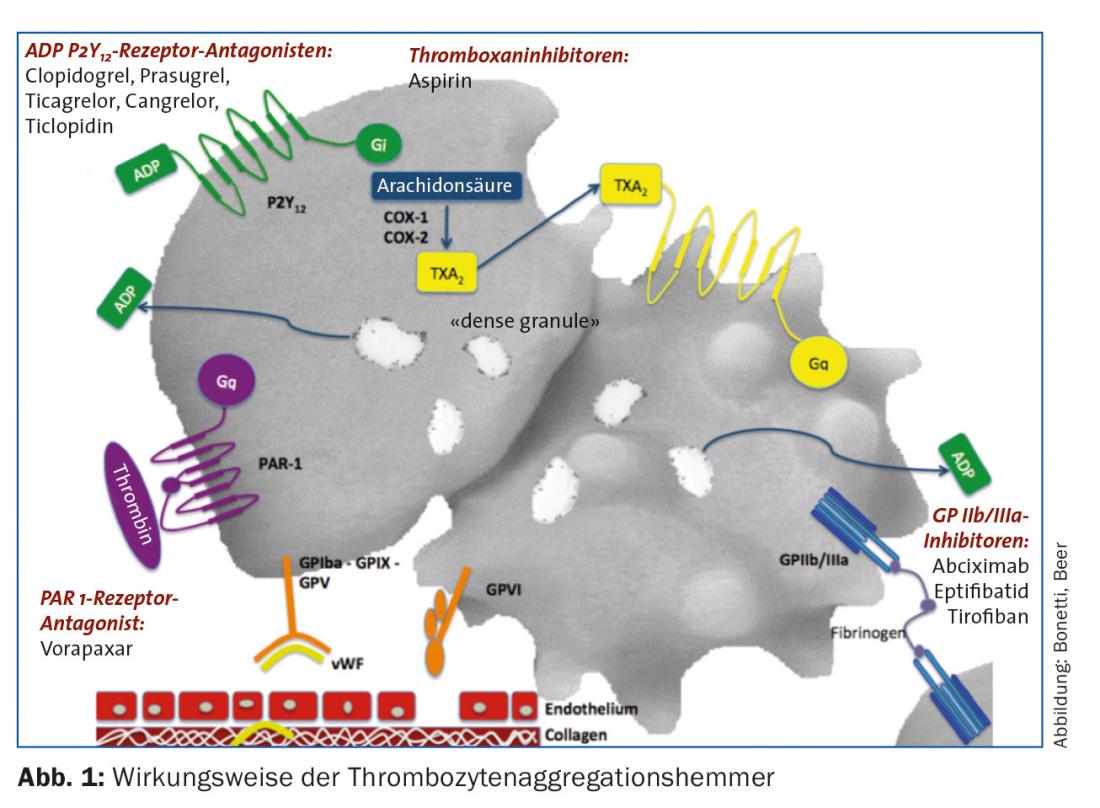
No cenário da síndrome coronária aguda, este processo pode ser interrompido terapêuticamente nos seguintes pontos (Fig. 1):
- Inibição da síntese de tromboxano (ácido acetilsalicílico [ASS] inibe a ciclo-oxigenase)
- Inibição do receptor ADP P2Y12 (irreversível: clopidogrel, prasugrel; reversível: ticagrelor, cangrelor [extremamente curto, adequado para fazer a ponte]).
- Inibição do receptor do GP IIb/IIIa (abciximab, eptifibatide, tirofibã)
- Inibição do receptor de trombina (vorapaxar)
Segue-se uma visão geral das substâncias individuais e dos seus mecanismos de acção.
Aspirina
A aspirina inibe irreversivelmente a cicloxigenase 1 (COX-1) e assim a síntese de tromboxane A2. Este efeito persiste durante todo o período de vida da plaqueta (dez dias, regra geral: 10% Tc “fresco” diariamente). A eficácia da aspirina tem sido demonstrada em doentes com angina de peito instável (AP). Quatro ensaios controlados aleatorizados da era pré-PCI mostraram uma redução de 51% na taxa de enfarte do miocárdio, bem como na mortalidade [6–9]. Uma meta-análise destes estudos mostrou uma redução de 46% na razão de probabilidade de complicações vasculares nesta população de doentes após dois anos de terapia com aspirina.
Em termos de dosagem, o ensaio CURRENT-OASIS 7, que estudou cerca de 25.000 pacientes com ACS, não mostrou diferenças nos resultados entre a dosagem mais elevada (300-325 mg) e a dosagem mais baixa (75-100 mg). De facto, os efeitos anti-agregadores já estão saturados numa dose de cerca de 30-75 mg em estado estacionário, enquanto os efeitos secundários gastrointestinais e as taxas de sangramento aumentam de forma dependente da dose (mesmo na gama de doses mais baixas). Na Suíça, recomenda-se uma dose padrão de 100 mg em conformidade na prevenção primária e secundária. A prevenção primária, por outro lado, só é recomendada para doentes com mais de 50 anos de idade com um perfil de risco significativamente aumentado [4]. Instrumentos normalizados tais como o Framingham Risk Score e as Directrizes AGLA devem ser utilizados para a estratificação do risco.
Inibidores P2Y12
Clopidogrel: Clopidogrel (300-600 mg dose de carga e 75 mg/d dose de manutenção) requer oxidação pelo sistema de citocromo hepático P450 para conversão para o metabolito activo. Neste processo, cerca de 85% do pró-fármaco é hidrolisado por esterases numa forma inactiva. O metabolito activo inactiva selectiva e irreversivelmente o receptor P2Y12, impedindo a activação das plaquetas mediadas por ADP. Enquanto a dupla terapia antiagregatória com aspirina e clopidogrel reduz a taxa de eventos isquémicos após a ICP [10–11], até 10% dos doentes com esta combinação de terapia experimentam recorrência isquémica no primeiro ano com uma taxa de trombose de stent de até 2% [12]. A variabilidade interindividual parcialmente grande da reactividade plaquetária, devido à biodisponibilidade variável, é considerada responsável por isso. Em termos farmacogenéticos, isto deve-se em grande parte às variantes de “perda de função” no alelo CYP 2C19 e especialmente no alelo C19*2. Os pacientes com esta mutação têm níveis mais baixos do metabolito activo e a correspondente inibição da agregação plaquetária reduzida. Embora os testes genéticos rápidos para esta mutação estejam agora mais amplamente disponíveis, a EMA e a FDA desaconselham a sua utilização não selectiva. Os testes genéticos e a análise da função plaquetária devem ser reservados para pacientes com trombose pós-stent em tratamento, alto risco de hemorragia e stents em vasos críticos (por exemplo, haste principal esquerda).
As interacções com PPIs, especialmente omeprazol e esomeprazol, têm sido descritas muitas vezes. Embora as interacções farmacodinâmicas sejam consideradas relativamente certas, uma relevância clínica não pôde ser confirmada com certeza. Em geral, os PPIs não devem ser prescritos automaticamente mesmo em doentes com dupla antiagregação, mas devem ser administrados a grupos de risco com estado pós hemorragia gastrointestinal, anticoagulação concomitante, em terapia com esteróides ou AINEs, idade avançada (>65 anos) ou com infecção por H. pylori. No caso de uma terapia PPI necessária, os estudos farmacodinâmicos falam pela utilização de substâncias mais recentes (por exemplo, pantoprazol).
Prasugrel: Prasugrel (60 mg dose de carga, 10 mg/d dose de manutenção) é um inibidor irreversível do receptor P2Y12 com um início de acção mais rápido e efeito mais forte do que o clopidogrel. No ensaio TRITON-TIMI 38, aproximadamente 10 000 pacientes com ACS (STEMI ou NSTEMI) e ICP planeada foram tratados com clopidogrel ou prasugrel, iniciado durante ou após a intervenção [13]. Após 15 meses, os eventos cardiovasculares recorrentes foram significativamente reduzidos no grupo prasugrel (de 11,2% para 9,3%; risco relativo (RR) 0,82; p=0,002). Em particular, o risco de enfarte do miocárdio foi significativamente menor com o prasugrel (redução do risco relativo de 23,9%). No entanto, isto foi feito ao preço de um aumento significativo da taxa de sangramento grave e fatal (2,4% vs. 1,8%; HR 1,4; p=0,02). Tendo em conta a taxa significativamente mais baixa de trombose de stent (1,13% vs 2,35%; HR 0,48; p<0,0001), o prasugrel deve ser considerado especialmente nos doentes com trombose de stent tratados com clopidogrel. Em pacientes submetidos a ICP para ACS (STEMI ou NSTEMI), o prasugrel é preferível ao clopidogrel na ausência de contra-indicações apropriadas. Estes incluem o estatuto pós CVI ou TIA, uma vez que existe um perfil de risco de benefício desfavorável para este grupo. Da mesma forma, a prescrição deve ser evitada em pessoas com mais de 75 anos de idade e em doentes com um baixo peso corporal de <60 kg. Se no entanto for considerado necessário, a terapia de manutenção deve ser administrada numa dosagem reduzida de 5 mg/d.
Ticagrelor: Ticagrelor é um inibidor reversível P2Y12 que também inibe a recaptação do ADP via ENT-1 (Equilibrative Nucleoside Transporter). A meia-vida do plasma é de 6-12 h. A dose de carregamento é de 180 mg, seguida de uma dose de manutenção de 2× 90 mg/d. Tal como o prasugrelor, o ticagrelor tem um início de acção acelerado e mais previsível em comparação com o clopidogrel e uma regeneração mais rápida da função plaquetária após a descontinuação. Os metabolitos do sistema CYP3A4 como a sinvastatina são aumentados nos níveis de plasma por ticagrelor, enquanto os inibidores de CYP3A4 (por exemplo, diltiazem) aumentam os níveis de ticagrelor. No ensaio PLATO, cerca de 18 000 pacientes com ACS foram tratados com clopidogrel ou ticagrelor [14]. Após 12 meses, foi observada uma redução significativa no ponto final primário de enfarte do miocárdio, morte vascular e AVC com ticagrelor (9,8% vs. 11,7%; FC 0,84; p=0,001). A taxa de mortalidade não vascular foi também significativamente reduzida no grupo do ticagrelor (4% vs. 5,1%; p=0,001). A frequência de grandes hemorragias não relacionadas com a CABG foi significativamente maior com o ticagrelor (4,5% vs. 3,8%; p=0,03). A taxa global de hemorragia fatal não diferiu significativamente entre grupos, embora a taxa de hemorragia intracraniana fatal tenha aumentado significativamente com o ticagrelor (0,1% vs. 0,001%; p=0,02). O Ticagrelor estava mais associado a efeitos secundários comuns tais como dispneia sem correlato morfológico (13,8% vs. 7,8%), pausas ventriculares e hiperuricemia assintomática. Tal como o prasugrelor, o ticargrelor é preferido à terapia de clopidogrel após ACS (1B).
Cangrelor: Cangrelor é um analógico ATP que é administrado por via intravenosa e liga-se reversivelmente ao receptor P2Y12 com grande afinidade. A meia-vida do plasma é muito curta aos dez minutos. Exerce uma potente inibição da activação de plaquetas dependente de ADP e permite uma rápida recuperação da função de TC logo uma a duas horas após a paragem da infusão. Três ensaios em grande escala compararam cangrelor – iniciados antes do PCI – com clopidogrel administrado antes/depois do PCI ou de acordo com a prática local (CHAMPION-PCI; CHAMPION-PLATFORM; CHAMPION-PHOENIX). Uma meta-análise [15] demonstrou uma redução de 19% no risco relativo de mortalidade periprocedural, enfarte do miocárdio, revascularização do vaso alvo e trombose do stent com cangrelor. O risco relativo de trombose de stent por si só foi mesmo reduzido em 39%. Isto mais uma vez veio ao preço de um aumento significativo da taxa de sangramento (cangrelor 0,9% vs. clopidogrel 0,6%; OR 1,38; p=0,007). Cangrelor é aprovado como adjunto da ICP em pacientes sem pré-tratamento com inibidores P2Y12 e sem bloqueio de receptores GP IIb/IIIa.
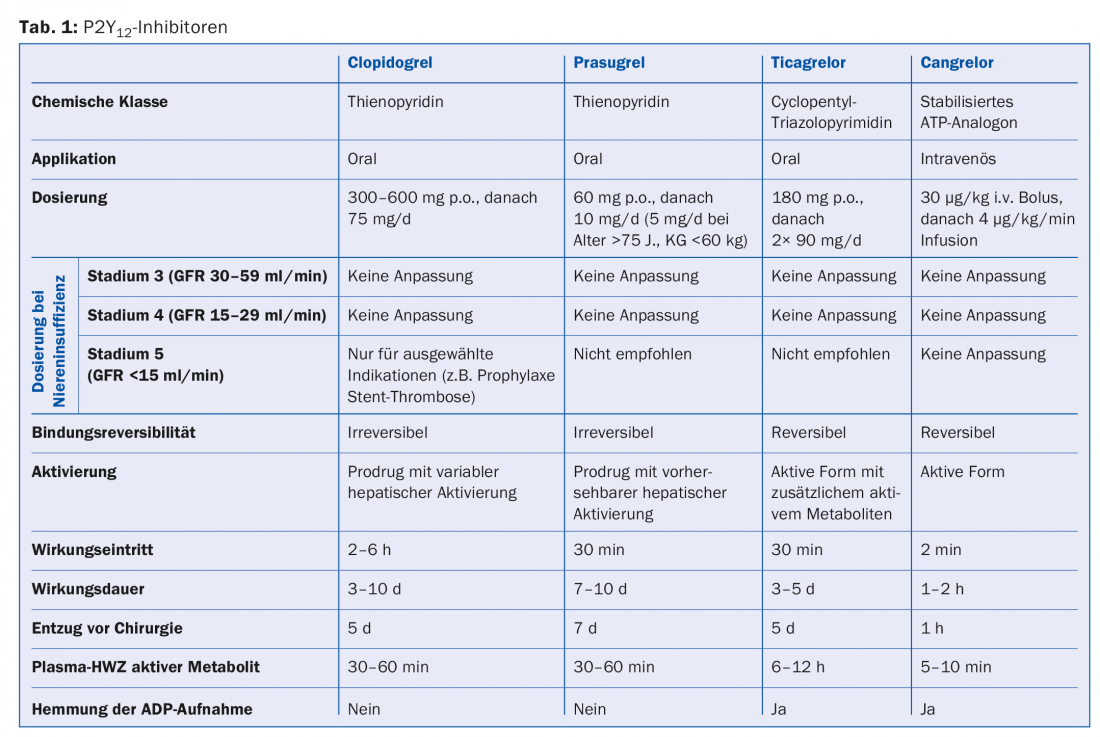
O quadro 1 dá uma visão geral dos inibidores P2Y12 em uso.
GP IIb/IIIa inibidores dos receptores
Abciximab, eptifibatide, tirofibã: Os inibidores de GP IIb/IIIa aplicados intravenosamente inibem a agregação bloqueando a ligação do fibrinogénio aos receptores de GP IIb/IIIa activados nas plaquetas adjacentes. Uma meta-análise de seis ensaios clínicos aleatórios com mais de 29 000 doentes mostrou uma redução de 9% no risco relativo de morte e enfarte do miocárdio não fatal ao adicionar inibidores de GP IIb/IIIa à terapia com heparina [16]. O efeito positivo foi maior nos pacientes que foram submetidos a ICP. Verificou-se que o risco de hemorragia grave mas não intracraniana foi significativamente aumentado. Deve notar-se aqui que a maioria dos estudos precedeu a utilização generalizada de inibidores P2Y12 e as combinações com prasugrel e ticagrelor nunca foram estudadas prospectivamente. Assim, os inibidores GP IIb/IIIa em combinação com estes medicamentos e também em pacientes em anticoagulação oral devem ser reservados apenas para situações de emergência. Em caso de deficiência da função renal com uma taxa de filtração glomerular <50 ml/min, o eptifibibatide requer um ajuste da dose, enquanto que este só é indicado para o tirofibã a partir de uma taxa de filtração glomerular de <30 ml/min e, no caso do abciximab, os fabricantes recomendam uma cuidadosa consideração da relação risco-benefício. Para um GFR de 15-30 ml/min só é aprovado tirofiban, abaixo do qual é desencorajada a utilização de todas as substâncias.
Antagonista do receptor PAR 1
Vorapaxar: Vorapaxar é um inibidor selectivo oralmente activo do receptor de trombina plaquetária PAR 1. No ensaio TRACER, o vorapaxar foi comparado com placebo para além da terapia padrão em quase 13 000 doentes com NSTEMI. Não houve redução no ponto final primário de morte cardiovascular, IM, IVC, isquemia repetida ou revascularização repetida com vorapaxar (18,5% vs 19,9%; HR 0,92; p=0,07). Por outro lado, ocorreram hemorragias significativamente mais graves e intracranianas com vorapaxar (7,2% vs. 5,2%; HR 1,35; p<0,001). No ensaio TRA 2P-TIMI 50, o vorapaxar foi comparado ao placebo, além da terapia padrão em pouco mais de 24 000 pacientes com st. n. MI, st. n. CVI ou PAVK. Aqui, vorapaxar foi associado a uma redução moderada na morte cardiovascular, IM e IVC durante três anos (9,3% vs. 10,5%; HR 0,87; p=0,001). Isto, por sua vez, veio à custa de taxas de hemorragia intracraniana significativamente aumentadas (1% vs. 0,5%; p<0,001). Consequentemente, o medicamento está contra-indicado em doentes com doença cerebrovascular. Nos EUA, o vorapaxar foi aprovado para a prevenção secundária do IM, embora o benefício moderado deva ser cuidadosamente ponderado contra o risco acrescido de hemorragia.
Inibição da agregação de plaquetas após ICP – utilização de acordo com cenários clínicos
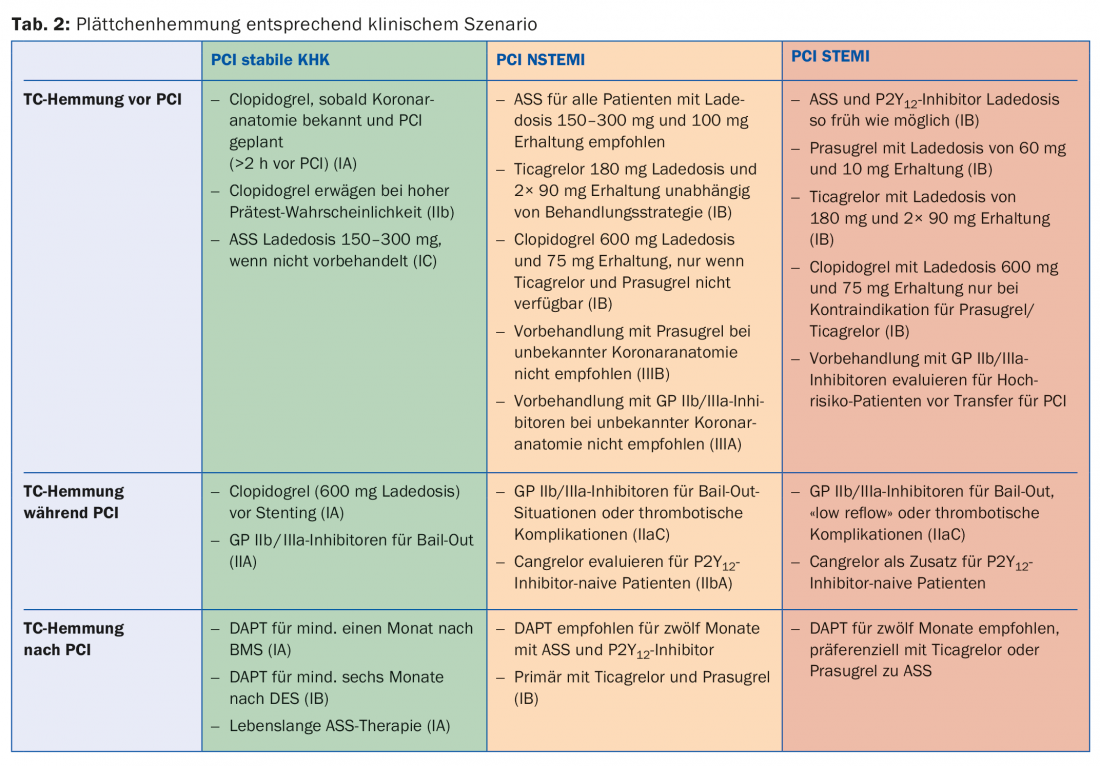
Enquanto a inibição da agregação plaquetária é uma terapia padrão para a doença aterosclerótica, a duração e intensidade variam de acordo com a urgência da doença. A seguir, são discutidos diferentes cenários; o quadro 2 fornece uma visão geral.
Doença arterial coronária estável (SCAD): Recomenda-se geralmente a utilização de uma abordagem radial e de preferência a última geração de DES para PCI (1A). A dupla terapia antiplaquetária (DAPT) em SCAD após PCI consiste geralmente em aspirina e clopidogrel. Todos os doentes com SCAD ou suspeitos de SCAD devem, idealmente, ser pré-tratados com aspirina 100 mg. Se não for este o caso, deve ser aplicada uma dose de carga oral de 150-300 mg antes da PCI electiva. Não há provas de pré-tratamento com clopidogrel antes de uma ICP puramente diagnóstica. No entanto, se a anatomia coronária já for conhecida e a revascularização estiver planeada em conformidade, recomenda-se uma dose de carga de clopidogrel 600 mg pelo menos duas horas antes da ICP. Em pacientes ainda não pré-tratados, recomenda-se uma dose de carga de 600 mg de clopidogrel durante a ICP, uma vez estabelecida a indicação para a endoprótese. A utilização de antagonistas de GP IIb/IIIa sob ICP deve ser reservada para situações de emergência (por exemplo, trombose coronária iminente) no SCAD. Após PCI, recomenda-se o DAPT com clopidogrel 75 mg/d e aspirina 100 mg/d durante um mês após a implantação de BMS (1A) e durante seis meses após a implantação de DES (1B). Depois disso, a monoterapia geralmente com aspirina deve ser continuada de forma óptima para toda a vida (1A). Ficou demonstrado que as circunstâncias de interrupção são importantes para o desenvolvimento de complicações coronárias após a suspensão da dupla antiagregação. Em 50% dos casos, o aborto foi prescrito por um médico e não levou a um aumento do risco de acontecimentos adversos. Nos 14% dos casos em que a hemorragia ou a má conformidade causaram a interrupção, o número de complicações cardíacas relevantes aumentou substancialmente, embora este efeito tenha diminuído após 30 dias [17]. Por conseguinte, uma boa informação e instrução dos pacientes é importante.
NSTEMI: DAPT após NSTEMI consiste em aspirina e um inibidor P2Y12, de preferência ticagrelor ou prasugrel (1B). A aspirina é recomendada para todos os doentes com uma dose de carga de 150-300 mg p.o. (ou 80-150 mg i.v.) em doentes ingénuos com aspirina, seguida de uma dose de manutenção a longo prazo de 100 mg/d. Um inibidor P2Y12 é combinado com aspirina durante geralmente 12 meses (1A). Ticagrelor com uma dose de carga de 180 mg seguida de uma dose de manutenção de 2× 90 mg/d é recomendado para todos os doentes com risco moderado a elevado de isquemia, independentemente da estratégia de tratamento inicial. Isto não exclui pacientes que tenham sido pré-tratados com clopidogrelor, que deve ser suspenso sob ticagrelor. Prasugrel com uma dose de carga de 60 mg seguida de uma dose de manutenção de 10 mg/d é recomendado para pacientes com anatomia coronária conhecida que estão definitivamente submetidos a ICP. Clopidogrel (dose de carga 300-600 mg seguida de 75 mg/d) só deve ser utilizado em doentes com contra-indicações ao ticagrelor ou prasugrel e na anticoagulação oral. Os inibidores GP IIb/IIIa durante a ICP podem ser utilizados em caso de complicações trombóticas ou nas chamadas situações de salvamento (“operações de salvamento”, por exemplo em caso de trombos grandes, fluxo lento ou ausente). O Cangrelor pode ser considerado como um agente adjuvante antiplaquetário em pacientes sem bloqueio prévio P2Y12 e estimado como estando em alto risco. Embora o DAPT seja geralmente recomendado para doze meses, a duração pode ser reduzida para três a seis meses ou prolongada até 30 meses (AII) em doentes seleccionados, dependendo do seu risco individual de hemorragia e isquemia [4]. Para facilitar a tomada de decisões, a AHA recomenda a utilização da pontuação DAPT (tab. 3) nas directrizes actuais. Isto foi concebido no estudo DAPT e validado no estudo PROTECT. Uma pontuação de -2 a 1 indica pacientes cujo risco de hemorragia é 2,5 vezes maior em comparação com o efeito protector anti-isquémico e que, consequentemente, são mais propensos a não beneficiar do DAPT prolongado. Por sua vez, os doentes com uma pontuação de >2 experimentam um benefício oito vezes maior de isquemia evitada em comparação com o risco de hemorragia e são mais susceptíveis de beneficiar [18].

STEMI: Os pacientes com STEMI submetidos a ICP primária devem receber DAPT com aspirina e um inibidor P2Y12 além da anticoagulação parenteral o mais cedo possível (IA). Aspirina com uma dose de carga de 300 mg p.o. é recomendada para todos os pacientes independentemente do possível pré-tratamento para assegurar o bloqueio total da síntese de TXA2. A monoterapia ao longo da vida com 100 mg/d é recomendada na ausência de contra-indicações. Um inibidor P2Y12 deve normalmente ser combinado com aspirina durante 12 meses após a STEMI (IA). O Prasugrel e o ticagrelor (IB) são novamente preferidos aqui, após uma análise conjunta de 48 000 bons pacientes ter demonstrado uma vantagem de sobrevivência sem aumento significativo das taxas de sangramento em pacientes STEMI sob estas substâncias [19]. É importante lembrar que os inibidores mais recentes e mais potentes de P2Y12 devem ser evitados em st. n. (hemorrágica) AVC ou deficiência hepática moderada a grave. Há também uma falta de dados sobre a combinação com (D)OAK, que deve ser evitada. Aqui, ou mesmo se as substâncias não estiverem disponíveis, clopidogrel com 600 mg de carga e 75 mg/d de dose de manutenção continua a ser utilizado (IB). O uso de inibidores GP IIb/IIIa durante a ICP parece ser apropriado no caso de grandes trombos, fluxo lento ou ausente, ou complicações trombóticas (CII) e é comummente utilizado internacionalmente, embora não haja grandes ensaios aleatórios. A chamada aplicação a montante (isto é, já antes da ICP) dos inibidores GP IIb/IIIa é controversa, embora possa ser considerada em pacientes de alto risco que ainda precisam de ser transferidos primeiro (IIB). O Cangrelor pode ser utilizado como ponte/suplemento da ICP em pacientes sem pré-tratamento com inibidores P2Y12 e sem inibidores adicionais de GP IIb/IIIa, de acordo com a prática local.
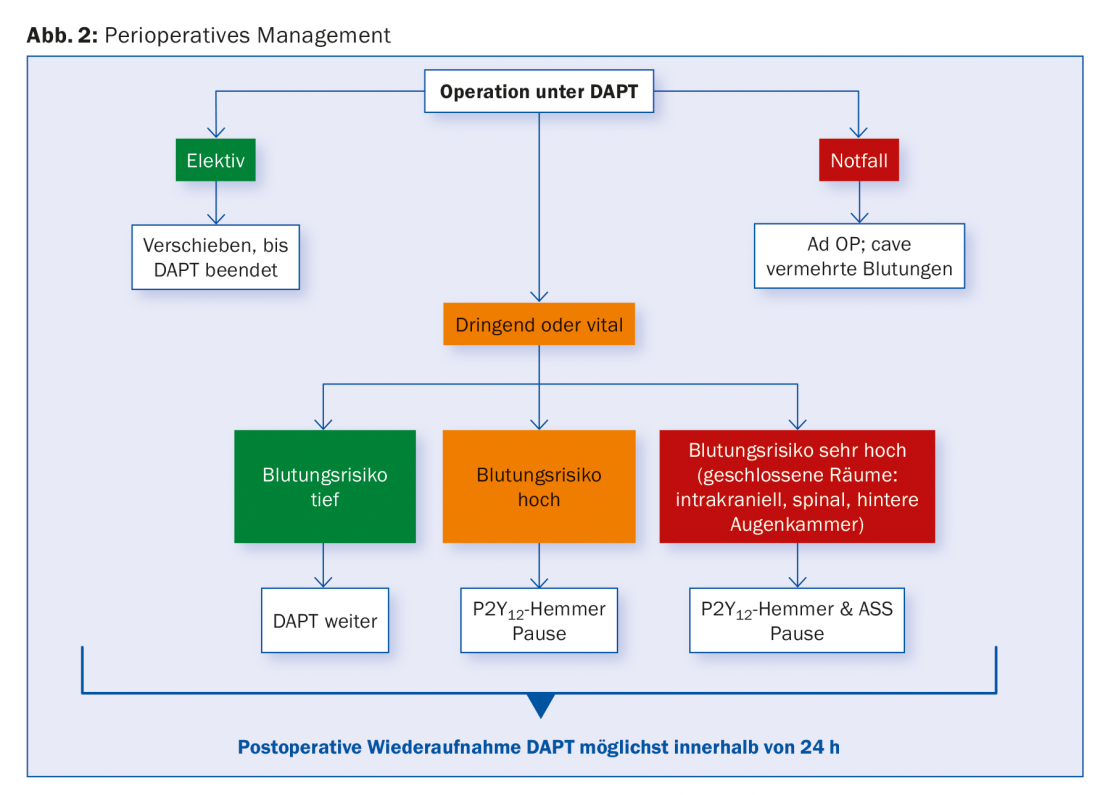
Cirurgia sob DAPT
Para pacientes com SCAD, o DAPT é recomendado por um a seis meses, dependendo do tipo de stent, e geralmente por doze meses para stents após ACS.
Não é raro surgir uma necessidade de cirurgia durante este período, quer em termos de revascularização cirúrgica (CRM), quer de natureza não cardíaca. Também aqui a gestão depende do risco individual de hemorragia e isquemia e deve ser discutida numa base interdisciplinar. Para procedimentos com baixo risco de hemorragia, deve ser procurada a continuação do DAPT. Se isto não for possível, pelo menos a aspirina deve ser deixada no lugar. Os dados de um grande estudo de coorte mostraram que o risco de complicações cardíacas relevantes após a cirurgia foi particularmente aumentado nos primeiros seis meses após a ICP. Não foi possível encontrar diferenças entre os tipos de stents.
Os procedimentos cirúrgicos eletivos devem, idealmente, ser adiados para depois da conclusão da duração recomendada do DAPT. Para procedimentos urgentes que exijam uma interrupção, recomenda-se que se faça uma pausa no clopidogrel e no ticagrelor durante cinco dias, e no prasugrel durante sete dias antes, enquanto se continua com a ASA. Os dados dos doentes com CABG sugerem que as medições de reactividade TC permitem determinar um tempo cirúrgico seguro e podem encurtar a pausa em 50%. Esta seria uma alternativa possível a uma ruptura arbitrária.
Em pacientes de alto risco, por exemplo nos primeiros dias e semanas após a endoprótese, é por vezes sugerida a utilização de antiagregação intravenosa com inibidores GP IIb/IIIa até quatro horas antes do procedimento, embora não haja dados clínicos prospectivos sobre isto. Cangrelor foi estudado no ensaio BRIDGE para a ponte para a CABG em pacientes pré-tratados com inibidor P2Y12. O canguru resultou numa melhor preservação da antiagregação sem aumento da frequência de sangramento [20]. Nenhuma das substâncias recebeu ainda aprovação oficial nesta área. A substituição de um DAPT por LMWH ou UFH não faz sentido. Postoperativamente, recomenda-se retomar todos os inibidores P2Y12 o mais cedo possível. A figura 2 fornece uma visão geral.
Conclusão
A anticoagulação é um princípio chave no tratamento da doença arterial coronária. Vários agentes antiplaquetários e inibidores da coagulação plasmática estão em uso clínico diário. Áreas de aplicação e opções de combinação estão em expansão, tais como a utilização de rivaroxaban de baixa dose após ACS, para além de DAPT. O sucesso clínico das preparações individuais e das suas combinações é determinado, em última análise, por se a eficácia antitrombótica melhorada melhora realmente o prognóstico sem que o possível benefício seja compensado pelo aumento das taxas de hemorragia. Dada a prevalência da doença e o seu grande impacto nas estatísticas das principais causas de morte – e isto já não está limitado ao mundo ocidental – é importante que os clínicos estejam familiarizados com as várias substâncias, as suas indicações, vantagens e desvantagens, a fim de prosseguirem a estratégia óptima para uma população de doentes cada vez mais complexa.
Literatura:
- Warren J: Comentários sobre angina pectoris. N Engl J Med Surg 1812; 1: 1-11.
- Stefanini G, et al: stents de artérias coronárias com efeito de droga. N Engl J Med 2013; 368: 254-265.
- Roger VL, et al: Estatísticas de doenças cardíacas e acidentes vasculares cerebrais – actualização de 2012: um relatório da Associação Americana do Coração. Circulação 2012; 125(22): e1002.
- Task Force sobre Revascularização do Miocárdio da Sociedade Europeia de Cardiologia (ESC) e da Associação Europeia de Cirurgia Cardiotorácica (EACTS): 2014 ESC/EACTS guidelines on myocardial revascularization. European Heart Journal 2014; 35: 2541-2619.
- Bonetti N, Beer JH: Actualização NOAK – um pequeno guia de viagem através de uma paisagem em movimento. Despacho Prático 2016; 12-19.
- O Grupo RISC: Risco de enfarte do miocárdio e morte durante o tratamento com aspirina de baixa dose e heparina intravenosa em homens com doença arterial coronária instável. O grupo RISC. Lancet 1990; 336: 827-830.
- Lewis HD Jr, et al: Efeitos protectores da aspirina contra enfarte agudo do miocárdio e morte em homens com angina instável. Resultados de um estudo cooperativo da Administração de Veteranos. N Engl J Med 1983; 309: 396-403.
- Theroux P, et al: Aspirina, heparina, ou ambas para tratar angina aguda instável. N Engl J Med 1988; 319: 1105-1111.
- Cairns JA, et al: Aspirina, sulfinpirazona, ou ambas em angina instável. Resultados de um ensaio canadiano multicêntrico. N Engl J Med 1985; 313: 1369-1375.
- Yusuf S, et al: Efeitos do clopidogrel para além da aspirina em doentes com síndromes coronárias agudas sem elevação do segmento ST. N Engl J Med 2001; 345: 494-502.
- Mehta SR, et al: Efeitos do pré-tratamento com clopidogrel e aspirina seguido de terapia a longo prazo em pacientes submetidos a intervenção coronária percutânea: o estudo PCI-CURE. Lancet 2001; 358: 527-533.
- Parodi G, et al.: Alta reactividade residual plaquetária após carga de clopi- dogrel e eventos cardiovasculares a longo prazo entre pacientes com síndromes coronárias agudas submetidas a ICP. JAMA 2011; 306: 1215-1223.
- Wiviott SD, et al: Prasugrel versus clopidogrel em doentes com síndromes agudas de cor- onários. N Engl J Med 2007; 357: 2001-2015.
- Wallentin L, et al: Ticagrelor vs. clopidogrel em doentes com síndromes coronárias agudas. N Engl J Med 2009; 361(11): 1045-1057.
- Steg PG, et al: Effect of cangrelor on periprocedural out- comes in percutaneous coronary interventions: a pooled analysis of patient-level data. Lancet 2013; 382: 1981-1992.
- Roffi M, et al.: Inibição da glicoproteína plaquetária IIb/IIIa nas síndromes coronárias agudas. Gradiente de benefício relacionado com a estratégia de revascularização. Eur Heart J 2002; 23: 1441-1448.
- Mehran R, et al: Cessação do tratamento duplo antiplaquetário e eventos cardíacos após intervenção coronária percutânea (PARIS): resultados de 2 anos de um estudo observacional prospectivo. Lancet 2013; 382(9906): 1714-1722.
- Levine GN, et al: Focused Update Writing Group, 2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease. JACC 2016. doi:10.1016/j.jacc.2016.03.513 [Epub ahead of Print].
- Bellemain-Appaix A, et al: Novos inibidores P2Y12 versus clopidogrel em intervenção coronária percutânea: uma meta-análise. J Am Coll Cardiol 2010; 56(19): 1542-1551.
- Angiolillo DJ, et al: Bridging antiplatelet therapy with cangrelor in patients undergoing cardiac surgery: a randomised controlled trial. JAMA 2012; 307(3): 265-274.
PRÁTICA DO GP 2016; 11(6): 22-29