Com o número crescente de opções terapêuticas personalizadas e imuno-oncológicas, a importância dos marcadores preditivos está também a crescer. Até à data, o diagnóstico dos tecidos, incluindo a remoção invasiva de uma biópsia, é necessário para determinar isto. Isto poderá mudar em breve com a introdução da chamada biópsia líquida. No entanto, há ainda alguns obstáculos a ultrapassar antes da implantação em grande escala.
Nos casos em que a análise genética requeria a remoção de tecido tumoral, uma simples amostra de sangue poderia em breve ser suficiente. No âmbito da análise do ácido nucleico com base no sangue através de biopsia líquida , as células tumorais circulantes, o ADN tumoral e o ARN são isolados do sangue venoso e examinados. É um método que só se torna possível através da detecção altamente sensível dos ácidos nucleicos. Se isto puder ser validado para uma utilização generalizada, poderia, entre outras coisas, simplificar significativamente o diagnóstico das mutações do condutor e, assim, a escolha da terapia. Embora ainda faltem procedimentos normalizados e dados a longo prazo, a tecnologia tem experimentado um verdadeiro boom nos últimos anos. Isto reflecte-se num aumento impressionante das contribuições e publicações do congresso. Enquanto a pesquisa PubMed por “biópsia líquida” produz um magro 21 artigos publicados em 2013, o número para 2020 é de 1374 [1]. O novo campo de diagnóstico também parece ser interessante do ponto de vista económico. Como resultado, surgiu um grande número de empresas que se dedicam exclusivamente à investigação e comercialização de biopsias líquidas . O mais famoso destes é provavelmente o GRAIL inicial, que é apoiado por Bill Gates e que se tem dedicado em particular à detecção precoce do cancro através da circulação de ácidos nucleicos tumorais sem células [2].
ADN tumoral no sangue
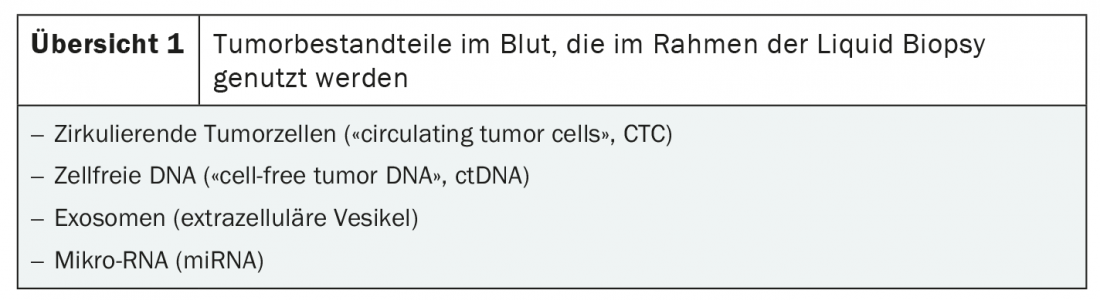
O pré-requisito para a biopsia líquida é o isolamento dos componentes tumorais no sangue. Existem duas fontes principais de ADN maligno: células tumorais circulantes (CTC) e ADN tumoral livre de células (ctDNA). Além disso, a biopsia líquida pode ser utilizada para identificar tumores. exosomas e microRNA (miRNA) podem ser detectados (visão geral 1) [3]. O procedimento baseia-se em métodos altamente sensíveis de detecção de ácidos nucleicos, tais como sequenciação paralela (NGS), PCR e análises unicelulares [3,4].
As diferentes abordagens são utilizadas em diferentes áreas com base nas suas vantagens e desvantagens. Por exemplo, a heterogeneidade do tumor pode ser mapeada através da análise do ctDNA, enquanto que é mais difícil fazer uma declaração sobre a composição do tumor global utilizando células tumorais circulantes. Em ambos os casos, poderia ser mostrado um valor prognóstico do exame para várias malignidades: Quanto mais células tumorais circulantes, bem como ADN livre de células, forem detectadas, maior será o risco de recorrência e progressão. Além disso, o grau do tumor e o estágio correlacionam-se com a carga de ctDNA. Mas as possibilidades de diagnóstico vão muito além dessas análises quantitativas. As mudanças qualitativas são também de importância prognóstica e preditiva. Podem não só ser utilizados para identificar alvos terapêuticos e aberrações genéticas, mas também servir como parâmetros de progressão que podem ser utilizados para avaliar a resposta terapêutica no futuro. Por exemplo, a persistência da expressão PD-L1 em células tumorais circulantes sob bloqueio de ponto de controlo adequado é classificada como prognosticalmente desfavorável [5]. Conclusões semelhantes aplicam-se à terapia com inibidores de tirosina quinase em doentes com cancro do pulmão: Em resposta, o nível de ctDNA para mutações do receptor do factor de crescimento epidérmico (EGFR) cai [6]. Em geral, uma instabilidade por microsatélite (MSI) no ctDNA, entre outras coisas, parece indicar uma fase avançada do tumor. Muitas investigações neste campo estão actualmente em pleno andamento, e com o número crescente de alvos terapêuticos e marcadores preditivos, há inúmeras outras questões à espera de serem testadas quanto à adequação para a biopsia líquida .
De exossomas e micro RNA
No entanto, não só as células tumorais circulantes e o ctDNA são objecto de investigação actual, mas também outros componentes tumorais que podem ser detectados no sangue: Exosomas e microRNA (miRNA). Estes últimos são pequenos fragmentos de ARN, não codificantes. Estes estão envolvidos na regulação da proliferação, diferenciação celular e apoptose e, portanto, funcionam como oncogenes ou genes supressores de tumores [7]. Clinicamente, o miRNA é particularmente promissor como biomarcador, porque o nível de expressão está correlacionado com mudanças malignas. E este é frequentemente o caso mesmo antes das alterações fenotípicas se tornarem detectáveis [8]. Além disso, cada malignidade tem uma assinatura característica do miRNA – uma grande vantagem quando se trata de determinar a origem tecidual de um tumor mal diferenciado. Seja na detecção precoce ou para clarificar a identidade do tumor, o miRNA será provavelmente ouvido ainda mais nos próximos anos.
Neste contexto, uma análise de exosomas, ou seja, vesículas extracelulares, é também interessante. Porque estes contêm concentrações elevadas de miRNA. Como presumivelmente todas as células, as células tumorais também secretam as vesículas de origem endossómica. O seu papel ainda não é em grande parte claro, mas está a ser intensamente investigado. Por exemplo, há indicações de que os exosomas tumorais podem promover a angiogénese ou inactivar anticorpos terapêuticos através da expressão de antigénios tumorais.
Quer ctDNA, células tumorais circulantes, miRNA ou exossomas – A Biópsia Líquida vem em consideração para numerosas áreas de aplicação. O método poderia ser particularmente adequado para a detecção precoce de tumores, caracterização genética e como parâmetro de progressão durante a terapia [4]. As vantagens são óbvias: o diagnóstico menos invasivo, que também é possível na ausência de tecido tumoral e, para além disso, é comparativamente de baixo risco, significa que se pode obter uma imagem dinâmica do perfil genético do tumor. Por um lado, as recidivas podem ser detectadas precocemente e, por outro lado, o seu perfil molecular frequentemente alterado pode ser decifrado por amostragem de sangue – e atacado em conformidade. Se a biopsia líquida se estabelecer como um método padrão, isto significaria provavelmente outro marco na era do planeamento terapêutico personalizado.
Desenvolvimento adicional necessário
Mesmo que muita investigação já tenha sido feita, o processo está ainda na sua infância. Por conseguinte, existem ainda grandes incertezas na avaliação e também na implementação. A aplicabilidade parece diferir significativamente entre os diferentes tipos e fases do tumor. Por exemplo, o ctDNA só é detectável em cerca de 70% das malignidades metastáticas. Em muitas entidades tumorais, uma proporção significativa de doentes quase não tem ctDNA. No caso de tumores cerebrais, a utilização da análise ctDNA é questionável devido à barreira hemato-encefálica, uma vez que apenas muito poucos fragmentos de ADN entram mesmo no sangue [3,4]. Com novos aumentos na sensibilidade dos métodos de medição, estas limitações podem provavelmente ser combatidas de forma cada vez mais eficiente nos próximos anos. No entanto, algumas optimizações técnicas ainda têm de ser feitas antes de poderem ser utilizadas na prática clínica diária [4].
A fim de permitir uma aplicação mais ampla, existe actualmente também uma falta de normalização e de gestão da qualidade dos métodos. Os peritos concordam com isto e exigem, entre outras coisas, a definição de valores de corte claros e painéis estandardizados. É também necessário determinar até que ponto os vários marcadores são capazes de representar a heterogeneidade dos tumores. A possibilidade de registar as características moleculares de uma malignidade mais completamente do que, por exemplo, através de uma biopsia clássica, poderia representar outra vantagem decisiva do novo método. O significado da biopsia líquida na detecção precoce do cancro, com todos os seus dilemas, continua por ver. Neste contexto, a relevância de uma descoberta “patológica” deve ser analisada em pormenor, especialmente no que diz respeito ao risco real de doença, antes de se proceder a uma utilização mais ampla de diagnósticos [4]. Portanto, há ainda um longo caminho a percorrer antes de ser posto em prática diariamente, o que certamente continuará a ser excitante nos próximos anos.
Fonte: Wallesch M, Wirth M, Wollenberg B: “Biópsia líquida” como figura chave em imuno-oncologia. OTORRINOLARINGOLOGIA. 2020; 68(12): 899-904.
Literatura:
- (acedido em 07.03.2021)
- https://grail.com/ (acedido em 07.03.2021)
- Nitz P: Biopsia Líquida. Sociedade Alemã contra o Cancro; 2018. www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/diagnosemethoden/liquid-biopsy.html (acedido em 07.03.2021)
- Dahl E: Diagnóstico: Biopsia Líquida – Estado 2016. Dtsch Arztbl. 2016; 113(4). DOI: 10.3238/PersOnko/2016.09.30.01
- Hofman P, et al.: Biopsia líquida na era da imuno-oncologia: está pronta para utilização em horário nobre para doentes com cancro? Ann Oncol. 2019; 30(9): 1448-1459.
- Thress KS, et al: A mutação adquirida EGFR C797S medeia a resistência ao AZD9291 no cancro do pulmão de células não pequenas que alberga o EGFR T790M. Nat Med. 2015; 21(6): 560-562.
- Iorio MV, Croce CM: Desregulação do MicroRNA no cancro: diagnóstico, monitorização e terapêutica. Uma análise abrangente . EMBO Mol Med. 2017; 9(6): 852.
- du Rieu MC, et al: MicroRNA-21 é induzido precocemente em lesões precursoras do adenocarcinoma ductal pancreático. Clin Chem. 2010; 56(4): 603-612.
InFo ONCOLOGy & HEMATOLOGy 2021; 9(2): 42-43