Muitas vezes, é dada pouca atenção aos linfomas cutâneos. E, no entanto, muito aconteceu nos últimos anos. Assim, estão também a surgir opções de tratamento inovadoras para estas doenças raras através de novas opções terapêuticas, tais como conjugados de anti-corpos, imunoterapia e vírus oncolíticos. A caracterização genética e imunobiológica cada vez mais precisa permite também diagnósticos cada vez mais diferenciados.
Muitas vezes, é dada pouca atenção aos linfomas cutâneos. E, no entanto, muito aconteceu nos últimos anos. Isto foi deixado claro por vários peritos de Zurique, Leiden e Birmingham no Congresso da EADO deste ano. Assim, estão também a surgir opções de tratamento inovadoras para estas doenças raras através de novas opções terapêuticas, tais como conjugados de anti-corpos, imunoterapia e vírus oncolíticos. A caracterização genética e imunobiológica cada vez mais precisa permite também diagnósticos cada vez mais diferenciados, tanto para linfomas cutâneos primários de células B como para linfomas de células T.
Linfomas cutâneos primários de células B: de vírus oncolíticos e pontos de controlo imunitário
Enquanto os linfomas cutâneos são mais comummente considerados como neoplasmas de células T, cerca de um em cada cinco linfomas cutâneos primários é um linfoma de células B. Distinguem-se três subtipos: linfoma cutâneo primário da zona marginal, linfoma cutâneo folicular primário e linfoma cutâneo primário de grandes células B. Segundo o Dr. med. Egle Ramelyte do Hospital Universitário de Zurique, novas possibilidades terapêuticas poderiam abrir-se num futuro próximo para todas as entidades, por exemplo através da utilização orientada de vírus oncolíticos. Isto já foi aprovado para o tratamento do melanoma maligno desde 2015 e foi também testado recentemente em neoplasias cutâneas de células B [1]. Através da injecção intralesional do vírus geneticamente modificado do herpes simplex 1 talimogene laherparepvec (T-VEC). resultados promissores foram alcançados.
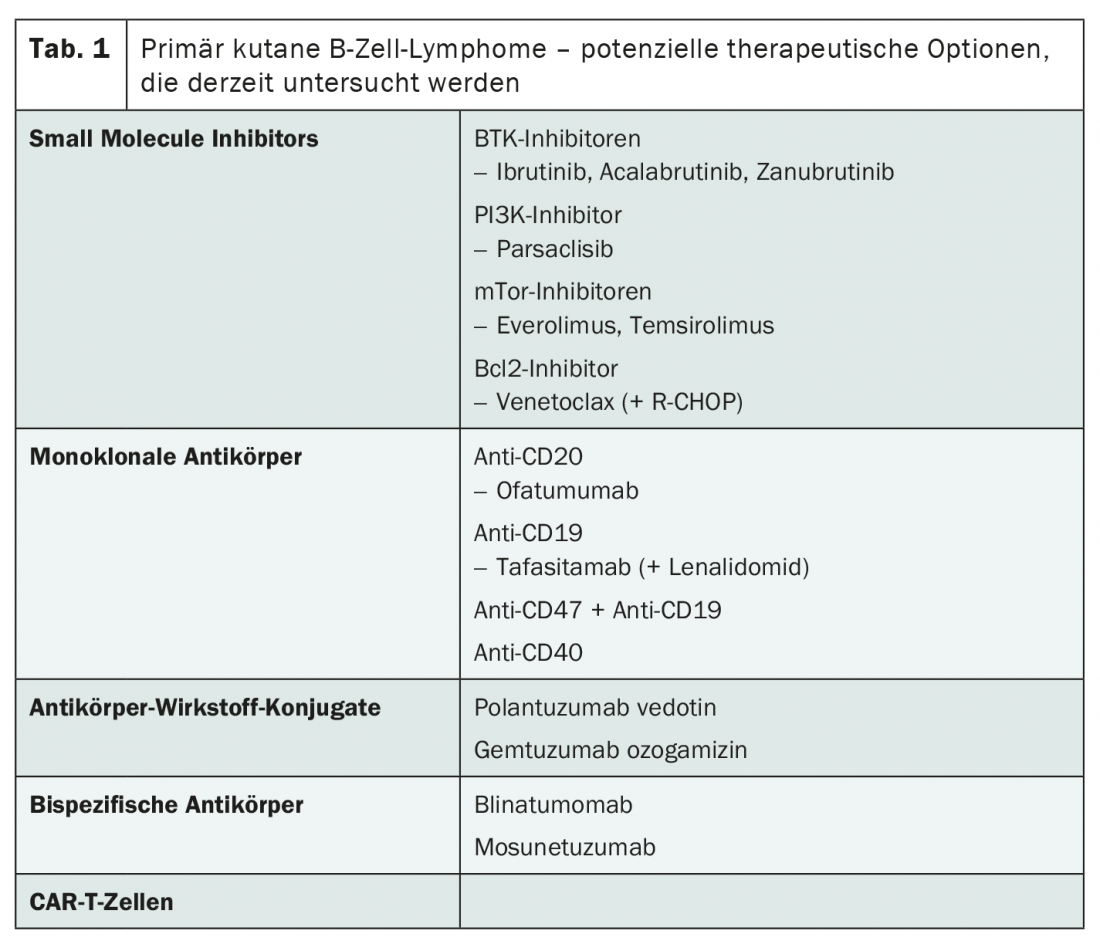
O actual panorama de investigação também tem muito a oferecer em termos de terapia para fases avançadas. Embora a maioria dos compostos esteja a ser investigada no linfoma difuso nodal de grandes células B (DLBCL), os resultados do estudo devem também ser relevantes para linfomas cutâneos primários de células B, diz Ramelyte. Assim, poderá em breve haver alternativas à radioterapia, rituximab e quimioterapia usando o R-CHOP. Para além de pequenos inibidores de moléculas e anticorpos monoclonais, conjugados anti-corpos, anticorpos bisespecíficos e células CAR-T entram em particular em consideração (Tab. 1) . Estes últimos já estão aprovados na Suíça para o tratamento de DLBCL recaídas ou refractários – com grande sucesso.
Em contraste com outras opções imunoterapêuticas como os anticorpos bisespecíficos, que ligam a célula tumoral, por um lado, e as próprias células T do corpo, por outro, e assim conduzem à luta contra a malignidade, o perito vê menos hipóteses de sucesso para os inibidores de pontos de controlo na terapia das neoplasias cutâneas de células B. Embora estes tenham alterado o panorama terapêutico dos tumores sólidos a longo prazo, tiveram pouco sucesso com neoplasias hematológicas, à excepção do linfoma de Hodgkin. A taxa de resposta em DLBCL à terapia combinada anti-PD1/anti-CTLA4 é inferior a 30%, disse Ramelyte. No entanto, vários tratamentos combinados com inibidores de pontos de controlo estão actualmente a ser testados. Além disso, o LAG3, um potencial novo ponto de controlo imunitário que é expresso por mais de 70% do DLBCL, está a ser investigado. É provável que o LAG3 esteja associado a um prognóstico mais pobre, de acordo com um estudo recente, independente do Índice Prognóstico Internacional [2]. Este novo ponto de controlo poderia, portanto, ganhar relevância tanto diagnóstica como terapêutica.
Também de importância diagnóstica podem ser descobertas nos campos da genética de tumores e da imuno-histoquímica. Actualmente, o valor dos dois marcadores imunohistoquímicos IRTA1 e MNDA, que têm sido utilizados principalmente para o diagnóstico de linfomas MALT extracutâneos, está a ser testado [3]. Foi também demonstrado nos últimos anos que a maioria dos DLBCL cutâneos – quase 80% – carrega uma mutação no gene MYD88. Isto leva a uma activação do factor de transcrição NF-κB. Nos tumores cujo gene MYD88 não sofreu mutação, outra mutação que activa a NF-κB pode ser detectada na maioria dos casos [4].
Linfomas cutâneos de células T: da citometria de fluxo à variância genética
De acordo com os resultados actuais da investigação, a paisagem genética dos linfomas cutâneos de células T é muito mais heterogénea do que a dos DLBCL cutâneos. Isto poderia ser analisado com mais detalhe através da utilização da Next Generation Sequencing. Globalmente, houve grandes diferenças genéticas tanto entre os indivíduos afectados, como também dentro do mesmo tumor. Em particular, segundo o Prof. Maarten Vermeer, MD, Chefe do Departamento de Dermatologia do Hospital Universitário de Leiden, Holanda, a integridade genómica é afectada por mutações P53, várias vias de sinalização, tais como as vias de sinalização NF-κB e JAK/STAT, e a paisagem epigenética é afectada por aberrações genómicas. Apesar da diversidade do quadro, as alterações características da metilação do ADN e da modificação do historial podem ser de valor diagnóstico e servir potencialmente como marcadores no futuro – com nomes como CMTM2, PROM1 ou GNMT [5,6]. Isto deve-se à falta de instrumentos de diagnóstico fiáveis para a identificação clara de linfomas cutâneos de células T. E essa não é a única desvantagem da grande variação genética: Vermeer alerta para a potencial resistência a terapias direccionadas através da selecção de subpopulações de células tumorais.
Mesmo que ainda hoje haja alguma incerteza no diagnóstico, especialmente no campo do diagnóstico do sangue, foram feitos importantes progressos desde a era da identificação morfológica das células tumorais circulantes. A classificação correcta de tais células malignas circulantes é importante na medida em que é crucial para a encenação e, portanto, para o prognóstico e a terapia. A introdução generalizada da citometria de fluxo para encenação tornou possível a sua normalização e melhoria nos últimos anos, embora a normalização do procedimento e a identificação de marcadores adequados continuem a colocar desafios [7].
Prognóstico e terapia em transição
Existem ainda incertezas quanto aos factores prognósticos dos linfomas cutâneos de células T. No entanto, novos marcadores prognósticos, tais como a carga total de mutação e a frequência de clones tumorais (TCF) na lesão, surgiram nos últimos anos. Um TCF de mais de 25% foi um preditor de progressão mais forte do que todos os outros factores de prognóstico estabelecidos no estudo correspondente [8]. Um pré-requisito para a determinação de TCF é a identificação do clone da célula T, que pode agora ser realizada por meio de sequenciação de alto rendimento com sensibilidade significativamente maior do que com a PCR tradicional (reacção em cadeia da polimerase) . No entanto, este método é caro e só é utilizado em alguns centros até agora. A fim de finalmente criar clareza no campo dos prognósticos, foi lançado em 2015 o estudo PROCLIPI (Prospective Cutaneous Lymphoma International Prognostic Index Study), no qual são continuamente recolhidos dados e materiais definidos para um biobank especialmente criado para o efeito. Está planeado um estudo com a duração de 10 anos, e 1991 já foram recrutados pacientes de 19 países.
Para além de investigar factores prognósticos, o estudo PROCLIPI tem também como objectivo avaliar as terapias actuais. Desde 2017, três novas substâncias foram aprovadas na União Europeia para o tratamento de linfomas cutâneos de células T: Brentuximab vedotin, Mogamulizumab e Chlormethine Gel. A primeira está também disponível na Suíça. Enquanto o gel de clormetina pode ser utilizado para terapia tópica em todas as fases de micose fungóide, o anti-corpo conjugado brentuximab vedotina e o anticorpo monoclonal mogamulizumab são utilizados para o tratamento de linfomas cutâneos recorrentes de células T.
Mesmo com estes desenvolvimentos, o transplante alogénico de células estaminais, realizado desde 1980, continua a ser a única opção curativa. Melhorias nos métodos de esgotamento das células T, regimes menos intensivos e novos conhecimentos sobre a gestão da doença enxerto-versus-hospedeiro (GvHD) também a tornaram mais tolerável. Uma revisão publicada em 2019 relatou uma mortalidade de 1 ano de 15% com uma taxa de recorrência de 50% [9]. Neste contexto, a Prof. Doutora Julia Med. Scarisbrick do Hospital Universitário de Birmingham, Inglaterra, salientou que o uso precoce de transplante alogénico de células estaminais deveria ser cada vez mais avaliado. Finalmente, uma resposta completa a qualquer terapia é rara em fases avançadas, e os transplantes para doentes com doenças residuais não provaram ser eficazes. Por conseguinte, ela pediu uma avaliação do transplante de células estaminais na primeira remissão.
Fonte: Symposium SY13 “Linfomas cutâneos: o que há de novo”, pelo Prof. Dr. med. Maarten Vermeer (Leids Universitair Medisch Centrum), Dr. med. Egle Ramelyte (Hospital Universitário de Zurique) e Prof. Dr. Julia Scarisbrick (University Hospital Birmingham), 15 de Abril de 2021, 10º Congresso Mundial de Melanoma/17. EADO Congress, o congresso teve lugar virtualmente.
Literatura:
- Ramelyte E, et al.: viroterapia oncolítica – resposta anti-tumoral mediada: uma perspectiva de célula única. Célula cancerígena. 2021; 39(3): 394-406. e4.
- Keane C, et al: LAG3: um novo ponto de controlo imunitário expresso por múltiplos subconjuntos de linfócitos em linfoma difuso de grandes células B. Blood Adv. 2020; 4(7): 1367-77.
- Wang Z, Cook JR: Expressão IRTA1 e MNDA no Linfoma da Zona Marginal: Utilidade no Diagnóstico Diferencial e Implicações para a Classificação. Am J Clin Pathol. 2019; 151(3): 337-343.
- Zhou XA, et al: Genomic Analyses Identify Recurrent Alterations in Immune Evasion Genes in Diffuse Large B-Cell Lymphoma, Leg Type. J Invest Dermatol. 2018; 138(11): 2365-2376.
- Qu K, et al.: Chromatin Accessibility Landscape of Cutaneous T Cell Lymphoma and Dynamic Response to HDAC Inhibitors. Célula cancerígena. 2017; 32(1): 27-41. e4.
- van Doorn R, et al.: Epigenomic Analysis of Sézary Syndrome Defines Patterns of Aberrant DNA Methylation and Identifies Diagnostic Marcadores. J Invest Dermatol. 2016; 136(9): 1876-1884.
- Scarisbrick JJ, et al: Desenvolvimentos na compreensão do envolvimento do sangue e estágio na micose fungóide/síndrome de Sezary. Eur J Cancro. 2018; 101: 278-280.
- de Masson A, et al: Sequenciamento de alto rendimento do receptor da célula T β gene identifica micose fungoides agressivos de fase inicial. Sci Transl Med. 2018; 10(440).
- Johnson WT, et al: Transplante alogénico de células estaminais hematopoiéticas em fase avançada de micose fungóide e síndrome de Sézary: uma revisão concisa. Chin Clin Oncol. 2019; 8(1): 12.
InFo ONCOLOGY & HEMATOLOGY 2021; 9(3): 28-29 (publicado 15.6.21, antes da impressão).