No SGIM Great Update em Interlaken, foram discutidos os problemas e desafios mais comuns que os médicos de clínica geral enfrentam quando lidam com pacientes com linfoma. É difícil dar nomes significativos: Como nomear as mais de 70 entidades de linfomas malignos para que permaneçam compreensíveis para o doente e os seus familiares? O diagnóstico e acompanhamento são também da responsabilidade do prestador de cuidados primários.
O Prof. Dr. med. Andreas Lohri do Hospital Cantonal Baselland abriu a sua apresentação com dados epidemiológicos: “Os registos de cancro suíços contam cerca de 1600 linfomas malignos por ano, um bom terço dos casos terminam fatalmente. Isto faz dos linfomas juntos um dos tipos de cancro mais difundidos, mas se se seguir a classificação da OMS, este grupo é dividido em mais de 70 entidades diferentes”.
Mais de 70% dos doentes com linfoma de Hodgkin estão livres de doenças após dez anos. Para os linfomas de células B, que são os linfomas mais comuns, o número é de 40%, e para as variantes de células T apenas 20%. Entre 2001 e 2010, registou-se um total de 16 000 novos casos de linfoma, dos quais cerca de 6000 pacientes sobreviveram à doença.
“Se se quiser nomear a entidade específica, torna-se difícil. Embora ainda seja relativamente claro no caso do linfoma de Hodgkin, o clínico geral geralmente não sabe que nome dar ao linfoma difuso de grandes células B (DLBCL), por exemplo, para que a condição também seja compreensível para o doente e os seus familiares. Normalmente recai então no termo realmente obsoleto “linfoma não-Hodgkin”. A organização suíça de doentes com linfomas e seus familiares fornece, portanto, ao doente informações específicas sobre os doze linfomas mais comuns, incluindo os nomes”, diz o Prof. Lohri.
Reconheceria um linfoma?
Os sintomas podem ser pouco claros ou conduzir na direcção errada. Um inquérito mundial envolvendo 1606 doentes com várias doenças linfoma mostrou que cerca de 50% visitaram o médico pela primeira vez porque tinham uma consulta de controlo de qualquer forma, ou porque geralmente não se sentiam bem. “Assim, os sintomas iniciais são bastante inespecíficos e o estudo também mostrou que demorou mais de cinco meses para que 30% dos pacientes fossem correctamente diagnosticados desde a sua primeira visita ao médico”, explicou o Prof Lohri. “Cerca de metade de todos os linfomas são extranodais e apresentam uma grande variedade de sintomas: neurológicos como nos linfomas do SNC, cutâneos como nos linfomas de células T, ou renais e cardíacos nos linfomas produtores de amilóides. Os sintomas típicos de B tornam-se aparentes bastante tarde, mas mesmo antes disso, alguns pacientes queixam-se de fadiga e depressão”.
Um diagnóstico correcto, de preferência feito em colaboração com um especialista, é portanto crucial. Basicamente, isto inclui:
- um historial médico (sintomas B, historial familiar)
- um laboratório (Hb, Lc, Tc, CRP, EBV, HBV, HCV, HIV, Toxoplasma, Bartonella)
- um estado (gânglios linfáticos, alas, baço, fígado, ORL, pele)
- uma biópsia (estão disponíveis vários exames de tecido: IHC, FACS, citogenética, PCR, FISH).
- imagem.
“O PET fornece dados muito bons sobre a progressão da doença, dá indicações para o prognóstico e facilita as decisões de tratamento”, diz o Prof. Lohri.
Como é que o médico de família acompanha a terapia?
Uma vez confirmado o diagnóstico, o tratamento é geralmente efectuado pelo especialista; o médico de clínica geral pode tratar das contagens de sangue provisórias e da administração de factores de crescimento e antibióticos.
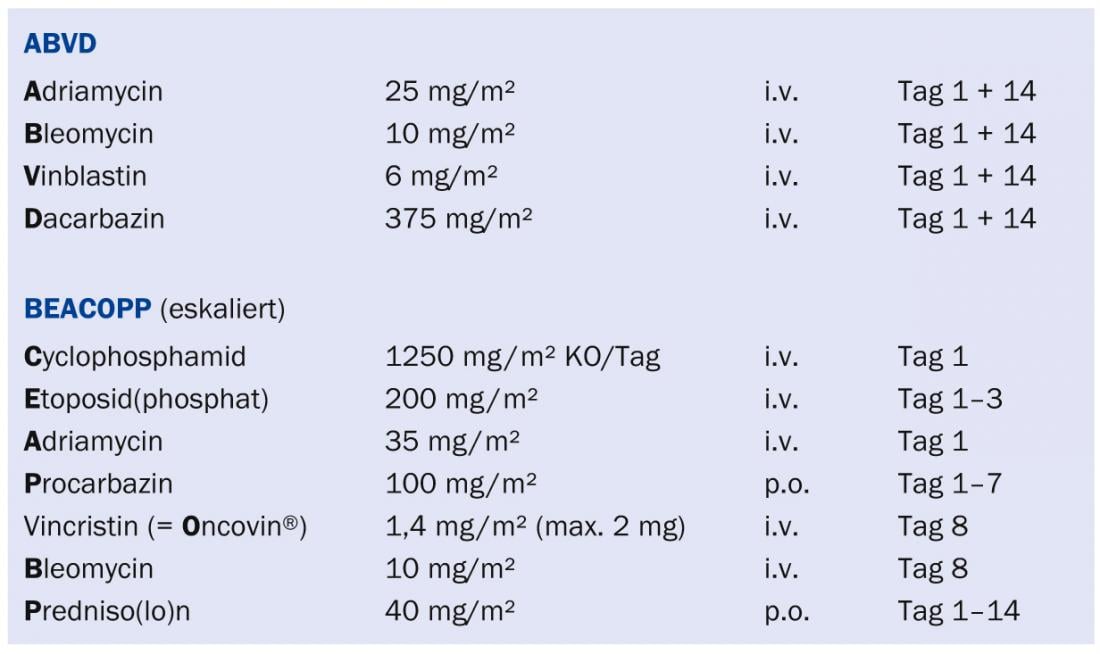
“Os algoritmos terapêuticos devem ser planeados de forma óptima numa conferência interdisciplinar. Basicamente, a terapia visa curar o paciente com um regime tão não tóxico quanto possível e que não cause quaisquer efeitos secundários mais tarde. Este objectivo não foi alcançado até à data. Por conseguinte, são necessárias novas vias de investigação para optimizar ainda mais o tratamento. No entanto, não se deve esquecer o grande progresso que tem sido feito com os regimes terapêuticos actualmente utilizados (especialmente com o regime ABVD para linfoma limitado de Hodgkin e o regime BEACOPP para linfoma avançado de Hodgkin) (ver caixa) . Para a célula B e muitos outros linfomas, o regime R-CHOP (com o rituximab de anticorpos) tem-se revelado muito eficaz. Para as formas indolentes, as combinações de bendamustina estão a tornar-se cada vez mais importantes. Este medicamento tem um excelente índice terapêutico, sendo as suas principais toxicidades as citopénias e as erupções cutâneas. As terapias por radiação são hoje menos utilizadas no ambiente curativo porque os efeitos tardios podem ser consideráveis”, explicou o Prof. Lohri.
Quanto tempo são necessários os exames de seguimento?
Antes do ano 2000, muitos pacientes de Hodgkin recebiam doses de radiação, algumas delas grandes. De acordo com estudos recentes, a irradiação mediastinal aumenta significativamente o risco de doença cardíaca 10 a 25 anos após o tratamento [1]. Uma vez que o clínico geral é responsável pelo acompanhamento dos chamados “sobreviventes do linfoma”, ele ou ela tem também o papel decisivo de reconhecer e diagnosticar correctamente tais complicações tardias.
No acompanhamento de pacientes irradiados, o Colégio Americano de Radiologia recomenda o rastreio através de uma prova de stress e ecocardiografia de cinco a dez anos após o tratamento, devido ao aumento do risco cardíaco.
O risco de segundos tumores também aumenta após a radioterapia: um estudo mostrou que cerca de 10% das pacientes que receberam radioterapia aos 20 anos de idade desenvolveram cancro da mama por volta dos 50 anos de idade [2]. Recomenda-se portanto uma ressonância magnética da mama e uma mamografia a partir de dez anos após a radioterapia.
Um olhar sobre o futuro
Finalmente, o Prof. Lohri falou de algumas inovações relevantes na terapia e no diagnóstico do linfoma:
- O PET permitirá uma cura com tratamentos menos agressivos no futuro.
- A radiação será evitada no cenário curativo no futuro.
- Muitas novas drogas moleculares e imunoterapêuticas estão em desenvolvimento: tais como inibidores da tirosina quinase (ibrutinibe), imunomoduladores, anticorpos de segunda geração.
“O médico de clínica geral deve ter sempre um linfoma no seu radar diagnóstico se detectar fadiga, prurido crónico, anemia, sintomas sistémicos de hepatite viral ou infecção crónica por EBV ou VIH. Mas ele é também a pessoa de contacto central na gestão a longo prazo do paciente com linfoma curado, assumindo assim um papel importante na detecção precoce dos efeitos tardios associados”, concluiu a sua palestra o Prof. Lohri.
Fonte: “Linfoma: O que o GP precisa de saber”, Seminário na SGIM Great Update, 14-15 de Novembro de 2013, Interlaken
Literatura:
- Galper S, et al: Doença cardíaca clinicamente significativa em doentes com linfoma de Hodgkin tratados com irradiação mediastinal. Sangue 2011; 117: 412-418.
- Dores GM, et al: Segunda neoplasia maligna entre os sobreviventes a longo prazo da doença de Hodgkin: uma avaliação baseada na população ao longo de 25 anos. J Clin Oncol 2002; 20(16): 3484-3494.
PRÁTICA DO GP 2014; 9(3): 36-37










