A gravidade e prevalência da deficiência de ferro na insuficiência renal crónica é paralela à sua fase e multifactorial na sua origem. Em doentes com insuficiência renal, a homeostase do ferro é significativamente alterada, de modo que os parâmetros ideais de ferro são definidos de forma diferente do que na saúde renal. Isto tem implicações para aspectos da história médica, exames a realizar, e limites e alvos. Este artigo trata deste assunto e analisa a substituição do ferro sob forma oral e parenteral.
O elemento ferro é essencial e, em termos de quantidade, o elemento vestigial mais importante para quase todos os organismos vivos. Ocorrendo em animais e humanos em formas divalentes e trivalentes, o ferro está principalmente envolvido na ligação de oxigénio e transferência de electrões. Estas propriedades físico-químicas resultam nas suas principais funções como ligante e transportador de oxigénio, catalisador de reacções redox na cadeia respiratória celular e componente activo de numerosas enzimas não hematológicas. No entanto, a capacidade dos iões de ferro livres de formar espécies de oxigénio altamente reactivas (por exemplo, radicais hidroxil) a partir do peróxido de hidrogénio (a chamada reacção de Fenton) e de causar peroxidação lipídica abriga um potencial citotóxico considerável. Por esta razão, a maioria do ferro, tanto intracelular como extracelularmente, está presente na forma redox-inactiva ligada a proteínas especializadas [1].
Homeostase do ferro
O corpo humano adulto contém cerca de 3,5-5 g de ferro elementar [2]. Isto está presente quase exclusivamente sob a forma de armazenamento e ferro funcional. A piscina de armazenamento (0,8-1,2 g) é constituída pelo complexo proteico ferritina, uma proteína de aproximadamente 450 kDa cheia de óxido de ferro(III), e a hemossiderina estritamente intracelular, que é uma forma de armazenamento lenta e difícil de mobilizar da ferritina desnaturada. O fígado, o baço e a medula óssea são particularmente ricos em ferro de armazenamento. Embora a proporção de ferritina extracelular seja comparativamente pequena, a sua concentração sérica parece estar bem correlacionada com a reserva de ferro intracelular em casos normais.
O ferro funcional inclui hemoglobina (2,5-3 g), que é a mais importante em termos de quantidade, mioglobina (150 mg), ferro intracelular (80 mg) e enzimas que contêm ferro (10 mg). O ferro de transporte em circulação (4 mg) ligado à transferrina, uma glicoproteína de aproximadamente 80 kDa, forma relativamente apenas uma pequena fracção da quantidade total. Assim, o ferro rapidamente permutável disponível para a re-síntese de hemoglobina e enzimas contendo ferro (25 mg/dia) é reciclado várias vezes por dia. Isto ocorre através da desagregação dos grupos de hemorragia no sistema reticuloendotelial. A saturação da transferrina, a proporção do ferro sérico em relação à capacidade total de ligação do ferro (transferrina), é uma medida indirecta do ferro disponível [1, 3].
A figura 1 dá uma visão geral da quantidade de ferro presente e da sua distribuição em adultos saudáveis.
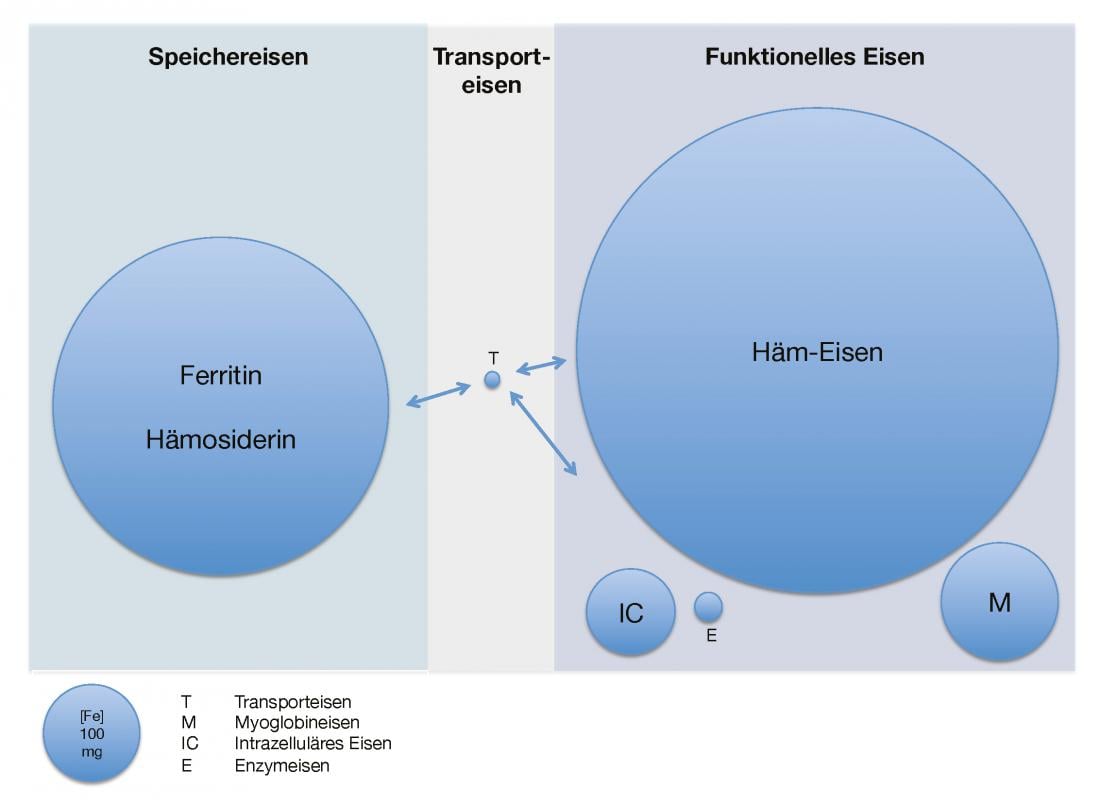
Fig. 1: Quantidade e distribuição de ferro disponível em adultos saudáveis
Distribuição do ferro no corpo sob aspectos quantitativos. T significa ferro ligado à transferrina, M significa ferro de mioglobina, IC significa ferro intracelular e E significa ferro contido em enzimas.
Devido à sua dupla propriedade como elemento traço indispensável e toxina de órgãos e células altamente potente, o equilíbrio do ferro e a sua compartimentação no corpo é estritamente regulado. Ao contrário dos cátions polivalentes como o cálcio, a homeostase do ferro é regulada exclusivamente por reabsorção, uma vez que as perdas normais não podem ser controladas e não é possível qualquer aumento adicional na excreção do ferro. Assim, em indivíduos saudáveis em estado estável, a ingestão diária de ferro enteral (1-2 mg em homens, 2-3 mg em mulheres menstruadas) cobre as perdas naturais através da esfoliação da pele e células da mucosa, menstruação em mulheres em idade fértil e quantidades vestigiais através de fezes e urina.
Nos mamíferos, o ferro pouco absorvível(III) é reduzido ao ferro mais solúvel(II) pelo citocromo B duodenal no pólo apical do enterócito. Depois a captação intracelular para o enterócito ocorre através do transportador de metal divalente (DMT1). O ferro também pode ser absorvido por um mecanismo paralelo e muito eficiente como haemin, um produto de degradação da hemoglobina e da mioglobina abundante em produtos de carne, através da proteína transportadora da hematina 1 (HCP1). O ferro(II) é então exportado pela ferroportina basolateral e directamente oxidado pelo ceruloplasmina ao ferro(III), que se liga à transferrina. No entanto, a taxa de reabsorção de ferro absorvido oralmente é baixa, sendo em média 6% nos homens e cerca do dobro nas mulheres jovens. Um aumento quando o sistema é maximamente estimulado (deficiência de ferro) só pode chegar aos 20%. Um papel fundamental nesta fina regulação é desempenhado pela hormona peptídeo hepcidina, que foi descoberta há cerca de 13 anos. Isto liga e induz a degradação da ferroportina do exportador de ferro em enterócitos duodenais, macrófagos reticuloendotelial e hepatócitos e impede que o ferro seja libertado para transferrina. Isto resulta numa baixa absorção de ferro entérico e redução da libertação de ferro da ferritina para a transferrina, conhecida como bloqueio reticuloendotelial. O ferro em circulação e os mediadores inflamatórios estimulam a produção de hepcidina, enquanto a hipoxemia e a administração de ESA têm um efeito inibidor [1, 3-5].
Deficiência de ferro na insuficiência renal crónica
Uma das características mais importantes da insuficiência renal crónica é a anemia renal, que está associada à redução da qualidade de vida, aumento da morbilidade cardiovascular e mortalidade por todas as causas [6, 7]. Para além da deficiência relativa de eritropoietina [8, 9], da resistência à eritropoietina uraémica [10] e do tempo de sobrevivência significativamente reduzido dos eritrócitos no meio uraémico [11], a deficiência absoluta e funcional de ferro deve ser mencionada como um importante factor causal. Ambos são também factores importantes na resistência à eritropoietina, que se caracteriza pela elevada procura de agentes estimulantes da eritropoiese (ESA) e dificuldade ou mesmo impossibilidade de atingir o alvo terapêutico sem a necessidade de transfusão [12, 13].
A prevalência e gravidade da deficiência de ferro na insuficiência renal crónica é paralela à sua fase e multifactorial na sua origem. A inapetência frequentemente observada neste colectivo, a restrição alimentar prescrita ao fosfato e o uso elevado e generalizado de inibidores da bomba de protões e aglutinantes de fosfato contendo cálcio levam a uma redução da ingestão e absorção de ferro [14, 15]. Devido à trombopatia uraémica e gastrite, há perdas gatrointestinais adicionais. Em paralelo, com o aumento da insuficiência renal, há um aumento da formação e acumulação de hepcidina devido ao estado pró-inflamatório associado à uraemia e diminuição da depuração das hormonas peptídeas. Esta constelação particular explica a deficiência de ferro funcional frequentemente observada em vários graus, que se caracteriza por valores elevados de ferritina e valores de saturação de transferrina baixos a normais [4, 12, 15, 16]. Consequentemente, em doentes renais insuficientes, o valor de ferritina para a definição de deficiência de ferro é fixado em 100-200 ng/ml [6, 7, 15, 17]. Uma formulação alternativa para isto seria que a utilização óptima do ferro nestes pacientes ocorra à custa de um aumento do ferro de armazenamento. Assim, os níveis de ferritina sérica abaixo de 100 ng/ml têm uma resposta subóptima à ESA e lojas insuficientes [18].
Em contraste, quase todos os doentes com insuficiência renal, incluindo os doentes em hemodiálise, têm reservas suficientes de ferro intramedular quando os níveis de ferritina sérica estão acima dos 300 ng/ml [19]. No entanto, Mirahmadi et al. mostram biopticamente há décadas que a níveis de ferritina sérica superiores a 124 ng/ml certos doentes em hemodiálise já mostram sinais de sobrecarga de ferro [20]. Toda a situação torna-se ainda mais complexa quando se considera o facto de certos pacientes de hemodiálise com níveis elevados de ferritina sérica (até mais de 1200 ng/ml) continuarem a mostrar uma resposta positiva à administração de ferro parenteral, especialmente quando a saturação da transferrina está abaixo dos 20% [21, 22].
Estes números demonstram claramente que a capacidade geral de avaliação destes testes deve ser posta em perspectiva [23]. No caso de mobilização rápida da reserva de ferro, como é o caso, por exemplo, no contexto de uma terapia recém-iniciada ou intensificada pela ESA, o fornecimento de ferro das reservas pode ser insuficiente, levando à chamada eritropoiese de ferro limitada. Isto pode ocorrer independentemente da deficiência de ferro funcional e caracteriza-se por um conteúdo reduzido de hemoglobina dos eritrócitos e seus precursores. A percentagem de eritrócitos hipocrómicos (% HRC) e o teor de hemoglobina reticulocítica (CHr) são indicadores bem estabelecidos da deficiência funcional de ferro e da presença de ferro na tropoiese ocular limitada. Uma CHr inferior a 29 pg/célula em doentes em terapia ESA é assim indicativa de uma deficiência funcional de ferro. O equivalente de hemoglobina reticulocitária (Ret-HE) inferior a 30,6 pg/célula, uma contraparte do CHr medido por um método alternativo, é por si só altamente preditivo de uma boa resposta à administração de ferro intravenoso em pacientes com hemodiálise tratada com ESA. Parâmetros mais recentes e mais precisos de deficiência funcional de ferro e eritropoiese limitada pelo ferro, como a protoporfirina eritrocitária de zinco (ZPP) e o receptor de transferrina solúvel (sTFR), não são actualmente recomendados como testes padrão em doentes com insuficiência renal devido à disponibilidade limitada, aos custos mais elevados e à experiência ainda insuficiente [22].
De acordo com os critérios acima mencionados, a prevalência de deficiência de ferro em doentes não dependentes de insuficiência renal por diálise (CKD fases 3 e 4) é superior a 50% [15]. A situação dos doentes em hemodiálise é ainda mais crítica. Além dos factores já mencionados, há uma perda considerável de ferro de 1-3 g (em hematócrito normal, 1 ml de sangue contém aproximadamente 0,5 mg de ferro) devido a numerosas retiradas de sangue e sequestro regular de sangue no filtro e equipamento de diálise. Isto conduz virtualmente à deficiência de ferro em todos os pacientes se as perdas não forem substituídas por uma substituição adequada [10].
A deficiência de ferro isolado sem anemia (EoA), uma entidade cada vez mais bem definida em doentes renalmente competentes [24, 25], é rara em doentes renalmente insuficientes. Estas são frequentemente situações iatrogénicas em que os pacientes não recebem substituição do ferro ou mesmo flebotomia durante muito tempo devido a valores de hematócrito espontaneamente elevados. A terapia inadequada da anemia renal com doses elevadas de ESA e a substituição do ferro em falta ou insuficiente pode levar ao mesmo quadro. Os sintomas gerais típicos de EoA, tais como fadiga, distúrbio do défice de atenção, termorregulação perturbada e queda de cabelo estão ausentes ou mascarados pelos sintomas uraémicos que se encontram em primeiro plano. Apenas a síndrome das pernas inquietas (RLS) parece estar associada à deficiência de ferro funcional nesta população, independentemente do grau de anemia [26].
Substituição do ferro e monitorização na insuficiência renal
Todos os doentes renais devem ser submetidos a um rastreio para detectar a presença de anemia. A prevalência de anemia renal aumenta significativamente a partir da fase 3 de CKD e requer um trabalho adequado [6, 7, 27]. Para além de uma história e exame específicos, isto inclui pelo menos um hemograma completo com índices de eritrócitos e contagem absoluta de reticulócitos e um nível sérico de vitamina B12 e folato. O estado do ferro deve ser avaliado para ferro de armazenamento (ferritina sérica) e ferro rapidamente mobilizável (saturação da transferrina e/ou um teor de hemoglobina reticulocitária) [6, 7].
A substituição do ferro é recomendada, em princípio, para todos os doentes com e sem diálise renal insuficiente com anemia e terapia ESA. Além disso, a administração de ferro parenteral pode evitar ou pelo menos atrasar a necessidade de terapia com ESA em pacientes não diálise e contribui para uma redução substancial da necessidade de ESA em pacientes de hemodiálise, o que está associado a benefícios financeiros e possivelmente de saúde [6, 7, 13, 28].
Embora não uniformemente definido por grupos de peritos, pode ser extraído um consenso sobre os valores-alvo. Um valor mínimo de 200 ng/ml para a ferritina sérica e 20% para a saturação da transferrina são unanimemente aceites. Em alternativa, são definidos valores-alvo para CHr (>29 pg/cell) e % HCR (<10%) para além da saturação da transferrina. Estes requisitos mínimos não representam por si só valores-alvo a nível populacional, que são naturalmente aqui estabelecidos mais elevados.
Continua a ser mais complicado fazer uma declaração clara sobre os limites superiores no que diz respeito às complicações imediatas e ainda pouco estudadas da terapia com ferro parenteral [29–31]. Foram observados sinais de toxicidade hepática e aumento da mortalidade e susceptibilidade à infecção em doentes de hemodiálise com sobrecarga de ferro [15, 29, 32]. Em geral, a suplementação com ferro não é recomendada para níveis de ferritina superiores a 500 ng/ml [6, 7, 17]. Além disso, no caso de infecções activas e febre, a administração de ferro parenteral deve ser evitada devido aos efeitos deletérios sobre o sistema imunitário e à reduzida capacidade de transporte associada à inflamação [7]. O défice persistente de ferro funcional requer uma clarificação adicional de uma infecção criptogénica ou neoplasia. Se ambos forem excluídos, a optimização do tratamento de hemodiálise e a administração controlada de ferro parenteral pode ser utilizada para tentar ultrapassar esta condição. Num futuro próximo, espera-se poder tratar “bloqueio uraémico de ferro” ainda mais eficientemente através do uso terapêutico de inibidores de hepcidina. O Quadro 1 resume os parâmetros alvo para a terapia com ferro de acordo com as directrizes hoje disponíveis.
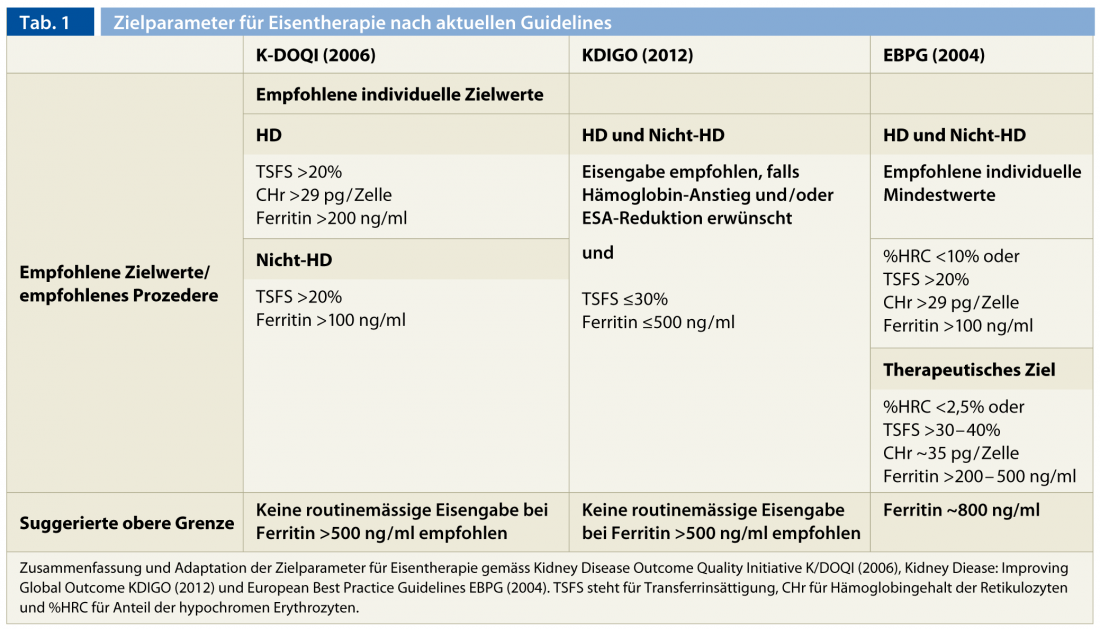
O efeito terapêutico deve ser regular para garantir reservas óptimas de ferro contínuas e para evitar efeitos secundários tóxicos devido à acumulação descontrolada de ferro armazenado (de aproximadamente 500-800 ng/ml de ferritina) e/ou exceder a capacidade de transporte de soro com um aumento prejudicial da quantidade de ferro livre no soro (TSFS >60%) [33]. É importante notar que a capacidade de avaliação dos parâmetros do ferro é severamente prejudicada imediatamente após a administração de ferro parenteral e que deve ser observado um intervalo de pelo menos uma semana entre a administração e a medição. Os controlos mensais durante as fases de saturação ou no início da terapia da ESA são recomendados. Em casos estáveis e em doentes sem terapia ESA, são suficientes controlos trimestrais.
Substituição oral do ferro
Apesar do seu baixo preço e facilidade de utilização, a substituição oral do ferro tem várias desvantagens. O ferro tomado peroralmente pode levar a danos oxidativos no tracto gastrointestinal, que se podem manifestar clinicamente com vómitos, dispepsia e diarreia. O fraco cumprimento resultante pode ser significativo, chegando a atingir 70% em certos colectivos [34]. Além disso, a eficácia da substituição oral do ferro continua a ser muito baixa pelas razões já mencionadas.
Uma reposição mais eficaz das reservas de ferro e uma melhor resposta à ESA só podem ser conseguidas com a forma parenteral [14]. Mesmo com reservas de ferro previamente normalizadas, a administração peroral não foi capaz de manter reservas de ferro suficientes a longo prazo [35]. Quando se utilizam preparações com altas doses de sal de ferro (ferro[II]-anion), a difusão passiva e descontrolada do ferro pode levar a um aumento significativo do ferro livre, o chamado ferro não ligado à transferência (NTBI), devido à exaustão dos mecanismos locais de transporte, o que também pode resultar numa toxicidade sistémica. Em geral, a substituição oral deve ser limitada aos doentes sem terapia de ESA e sem deficiência grave de ferro, com avaliação regular da eficácia e da tolerância [6, 7].
Substituição do ferro parentérico
A elevada necessidade de ferro, especialmente em doentes em hemodiálise, excede a capacidade de absorção e libertação de ferro enteral da piscina de armazenamento, que já é prejudicada no contexto da insuficiência renal, e explica a clara superioridade terapêutica da administração parenteral sobre a administração peroral. Por este motivo, é recomendado como forma padrão de administração em todos os doentes com insuficiência renal. Três preparações de ferro parenteral estão actualmente disponíveis na Suíça (Tab. 2).
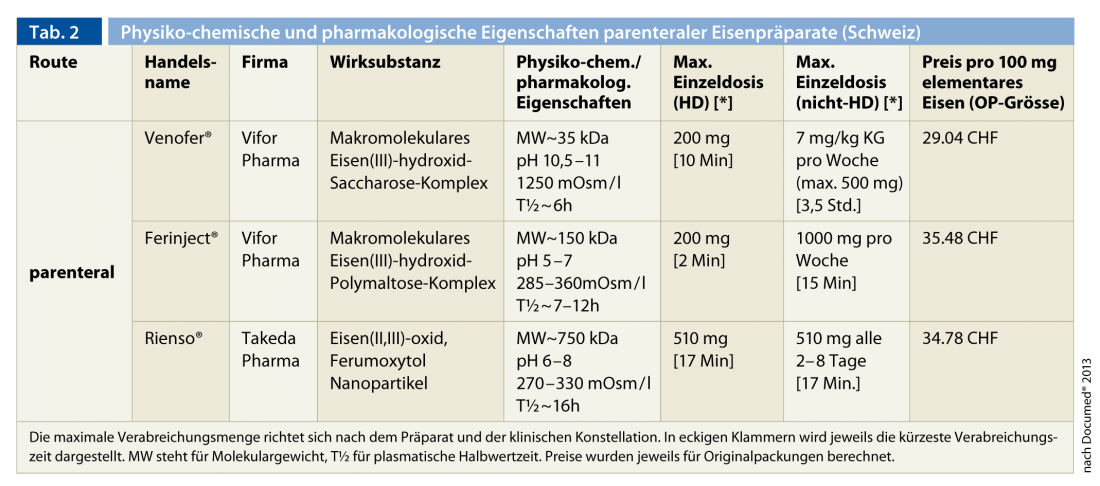
Estes são, por ordem cronológica de aprovação, Venofer® (complexo de hidróxido de ferro macromolecular(III) sacarose), Ferinject® (complexo de hidróxido de ferro macromolecular(III) polimaltose) e Rienso® (nanopartículas de óxido de ferro(II, III) (ferumoxytol)). As preparações de baixo e alto peso molecular contendo dextrano já não se encontram no mercado devido às reacções adversas potencialmente ameaçadoras da vida (anafilaxia). A experiência adquirida ao longo de décadas com a preparação anterior (Venofer®) é considerável. As duas novas preparações permitem a administração de doses únicas mais elevadas devido às suas propriedades físico-químicas (pH e osmolalidade) e especialmente devido à maior estabilidade do complexo de ferro. Esta é uma vantagem significativa para os pacientes externos não hemodiálicos. Em todos os casos, a frequência dos efeitos secundários graves que ameaçam a vida é muito baixa. Não são de esperar reacções cruzadas com os preparados contendo dextran, que não estão disponíveis na Suíça [15, 36]. Ocasionalmente, são observados episódios de hipotensão, broncoespasmo, reacção cutânea, mialgias e artralgia ou febre, especialmente com administração rápida.
A terapia é dividida numa fase de reposição e numa fase de manutenção. A necessidade inicial de ferro pode ser calculada de acordo com a fórmula de Ganzoni:
Défice total de ferro (mg) = [Soll-Hb – Ist-Hb (g/dl)] × peso corporal (kg) × 2,4 + ferro de reserva (mg)
Esta quantidade pode então ser administrada fraccionadamente (Venofer® e Ferinject®) ou como dose única (Ferinject® e Rienso®), dependendo da preparação, da gravidade da insuficiência renal e da forma de administração. A dose de manutenção depende do efeito terapêutico alcançado e dos parâmetros de ferro regularmente monitorizados.
CONCLUSÃO PARA A PRÁTICA
- A deficiência de ferro absoluta e funcional é comum na insuficiência renal crónica e está significativamente envolvida no desenvolvimento da anemia renal.
- A substituição do ferro é um componente central na terapia da anemia renal. A optimização dos parâmetros do ferro permite alcançar objectivos terapêuticos na maioria dos pacientes e minimiza a utilização da ESA, o que está associado à redução de custos e possivelmente a melhores resultados.
- A homeostase do ferro é significativamente alterada na insuficiência renal, de modo que os parâmetros ideais de ferro são definidos de forma diferente do que na saúde renal.
- Actualmente, a administração parenteral é superior à administração peroral devido a uma melhor eficácia e tolerabilidade. Preparações mais modernas de ferro parenteral são seguras e tornam a substituição do ferro muito mais fácil.
- Devido à falta de estudos de resultados a longo prazo e de provas existentes dos efeitos deletérios da overdose de ferro nesta população, a administração sistemática do ferro só deve ser realizada respeitando os valores-alvo.
Robert M. Kalicki, MD
Literatura:
- Dunn LL, Suryo Rahmanto Y, Richardson DR: Trends Cell Biol 2007; 17, 93.
- Löffler G: Bioquímica e Pathobiochemistry. 7 edição. Springer-Verlag: Berlim 2002.
- Andrews NC: Sangue 2008; 112: 219.
- Babitt JL, Lin HY: Am J Kidney Dis 2010; 55: 726.
- Nemeth E, et al.: Science 2004; 306: 2090.
- Am J Kidney Dis 2006; 47: S16.
- Kidney International Supplements 2012; 2: 279.
- Jacobson LO, Goldwasser E, Fried W, Plzak L: Nature 1957; 179: 633.
- McGonigle RJ, Wallin JD, Shadduck RK, Fisher JW: Kidney Int 1984; 25: 437.
- Besarab AF, em: Anemia nas doenças renais. Lippincott Williams e Wilkins: Philadelphia 2007; 2406-2430.
- Eschbach JW: Kidney Int 1989; 35: 134.
- Babitt JL, Lin HY: J Am Soc Nephrol 2012; 23: 1631.
- Coyne DW, Auerbach M: Am J Hematol 2012; 85: 311.
- Fudin R, Jaichenko J, Shostak A, Bennett M, Gotloib L: Nephron 1998; 79: 299.
- Macdougall IC, Geisser P: Irão J Kidney Dis 2012; 7: 9.
- Ashby DR, et al: Kidney Int 2009; 75: 976.
- Nephrol Dial Transplant 2004; 19 [Suppl 2]: ii6.
- Fernandez-Rodriguez AM, et al: Am J Kidney Dis 1999; 34: 508.
- Aljama P, et al: Clin Nephrol 1978; 10: 101.
- Mirahmadi KS, et al: JAMA 1977; 238: 601.
- Chang CH, Chang CC, Chiang SS: Clin Nephrol 2002; 57: 136.
- Thomas DW, et al: Br J Haematol 2013.
- Kalantar-Zadeh K, et al: Am J Kidney Dis 1995; 26: 292: 292.
- Bruner AB, Joffe A, Duggan AK, et al: Lancet 1996; 348: 992.
- Rowland TW, Deisroth MB, Green GM, et al: Am J Dis Child 1988; 142: 165.
- Sloand JA, Shelly MA, Feigin A, et al: Am J Kidney Dis 2004; 43: 663.
- Bethesda MD, The National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases 2004.
- Solomon SD, et al: N Engl J Med 2010; 363: 1146.
- Kalantar-Zadeh K, et al: J Am Soc Nephrol 2005; 16: 3070.
- Feldman HI, et al: J Am Soc Nephrol 2002; 13: 734.
- Feldman HI, et al: J Am Soc Nephrol 2004; 15: 1623.
- Vaziri ND: Am J Kidney Dis 2013.
- Hershko C, Graham G, Bates GW, et al: Br J Haematol 1978; 40: 255.
- Kruske SG, Ruben AR, Brewster DR: J Paediatr Child Health 1999; 35: 153.
- Macdougall IC, et al: Kidney Int 1996; 50: 1694.
- Auerbach M, Ballard H: Hematology Am Soc Hematol Educ Program 2010; 338.











