Factores como o pré-tratamento, idade, desempenho e comorbilidades do doente determinam a terapia de recaída no mieloma múltiplo. Os padrões são combinações triplas com um inibidor de proteasoma e/ou um IMID. As terapias de anticorpos também desempenham um papel importante no tratamento do mieloma múltiplo.
Para pacientes aptos com mieloma múltiplo recentemente diagnosticado, é realizado um tratamento de indução seguido pela consolidação de quimioterapia de alta dose com transplante de células estaminais autólogas (ASZT). A fim de alcançar um bom controlo da doença durante um período tão longo quanto possível, é seguido um tratamento de consolidação e/ou terapia de manutenção. O objectivo terapêutico é uma remissão molecular completa, se possível completa. Em doentes idosos e/ou inaptos, o foco está em conseguir a melhor resposta possível ao tratamento de primeira linha com poucos efeitos secundários e a preservação da qualidade de vida.
Quase todos os doentes sofrem subsequentemente uma recidiva. Nesta situação, as combinações lenalidomida/dexametasona (RD) e bortezomib/dexametasona (VD) foram os tratamentos padrão durante muito tempo [1–3]. No entanto, ambas as substâncias são agora amplamente utilizadas no tratamento de primeira linha, o que significa que o número de pacientes refractários a estes medicamentos está a aumentar. Há já alguns anos que muitos medicamentos novos estão disponíveis para estes pacientes. A escolha da terapia tem em conta as terapias anteriores (mudança de classe de substância, resposta, tolerância), idade, desempenho, comorbilidades e, claro, aprovação na Suíça. Em doentes em forma com um período sem progressão de pelo menos 12 meses após uma primeira TSA, deve ser considerada uma segunda TSA, uma vez que os resultados após a TSA de recuperação em tais doentes são equivalentes ou superiores aos das combinações de três drogas mais eficazes, com uma duração de tratamento mais curta e custos totais mais baixos em média (Tab. 1) [4,5].
Primeira recaída após terapia baseada em bortezomib
Após a terapia de primeira linha à base de bortezomib, o tratamento com lenalidomida/dexametasona foi sugerido aos doentes até há alguns anos atrás [1,2]. Hoje, na segunda linha, com uma melhor sobrevivência sem progressão (PFS), o foco deve ser uma combinação de três drogas.
A combinação de RD com o anticorpo monoclonal SLAMF7 (“molécula de activação linfocítica sinalizadora F7”) elotuzumab mostrou uma PFS mediana de 19,4 meses (vs. 14,9 meses com RD) no ensaio ELOQUENT-2. Foram incluídos 646 pacientes com uma mediana de duas terapias anteriores. O tratamento com ERD foi continuado até à progressão ou efeitos secundários inaceitáveis. A taxa de resposta global (ORR) com ERD foi de 79% (vs. 66%). O tempo para o tratamento seguinte (TTNT) foi prolongado por um ano (33 vs. 21 meses), a sobrevivência mediana no grupo ERD foi de 43,7 meses (vs. 39,6 meses). Os efeitos secundários mais comuns de grau 3 ou 4 foram hematológicos (neutropenia 34% vs. 44% e linfopenia 77% vs. 49%). Os benefícios clínicos foram acompanhados de infecções mais frequentes (88% vs. 74%), especialmente o herpes zoster [6,7]. Na Suíça, a combinação de elotuzumab com lenalidomida e dexametasona (ERD) é aprovada a partir da segunda linha de terapia.
Como outra terapia tripla, a combinação de lenalidomida/dexametasona juntamente com o carfilzomibe, um inibidor do proteasoma de segunda geração, é aprovada a partir da segunda linha de terapia. No ensaio ASPIRE, esta combinação mostrou um prolongamento da mediana PFS por 8,7 meses (26,3 vs. 17,6 meses) em 792 pacientes, em comparação com o RD apenas. Carfilzomib com RD (KRD) foi administrado por um máximo de 18 ciclos, RD até à progressão. O ORR foi um impressionante 87,1% (vs. 66,7%), com uma taxa de RC para o KRD de 31,8% (vs. 9,3% no grupo RD). A sobrevivência de 2 anos no grupo KRD foi de 73,3% (vs. 65%). O Carfilzomib é administrado nesta combinação até um máximo de 27 mg/m2 duas vezes por semana. A taxa de efeito secundário, também no que diz respeito à neuropatia, é comparável. De particular interesse foram os problemas cardíacos com carfilzomibe: dispneia (2,8% vs. 1,8%), insuficiência cardíaca (3,8% vs. 1,8%), doença cardíaca isquémica (3,3% vs. 2,1%), hipertensão (4,3% vs. 1,8%) e insuficiência renal aguda (3,3% vs. 3,1%) [8].
Primeira recaída após terapia baseada em IMID
Após terapia de primeira linha baseada em IMID, recomenda-se a terapia com inibidores proteasómicos como terapia de segunda linha. Tradicionalmente, a combinação bortezomib/dexametasona (VD) é utilizada [3]. A combinação de carfilzomibe com dexametasona (KD) provou ser mais eficaz no ensaio ENDEAVOR. A PFS mediana foi significativamente mais longa aos 18,7 vs. 9,4 meses em comparação com a VD. 54% dos 929 pacientes deste estudo foram pré-tratados com bortezomib, embora não refractários. Também nestes pacientes, o PFS foi mais longo com KD, 15,6 vs. 8,1 meses. Carfilzomib foi administrado na dose de 56 mg/m2 duas vezes por semana. Os eventos adversos mais comuns nesta dose incluíam anemia (14% vs. 10%), hipertensão (9% vs. 3%), trombocitopenia (8% vs. 9%) e pneumonia (7% vs. 8%), enquanto a ocorrência de polineuropatias de grau 2 ou superior era significativamente menos frequente com o carfilzomib (6% vs. 32%) [9]. Carfilzomib não está licenciado na Suíça para esta dosagem.
O padrão na primeira recaída deve ser uma combinação tripla, se possível. Uma combinação bastante favorável é bortezomib/dexametasona em combinação com ciclofosfamida (VCD ou CyBorD). Contudo, este tratamento só é aprovado na Suíça para tratamento por indução antes de um ASZT planeado. Em contraste, o regime de KRD significativamente mais caro é aprovado a partir da segunda linha de terapia.
Tratamento de outras recidivas
A partir da terceira linha de terapia (após falha de bortezomib e lenalidomida), a combinação de pomalidomida com dexametasona (Pom/D) é aprovada na Suíça [10]. Devido ao elevado custo, a dose aprovada (4 mg/d) foi recentemente questionada a favor de um regime de alternância (4 mg de dois em dois dias), o que é potencialmente significativo em termos de economia da saúde [11]. Semelhante ao carfilzomibe, as questões sobre a dosagem ideal na terapia do mieloma múltiplo foram insatisfatoriamente resolvidas no ritmo agitado do lançamento de produtos.
Como medicamento adicional, o panobinóstato inibidor deacetylase histone em combinação com VD é aprovado a partir da terceira linha. No estudo PANORAMA-1, 768 pacientes com pré-tratamento intensivo foram tratados com panobinóstato/VD ou panobinóstato/VD. Tratamento placebo/VD. O Panobinostat é dado peroralmente três dias por semana nas semanas 1 e 2 num ciclo de 21 dias, para além do VD. Houve uma melhoria na mediana PFS de quase quatro meses (12 vs. 8 meses) com a mesma sobrevivência global. O ORR com panobinostato/VD foi de 60,7%, com uma resposta completa alcançada em 11% dos pacientes e uma resposta parcial muito boa em 17%. Os efeitos secundários não hematológicos mais comuns incluíam diarreia (68% vs. 42%), astenia ou fadiga (57% vs. 41%) e neuropatia periférica (61% vs. 67%). Os efeitos secundários hematológicos significativos foram também mais frequentes sob o panobinostato [12].
O primeiro inibidor do proteasoma peroralmente disponível, ixazomib, é aprovado na Suíça em combinação com lenalidomida e dexametasona da terceira linha de terapia (ou da segunda linha de terapia se estiverem presentes características de alto risco). O ensaio TOURMALINE-MM1 comparou o ixazomib em combinação com RD versus placebo/RD. A PFS mediana foi significativamente mais longa no grupo ixazomib (20,6 vs. 14,7 meses). A tolerância hematológica de ambas as terapias era comparável. A neuropatia periférica ocorreu em 27% dos doentes (contra 22%) com ixazomib [13]. Sendo uma terapia completamente peroral, esta combinação é sem dúvida amiga do paciente.
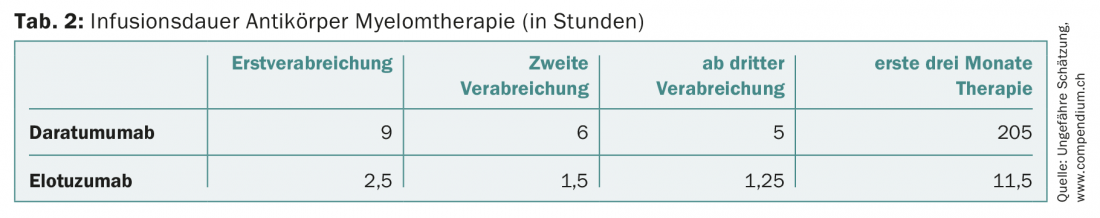
Em doentes que são refractários a pelo menos um inibidor proteasómico e um agente imunomodulador, ou que tenham tido pelo menos três terapias anteriores, o anticorpo monoclonal CD38 daratumumab também pode ser administrado na Suíça. Como monoterapia, o daratumumab mostra taxas de resposta de cerca de 30% [14]. O anticorpo, que é inicialmente administrado semanalmente, representa um desafio para os ambulatórios de oncologia quando utilizado mais amplamente, dada a longa duração da infusão de nove horas para a primeira administração (e ainda pelo menos cinco horas a partir da terceira administração). Daratumumab é também recentemente aprovado na segunda linha em combinação com dexametasona e bortezomib ou lenalidomida.
Outras opções terapêuticas
Na literatura em rápido crescimento podem encontrar-se vários outros regimes terapêuticos para o tratamento do mieloma múltiplo recaído.
No ensaio CASTOR, 498 pacientes com uma mediana de duas terapias anteriores foram randomizados para daratumumab/VD (Dara/VD) ou apenas para VD. Em ambos os braços de tratamento, a VD foi parada após oito ciclos cada, e o daratumumab podia ser continuado até à progressão. Após um seguimento médio de 7,4 meses, houve um PFS significativamente prolongado no grupo daratumumab. O ORR foi significativamente mais elevado no braço daratumumab (82,9% vs 63,2%) e, em particular, as taxas de remissão parcial muito boa ou melhor foram quase duplicadas (59,2% vs 29,1%) [15].
No estudo POLLUX, 569 pacientes pré-tratados com pelo menos uma terapia receberam RD ou a combinação com daratumumab. Após um seguimento médio de 13,5 meses, a análise intercalar mostrou um PFS prolongado no grupo experimental (não atingido vs. 18,4 meses). O ORR também foi mais elevado no braço daratumumab a 92,9% (vs 76,4%), assim como a taxa de remissões completas (43,1% vs 19,2%) [16]. O principal problema com a utilização deste anticorpo são as reacções de infusão e trombopenia.
Há também dados para combinações de Pom/D com uma terceira substância para mieloma recidivante, por exemplo, em combinação com 400 mg semanais de ciclofosfamida peroral (PomCyDex) ou bortezomib (PVD) [17,18]. Ambos os estudos incluíram doentes com mieloma refletor de lenalidomida. A monoterapia com bendamustina também pode ser utilizada, especialmente em doentes com insuficiência renal ou que necessitem de diálise [19]. Esta última não é aprovada para esta indicação na Suíça.
Em dois ensaios inovadores da fase II, a Associação Suíça para a Investigação Clínica do Cancro (SAKK) testou a combinação de nelfinavir com VD resp. RD investigado. Isto foi baseado em observações de que este medicamento para o VIH pode restaurar a sensibilidade aos dois medicamentos para o mieloma múltiplo. No ensaio SAKK 39/13, foi alcançado um ORR promissor de 65% numa população com um pré-tratamento muito intenso e frequentemente bortezomibe e lenalidomida-refractária [20]. Outros estudos SAKK com combinações de nelfinavir estão a ser planeados.
Perspectivas
Os dados até à data sobre inibidores de mieloma múltiplo em pontos de controlo não são muito promissores. Em contraste, na sequência da aprovação pela FDA da terapia celular CAR-T para doentes jovens com recaídas ou TODOS refractários, esta opção de tratamento tornou-se o foco de interesse também para os doentes com mieloma múltiplo. Isto baseia-se em dados de ensaios clínicos iniciais em doentes com mieloma múltiplo com células BCMA-CAR-T (“antigénio de maturação de células B”) com taxas de remissão de cerca de 100% [21–23].
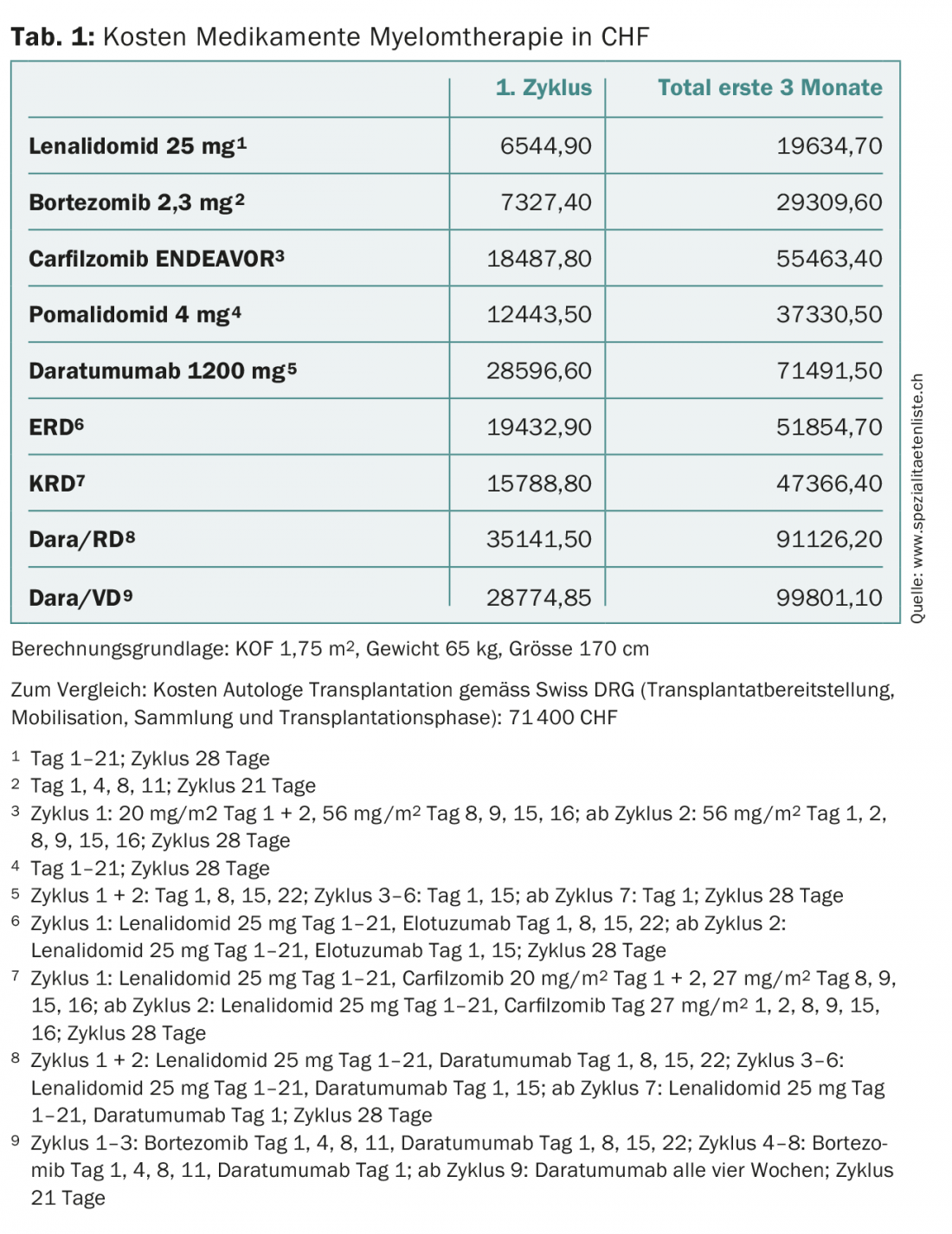
Registaram-se progressos sem precedentes na terapia do mieloma múltiplo. Embora o tempo médio de sobrevivência há 15 anos ainda fosse de dois a três anos, hoje em dia 40% dos doentes com mieloma múltiplo vivem dez anos ou mais. No entanto, esta melhoria reflectiu-se também nos custos de tratamento (tab. 1) . Estes últimos devem ser tidos em conta pelos vários actores do sistema de saúde, especialmente porque os novos medicamentos muito caros irão avançar para a linha da frente. Para ficar com o exemplo do daratumumab, isto também aumentará a pressão organizacional, infra-estrutural e pessoal sobre as clínicas e práticas ambulatórias oncológicas devido apenas à longa duração da infusão (Tab. 2) . A aplicação subcutânea deste anticorpo aliviaria o problema [24].
Para além da sua eficácia, o tratamento de doenças não incuráveis deve melhorar principalmente a qualidade de vida. Para os novos medicamentos, estes dados ainda estão em falta, ou a qualidade de vida era apenas um parâmetro secundário [25].
Em resumo, os doentes com mieloma múltiplo têm hoje uma variedade de novas opções de tratamento. Se possível, os pacientes devem ser incluídos nos estudos (por exemplo, o SAKK). Seria desejável que os protocolos examinassem cada vez mais também as sequências terapêuticas e a qualidade de vida.
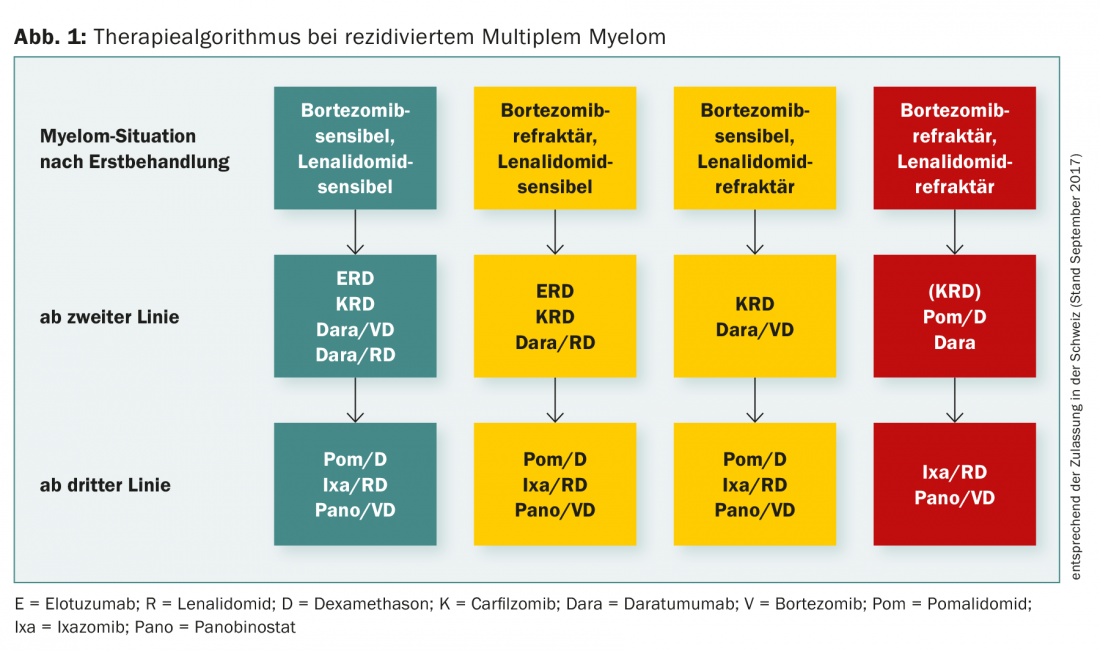
Figura 1 resume o algoritmo de tratamento do mieloma múltiplo recidivado.
Mensagens Take-Home
- A escolha da terapia de recaída depende do pré-tratamento (classe de substância, resposta e tolerância), idade, desempenho e comorbilidades dos pacientes, bem como da aprovação dos medicamentos.
- O padrão no tratamento de recorrência são combinações triplas com um inibidor de proteasoma e/ou um IMID, dependendo do pré-tratamento.
- As terapias de anticorpos desempenham um papel importante no tratamento do mieloma múltiplo.
- Os doentes com mieloma devem ser sempre tratados em protocolos (por exemplo, SAKK), se possível.
- A terapia com células T da CAR pode tornar-se uma opção promissora no mieloma múltiplo.
Literatura:
- Weber DM, et al: Lenalidomida mais dexametasona para mieloma múltiplo recaído na América do Norte. N Engl J Med 2007; 357(21): 2133-2142.
- Dimopoulos M, et al: Lenalidomida mais dexametasona para mieloma múltiplo recidivante ou refractário. N Engl J Med 2007; 357(21): 2123-2132.
- Richardson PG, et al: Bortezomib ou dexametasona de alta dose para mieloma múltiplo recidivado. N Engl J Med 2005; 352(24): 2487-2498.
- Grovdal M, et al.: Transplante autólogo de células estaminais versus novos medicamentos ou quimioterapia convencional para pacientes com mieloma múltiplo recidivado após ASCT anterior. Transplante de medula óssea 2015; 50(6): 808-812.
- Giralt S, et al.: American Society of Blood and Marrow Transplantation, European Society of Blood and Marrow Transplantation, Blood and Marrow Transplant Clinical Trials Network, e International Myeloma Working Group Consensus Conference on Salvage Hematopoietic Cell Transplantation in Patients with Relapsed Multiple Myeloma. Biol Blood Marrow Transplant 2015; 21(12): 2039-2051.
- Dimopoulos MA, et al: Elotuzumab mais lenalidomida/dexametasona para mieloma múltiplo recidivante ou refractário: ELOQUENT-2 acompanhamento e análises post-hoc sobre sobrevivência sem progressão e crescimento tumoral. Br J Haematol 2017; 178(6): 896-905.
- Lonial S, et al: Elotuzumab Therapy for Relapsed or Refractory Multiple Myeloma. N Engl J Med 2015; 373(7): 621-631.
- Stewart AK, et al: Carfilzomib, lenalidomida, e dexametasona para mieloma múltiplo recidivado. N Engl J Med 2015; 372(2): 142-152.
- Dimopoulos MA, et al: Carfilzomib e dexametasona versus bortezomib e dexametasona para doentes com mieloma múltiplo recidivado ou refractário (ENDEAVOR): um estudo randomizado, fase 3, rótulo aberto, multicêntrico. Lancet Oncol 2016; 17(1): 27-38.
- Dimopoulos MA, et al: Segurança e eficácia da pomalidomida mais baixa dose de dexametasona em STRATUS (MM-010): um estudo de fase 3b no mieloma múltiplo refractário. Sangue 2016; 128(4): 497-503.
- Zander T, et al.: Spotlight on pomalidomide: poderia menos ser mais? Leucemia 2017; 31(9): 1987-1989.
- San-Miguel JF, et al: Panobinostat plus bortezomib e dexametasona versus placebo plus bortezomib e dexametasona em doentes com mieloma múltiplo recidivado ou recidivado e refractário: um ensaio multicêntrico, aleatório, duplo-cego fase 3. Lancet Oncol 2014; 15(11): 1195-1206.
- Moreau P, et al: Ixazomib oral, lenalidomida, e dexametasona para o mieloma múltiplo. N Engl J Med 2016; 374(17): 1621-1634.
- Usmani SZ, et al: Eficácia clínica da monoterapia de daratumumab em doentes com mieloma múltiplo altamente pré-tratados recaídos ou refractários. Sangue 2016; 128(1): 37-44.
- Palumbo A, et al: Daratumumab, Bortezomib, e Dexamethasone para o Mieloma Múltiplo. N Engl J Med 2016; 375(8): 754-766.
- Dimopoulos MA, et al: Daratumumab, Lenalidomida, e Dexametasona para o Mieloma Múltiplo. N Engl J Med 2016; 375(14): 1319-1331.
- Baz RC, et al: Estudo aleatório multicêntrico fase 2 de pomalidomida, ciclofosfamida, e dexametasona em mieloma refractário recidivado. Sangue 2016; 127(21): 2561-2568.
- Paludo J, et al: Pomalidomida, bortezomibe, e dexametasona para doentes com mieloma múltiplo refractário de lenalidomida recidivante. Sangue 2017; 130(10): 1198-1204.
- Hoy SM: Bendamustine: uma revisão da sua utilização no tratamento da leucemia linfocítica crónica, do linfoma não-Hodgkin indolente rituximab-refractário e do mieloma múltiplo. Drogas 2012; 72(14): 1929-1950.
- Driessen C, et al: O inibidor de protease HIV Nelfinavir em combinação com Bortezomib e Dexametasona (NVd) tem excelente actividade em doentes com mieloma múltiplo avançado, inibidor-refractário protease: um ensaio de Fase II multicêntrico (SAKK 39/13). Sangue 2016; 128: Resumo 487.
- Ali SA, et al: As células T que expressam um receptor antigénio quimérico anti-madurecimento de células B causam remissões de mieloma múltiplo. Sangue 2016; 128(13): 1688-1700.
- Berdeja J, et al: Primeiro estudo multicêntrico em humanos da terapia com células T anti-BCMA CAR bb2121 para mieloma múltiplo recidivante/refractário: Resultados actualizados. J Clin Oncol 2017; 35(15 suppl): 3010.
- Fan F, et al: Remissões duradouras com células T quiméricas específicas do receptor de antigénio quimérico (CAR)-modificado BCMA em doentes com mieloma múltiplo refractário/relapsado. J Clin Oncol 2017; 35(18 suppl): 3001.
- Usmani S, et al: Open-Label, Multicenter, Dose Escalada Fase 1b Estudo para Avaliar a Entrega Subcutânea de Daratumumab em Pacientes (pts) com Mieloma Múltiplo Relapsado ou Refractário (PAVO). Sangue 2016; 128: Resumo 1149.
- Kvam AK, Waage A: Qualidade de vida relacionada com a saúde em doentes com mieloma múltiplo – será que isso importa? Haematologica 2015; 100(6): 704-705.
InFo ONCOLOGy & HEMATOLOGy 2017; 5(5): 16-20











