O padrão ouro para avaliação de AVC agudos é a TAC nativa para excluir hemorragias, após o que a terapia trombolítica iv pode ser administrada na janela de tempo actualmente permitida de 4,5 horas e após a exclusão de possíveis contra-indicações. O maior desafio na gestão interdisciplinar de AVC é a selecção de doentes com tempo optimizado para as terapias disponíveis (iv terapia trombolítica, ia recanálise, ia lise, sem terapia). Protocolos de imagem modernos e promissores ajudam na tomada de decisões no cenário agudo e podem avaliar a penumbra e o estado colateral vascular individual em minutos. Isto pode justificar terapias endovasculares fora da janela temporal de 4,5 horas se a situação colateral for boa ou na área do estroma vertebro-basilar.
O AVC agudo é a emergência neurológica mais comum. A causa mais frequente é a oclusão aguda das artérias que abastecem o cérebro. Restaurar o fluxo sanguíneo para o cérebro o mais rapidamente possível é crucial para um tratamento bem sucedido. A extensão dos danos dos tecidos depende essencialmente do tempo de isquemia e das garantias disponíveis. Toda a cadeia de tratamento deve portanto ser optimizada no tempo: desde o início do AVC, transporte para o hospital, diagnósticos, tratamento agudo, até à enfermaria do AVC. Os cuidados de acompanhamento e reabilitação são igualmente importantes, mas menos críticos em termos de tempo.
O papel da neurorradiologia é no diagnóstico por imagem primário e na revascularização neurointervencionista. O primeiro passo é distinguir entre infarto cerebral isquémico (cerca de 80%) e hemorragia cerebral (o diagnóstico diferencial mais comum), o que não é clinicamente possível do ponto de vista neurológico. Apenas os pacientes com AVC isquémico são elegíveis para qualquer forma de terapia revascularizante. O padrão de ouro para a avaliação do AVC agudo é a tomografia computorizada nativa (TAC nativa) devido à sua ampla disponibilidade e alta sensibilidade para excluir a hemorragia cerebral. Isto é suficiente para iniciar atempadamente a terapia trombolítica iv se estiverem presentes défices funcionais relevantes e sem contra-indicações (por exemplo, traumatismo craniano, cirurgia recente, coagulação descarrilada). Em 2010, de acordo com novas descobertas científicas baseadas em resultados correspondentes, a janela de tempo entre o início dos sintomas e o início da terapia trombolítica foi alargada de 3 para 4,5 horas (ECASS III) [1].
A TC nativa é conhecida por ter baixa sensibilidade para detectar enfarte cerebral nas primeiras horas após o início do enfarte e varia com o intervalo de tempo e a experiência radiológica. Os protocolos modernos de exame (perfusão CT) aumentam significativamente a sensibilidade [2], fornecem informação adicional útil sobre o AVC individual e o estado colateral vascular e ajudam a tomar decisões terapêuticas individuais. Para além da terapia trombolítica iv baseada em evidências numa janela de tempo de 4,5 horas, há também abordagens da terapia endovascular da neurorradiologia intervencionista para oclusões proximais de vasos, por exemplo. Estes procedimentos de recanálise mecânica foram capazes de alcançar melhores taxas de recanalização das artérias cerebrais proximais ocluídas em comparação com a trombólise IV [3], mas nos estudos maiores, muito discutidos e novos, nenhuma melhoria significativa no resultado funcional dos pacientes tratados (IMS III) [4]. Estudos adicionais com desenho optimizado, melhor selecção de doentes e equipamento uniforme de revascularização continuam por ver. A revascularização da ia é actualmente utilizada até 6-8 horas após o início dos sintomas, sem limite de tempo para oclusões vertebrobasilares. O verdadeiro desafio na avaliação neurorradiológica e no tratamento interdisciplinar do AVC agudo reside na decisão da melhor/eficaz terapia individualmente. A questão central no centro interdisciplinar de acidentes vasculares cerebrais é: que doente beneficia melhor da trombólise iv, da recanálise da ia, da trombólise da ia ou da ausência de terapia e quando? Para além da idade, tamanho do enfarte, gravidade dos défices neurológicos, localização e tamanho da oclusão do vaso, bem como a janela temporal, outros factores (comorbilidades, medicação, anatomia individual do vaso e possíveis contra-indicações) desempenham um papel importante na decisão a favor ou contra uma forma específica de terapia. Técnicas mais recentes de TC (perfusão de TC), que juntamente com a TC nativa e a angiografia de TC (CTA) no cenário agudo excluem a hemorragia cerebral em poucos minutos e permitem declarações úteis sobre o estado colateral vascular e o tamanho aproximado do parênquima cerebral irreversivelmente danificado e ainda salvável (conceito de penumbra), são úteis para a tomada de decisões.
Em comparação com a ressonância magnética, um protocolo de AVC CT traz claras vantagens em termos de tempo e logística (aquisição de dados mais rápida, maior disponibilidade, menor esforço, melhor monitorização do paciente), em linha com o lema “tempo é cérebro”. Em muitos centros de AVC, tais protocolos de AVC CT já são utilizados clinicamente. Estudos de comparação directa entre a perfusão por TC e a ressonância magnética forneceram resultados comparáveis [5], mas faltam ainda comparações multicêntricas válidas devido a uma padronização insuficiente dos algoritmos de avaliação/pós-processamento [6].
A seguir, serão apresentadas as possibilidades de diagnóstico neurorradiológico em acidente vascular cerebral agudo e sublinhadas com estudos de caso. Também comentamos sobre possíveis fontes de erro e diagnósticos diferenciais.
Nativo T
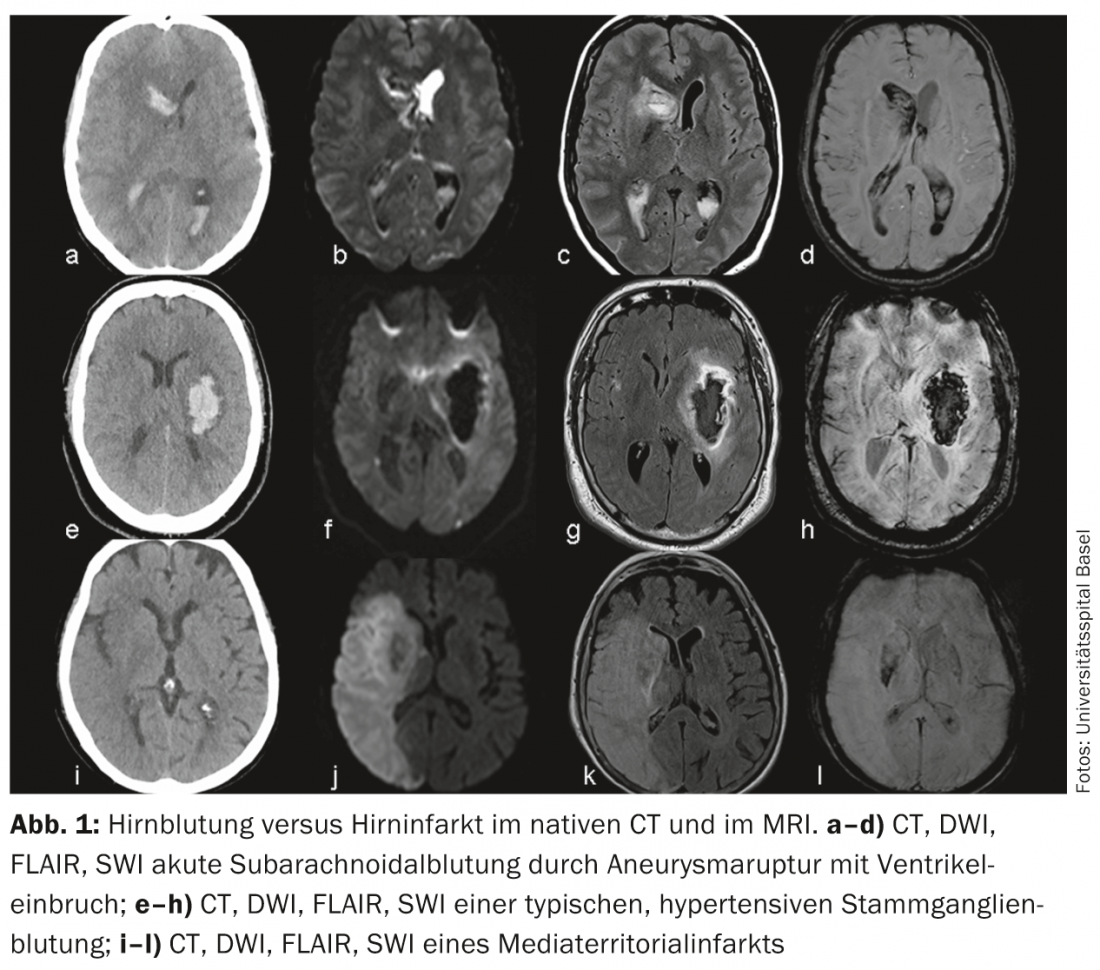
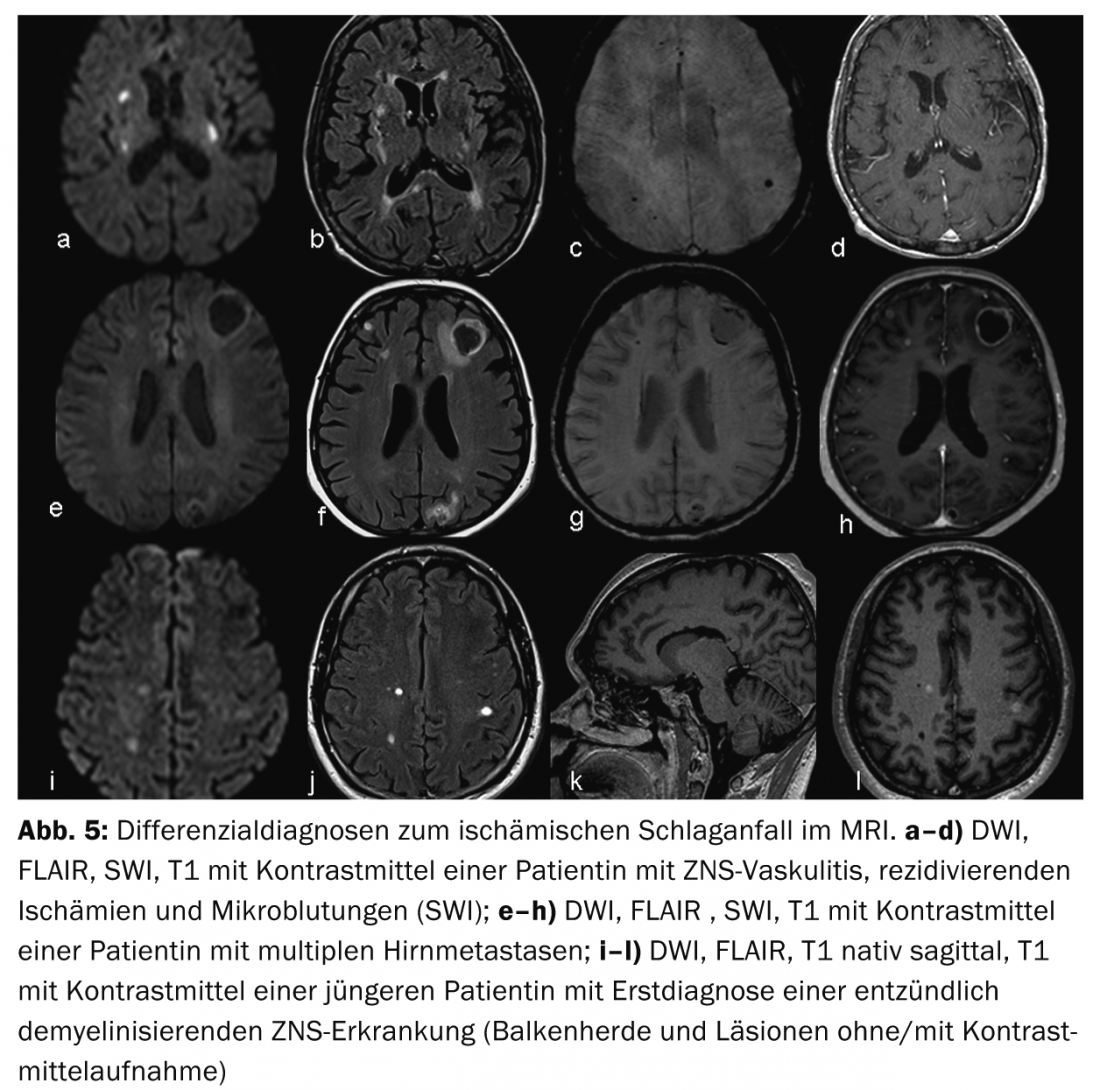
Infarto cerebral versus hemorragia cerebral: O diagnóstico diferencial mais frequente de AVC isquémico é a hemorragia intracraniana. Pode ser feita uma distinção entre hemorragias subaracnoidais (aneurismáticas) e intraparenquimais (hipertensivas e não hipertensivas). A detecção ou exclusão de hemorragia cerebral pode ser feita de forma rápida e fiável com TC nativa, mas também pode ser feita com sequências modernas (SWI, DWI, FLAIR) e um pouco mais de esforço na ressonância magnética (Fig. 1).
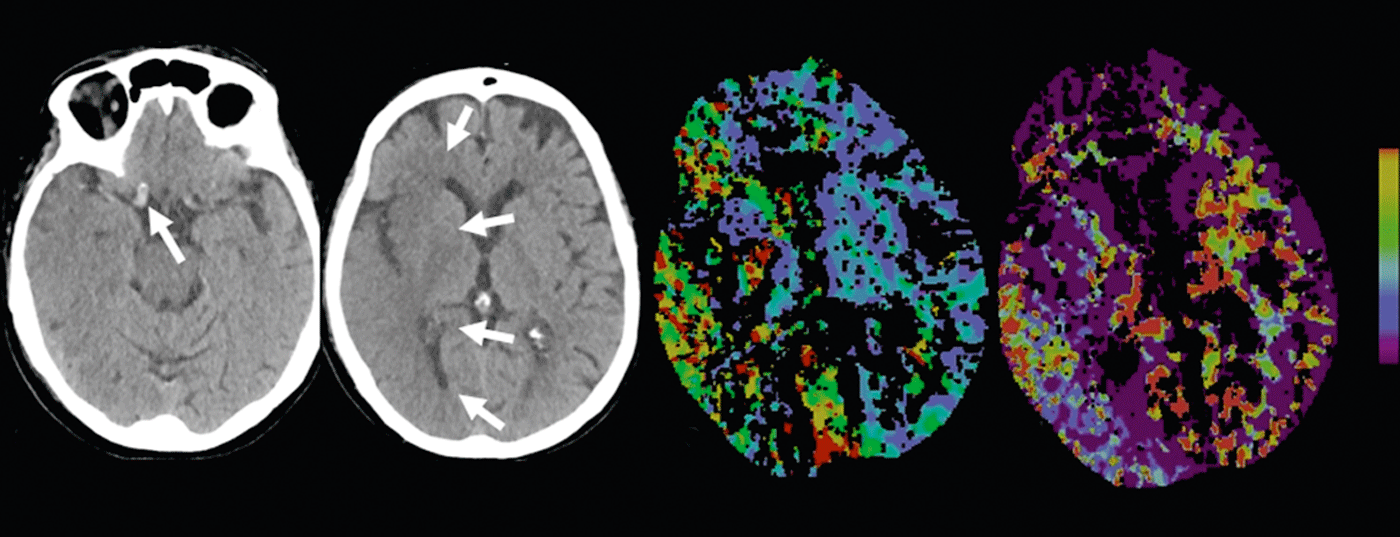
Enfarte cerebral: A TC nativa pode mostrar os chamados sinais precoces de enfarte. Por exemplo, reduções da densidade da matéria cinzenta com desdiferenciação corticomedular causada por edema de enfarte – ou o sinal arterial hiperdenso, causado pelo aumento da densidade com trombo intraluminal (Fig. 2 e 3).
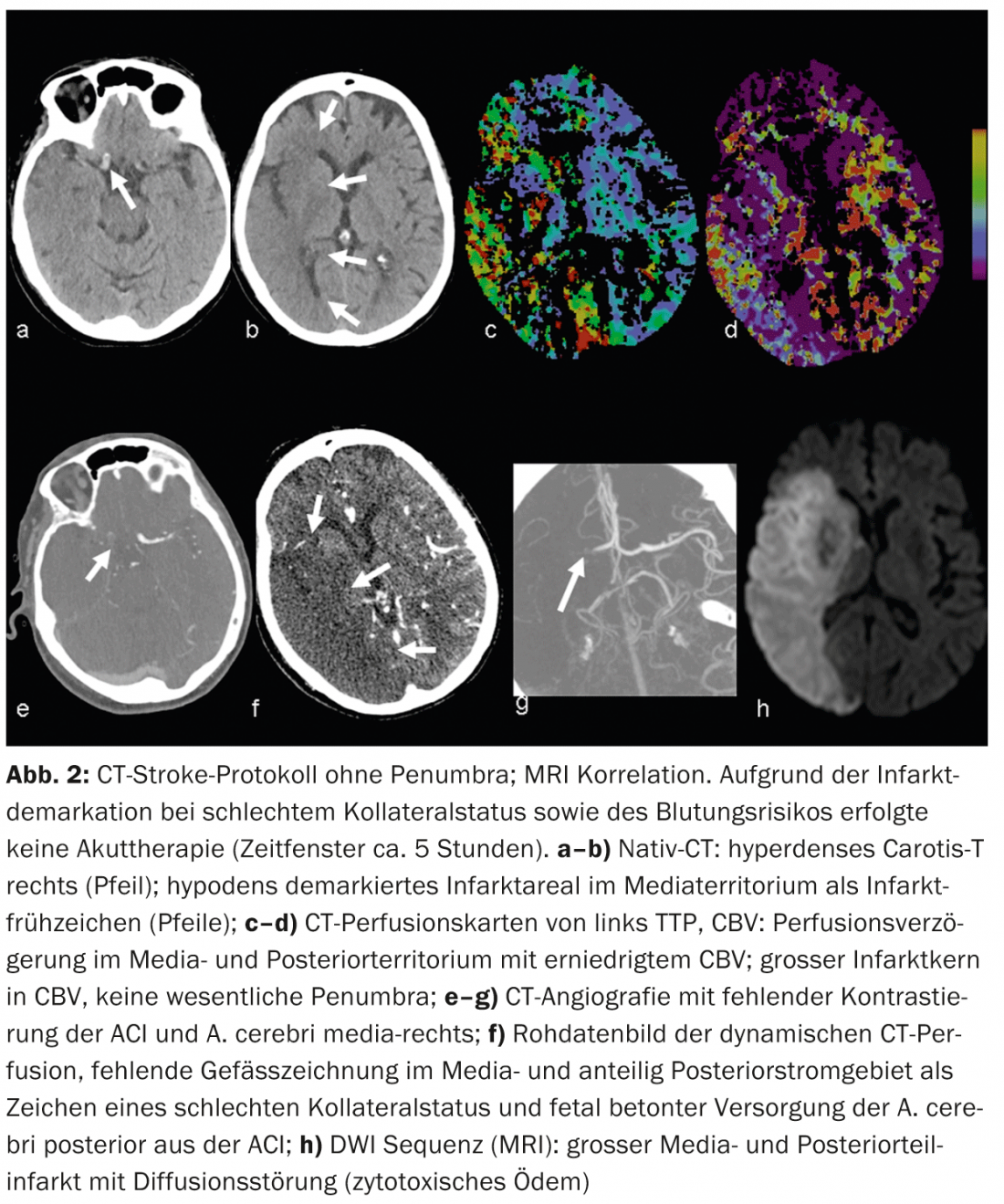
De acordo com a literatura, a sensibilidade na detecção precoce de sinais de enfarte varia entre 12 e 92% e depende principalmente da duração da isquemia. As áreas de infarto demarcadas no TAC nativo são altamente específicas para danos parenquimatosos irreversíveis e são prognosticalmente significativas [7]. Por exemplo, se mais de um terço do território mediastinal mostrar demarcação por enfarte, o risco de hemorragia aumenta com a terapia trombolítica iv.
MRI
O melhor método para visualizar os danos parenquimatosos isquémicos é a RM, que pode visualizar o enfarte em minutos, devido a edema citotóxico. Isto leva a uma redução do movimento molecular browniano e, portanto, à desordem de difusão detectável no DWI, que corresponde ao núcleo de enfarte irreversivelmente danificado. Os estudos de perfusão por ressonância magnética podem revelar défices de perfusão que também infartam na ausência de reperfusão (“tecido em risco”). Este desfasamento difusão-perfusão (conceito penumbra) tem sido intensamente estudado na última década e considerado um conceito atractivo para a selecção de doentes para terapias de reperfusão [5]. O estado vascular intra e extracraniano do paciente também pode ser imitado por angiografia de RM e revelar oclusões vasculares.
Na rotina clínica, apenas algumas clínicas podem fornecer uma ressonância magnética para o diagnóstico de AVC agudo; além disso, o tempo de exame é mais longo, a logística mais complexa e, em última análise, só pode ser estabelecida como diagnóstico agudo padrão se a infra-estrutura for muito boa.
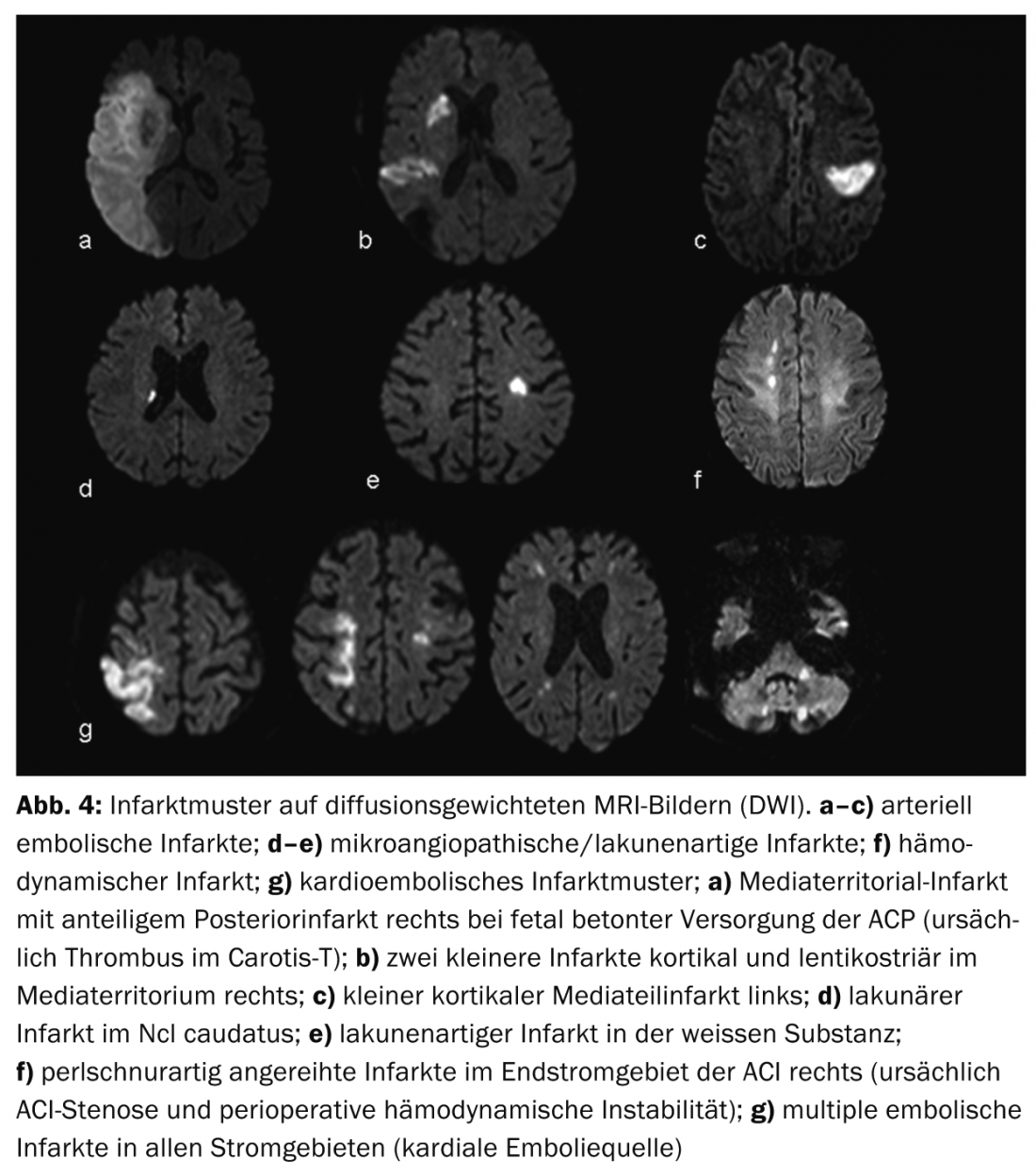
As vantagens da ressonância magnética são uma melhor visualização dos padrões de enfarte e, portanto, uma melhor avaliação da etiologia do enfarte (Fig.4) bem como uma melhor diferenciação dos diagnósticos diferenciais, as chamadas mímicas de AVC, por exemplo vasculite, tumores ou doenças inflamatórias desmielinizantes do SNC. (Fig.5). O conceito de penumbra é particularmente útil para decisões terapêuticas em casos de acidentes vasculares cerebrais com uma janela de tempo pouco clara (o chamado “golpe de despertar”).
Moderno Protocolo de AVC de CT
Utilizando a moderna tecnologia de TC, a sensibilidade para detectar o enfarte cerebral isquémico pode ser significativamente aumentada adicionando a perfusão de TC com KM e a angiografia de TC.
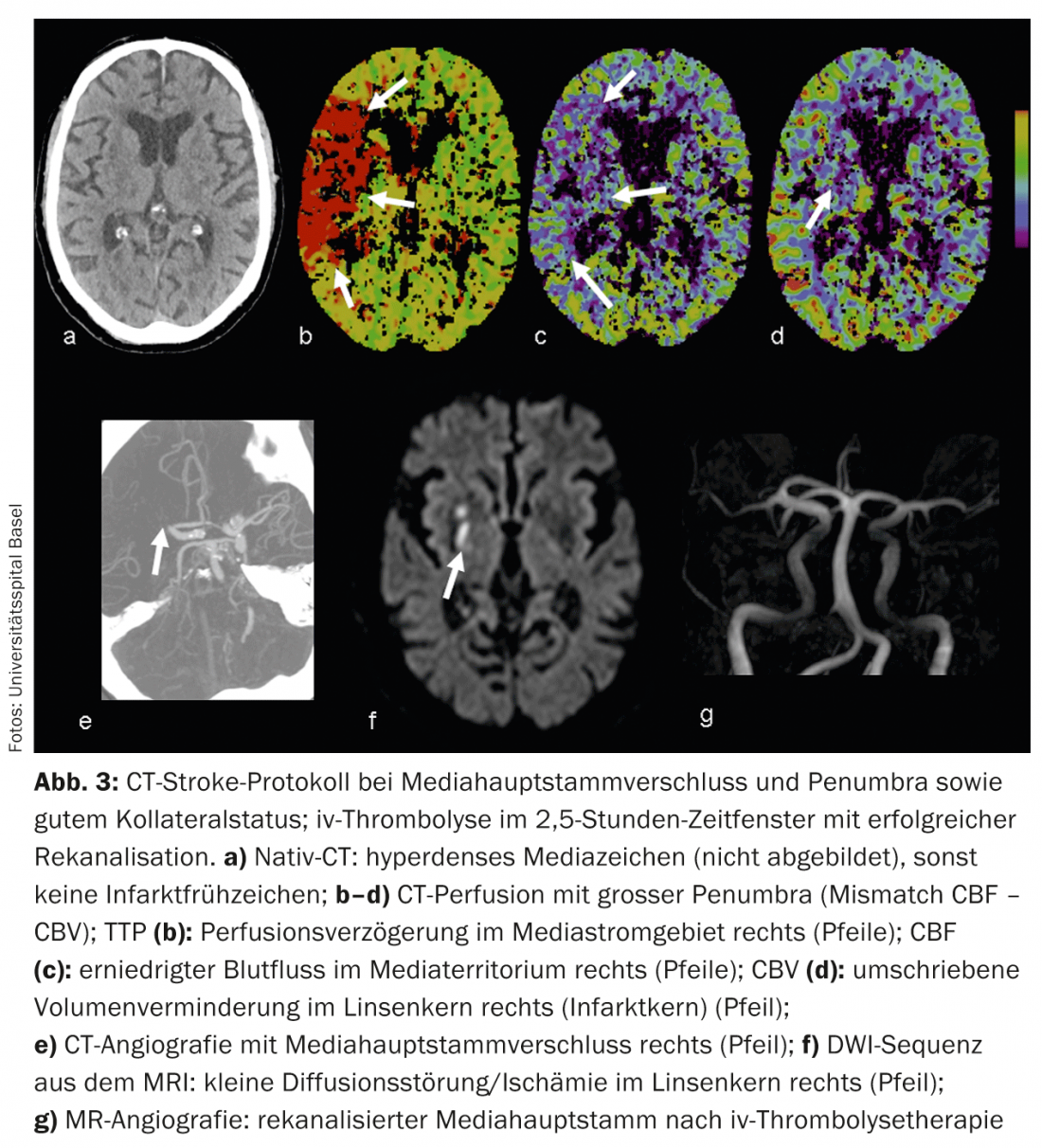
CTA: Contraste melhorado CTA retrata de forma fiável a anatomia vascular, patologia e colateralização. O estado colateral vascular tornou-se cada vez mais o foco de interesse clínico e científico. Individualmente, o estatuto colateral pode ter um impacto significativo no tempo da cascata isquémica. A colateralização intacta é prognosticamente significativa [8]; além do lema “o tempo é cérebro”, fala-se também de “a colateralização é cérebro”. O fornecimento colateral do parênquima cerebral realiza-se através do circulo arteriosus Willisi anatomicamente variado como rede primária, e também através de anastomoses leptomeníngeas entre os vários territórios vasculares como rede secundária. A forma e número de anastomoses, bem como a sua capacidade compensatória, são individualmente variáveis [9]. O estatuto colateral de um paciente pode justificar uma terapia de recanálise mecânica fora do período de 4,5 horas. Ao conhecer o estatuto colateral individual, os pacientes podem ser melhor seleccionados para diferentes formas de terapia (Fig. 2 e 3).
CTP: A perfusão por TC é uma digitalização dinâmica por TC após a administração de um bolo de contraste iv durante um período de aproximadamente 45 segundos. Algoritmos complexos de desconvolução transferem os dados para mapas de parâmetros funcionais. CBV denota o volume de sangue cerebral (fisiologicamente 4-5 ml/100 g de massa cerebral), CBF denota o fluxo de sangue cerebral, MTT denota o tempo médio de trânsito como o intervalo de tempo entre o influxo arterial e o fluxo venoso, e TTP denota o tempo de pico como o intervalo de tempo entre a injecção de bolus e o pico máximo de contraste. A avaliação dos dados em bruto é semi-automatizada e rápida. De acordo com o conceito de desencontro, a avaliação dos mapas funcionais permite uma declaração sobre a dimensão da perturbação da perfusão (“tecido em risco”) e o núcleo de enfarte irreversivelmente danificado. Desta forma, a estimativa de uma penumbra também é possível no CT dentro de poucos minutos.
Na isquemia aguda, o fluxo sanguíneo cerebral diminui. Devido à expansão reactiva do leito capilar – com a auto-regulação inicialmente intacta – o volume de sangue permanece inicialmente estável. Se a auto-regulação descompensar, especialmente com um mau estatuto colateral, a CBV diminui [10]. Áreas com diminuição da VFC correspondem ao parênquima cerebral irreversivelmente infartado e correlacionam-se bem com a área perturbada pela difusão na ressonância magnética (Fig.2 e 3). Áreas com VFC normal mas com MTT ou CBF perturbado correspondem ao “tecido em risco”, o tecido potencialmente salvável. (Fig.3). A sensibilidade para a detecção de enfarte é significativamente mais elevada para a perfusão de TC (68-83%) em comparação com a TC nativa (19-45%) ou TC nativa mais CTA (até 58%), cada uma dependendo do tamanho do enfarte [2]. Os falsos resultados negativos da perfusão por TC são encontrados em pequenos enfartes/lacunares ou em enfartes fora da secção do cérebro examinado, embora os scanners multislice modernos possam agora cobrir quase todo o cérebro num único exame.
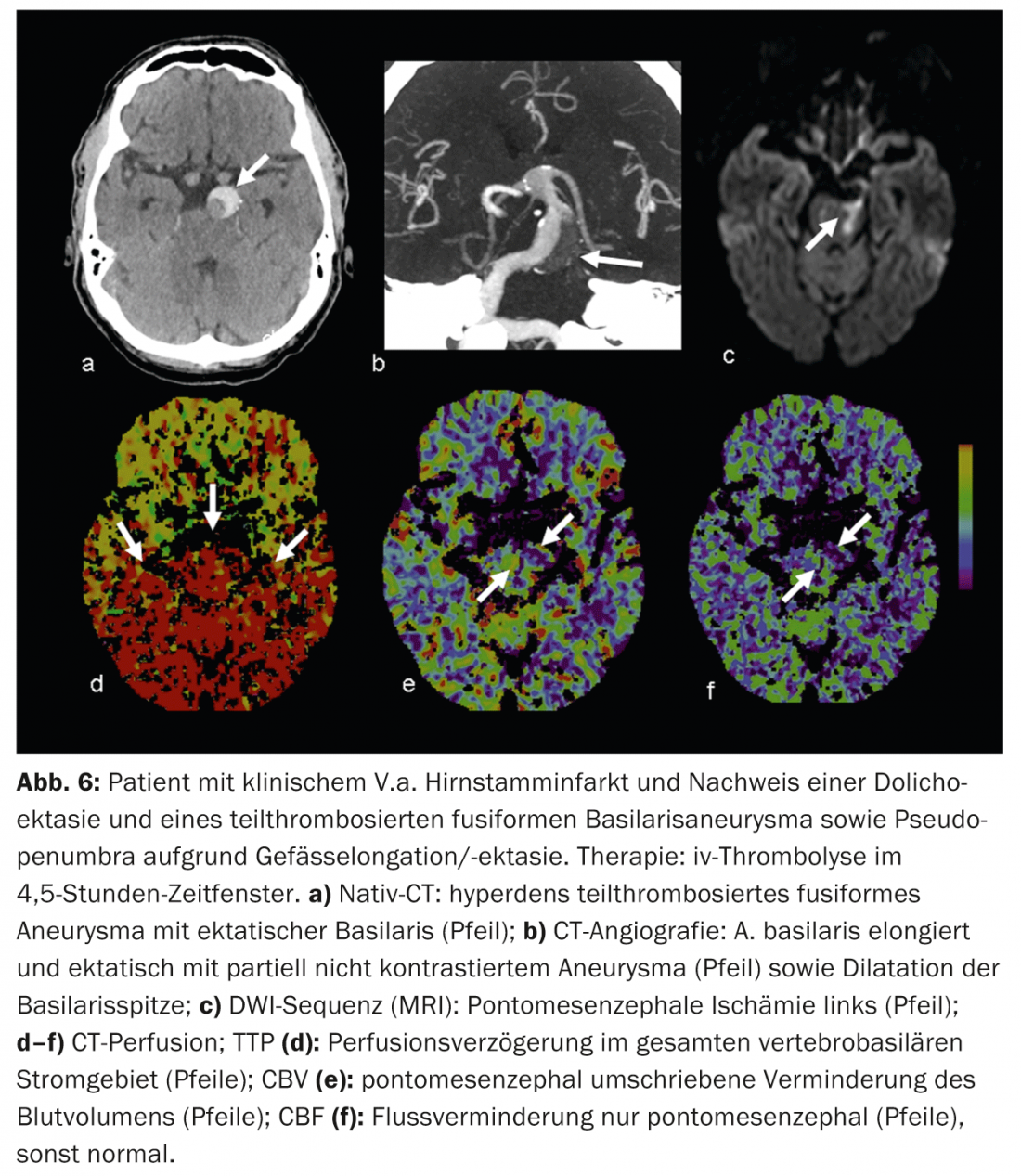
Os falsos resultados positivos são causados, por exemplo, por doenças cardiovasculares concomitantes que podem levar a um atraso na perfusão crónica e não devem ser confundidos com uma “pseudo-penumbra”, por exemplo, função de débito cardíaco reduzido na insuficiência cardíaca, estenoses vasculares de grau superior a montante (principalmente estenoses ACI), oclusões ou mesmo dolichoectasias (por exemplo, circulação posterior) (Fig. 6).
Johanna M. Lieb, MD
Literatura:
- Hacke W, et al: Trombólise com alteplase 3 a 4,5 horas após acidente vascular cerebral isquémico agudo. N Engl J Med 2008; 359: 1317-1329.
- Campbell BCV, et al: A perfusão por TC melhora a precisão diagnóstica e a confiança no derrame isquémico agudo. J Neurol Neurosurg Psychiatry 2013; 84: 613-618.
- Mokin M, et al: Tratamento endovascular do derrame isquémico agudo: o fim ou apenas o início? Neurosurg Focus 2014 Jan; 36(1): 1-10.
- Broderick JP, et al: Interventional Management of Stroke (IMS) III Investigators. Terapia endovascular após intravenoso t-PA versus t-PA apenas para AVC. N Engl J Med 2013 Mar 7; 368(10): 893-903
- Campbell BC, et al: Comparação entre a perfusão de tomografia computorizada e a perfusão-difusão por ressonância magnética em acidente vascular cerebral isquémico. Stroke 2012 Out; 43(10): 2648-2653.
- Dani KA, et al: Revisão sistemática de imagens de perfusão com tomografia computorizada e ressonância magnética em AVC isquémico agudo: heterogeneidade de parâmetros de aquisição e pós-processamento: uma colaboração de investigação em medicina translacional estudo multicêntrico de imagens de AVC agudo. Stroke 2012 Fev; 43(2): 563-566.
- Nabavi DG, et al: MOSAIC: Multimodal Stroke Assessment Using Computed Tomography: novel diagnostic approach for the prediction of infarction size and clinical outcome. Stroke 2002; 33: 2819-2826.
- Nambiar V, et al: CTA-Colateral Status and Response to Recanalization in Patients with Acute Ischemic Stroke. AJNR Am J Neuroradiol 2013 Dez 26. [Epub ahead of print]
- Liebeskind DS: Circulação colateral. Stroke 2003; 34: 2279-2284.
- Ahlhelm F, et al: Diagnóstico neurorradiológico focalizado em acidente vascular cerebral agudo. Therapeutische Umschau 2012; 69(9): 6.1-6.6.
InFo Neurologia & Psiquiatria 2014; 12(2): 8-13