A superação da barreira hematoencefálica é um pré-requisito importante para a eficácia dos antidepressivos. Um componente essencial da barreira hemato-encefálica é a glicoproteína P, que é codificada pelo gene ABCB1 e impede a maioria dos antidepressivos de atravessar para o tecido. O gene ABCB1 em humanos contém variantes que podem ter uma influência considerável no resultado da terapia. A consideração do resultado do teste ABCB1 no tratamento com antidepressivos aumenta a perspectiva de um início de acção mais rápido e de uma remissão total.
As drogas que supostamente exercem o seu efeito no cérebro não têm apenas de sobreviver à passagem pelo tracto gastrointestinal e à degradação prematura do fígado. Também têm de atravessar a barreira hemato-encefálica, que protege o cérebro de ser invadido por moléculas que possam prejudicar o cérebro. O cérebro tem uma grande necessidade de protecção e as suas células nervosas têm uma capacidade de regeneração extremamente limitada. O nosso órgão mais precioso está urgentemente dependente de um fornecimento contínuo de nutrientes, porque não pode acumular depósitos. Embora pese apenas 2% do nosso peso corporal total, mais de 20% do nosso consumo alimentar é consumido pelo nosso cérebro. Os nutrientes são fornecidos através de uma extensa rede capilar, cujo comprimento total é de uns impressionantes 600 km. A área total das paredes desta rede de capilares é de cerca de 20 m². Com uma área de contacto tão grande entre a corrente sanguínea e o cérebro, torna-se compreensível porque é que a natureza teve de desenvolver um sistema de protecção bastante diferenciado sob a forma da barreira hemato-encefálica. O seu componente mais importante são as células endoteliais, que são mantidas juntas por junções apertadas e assim impedem a difusão dos vasos sanguíneos para o tecido cerebral. Para além desta protecção passiva, as células endoteliais podem também sintetizar uma grande molécula, P-glycoprotein (P-gp), que transporta activamente a maioria das pequenas moléculas de volta à corrente sanguínea logo que estejam prontas para penetrar na parede do vaso (Fig. 1).
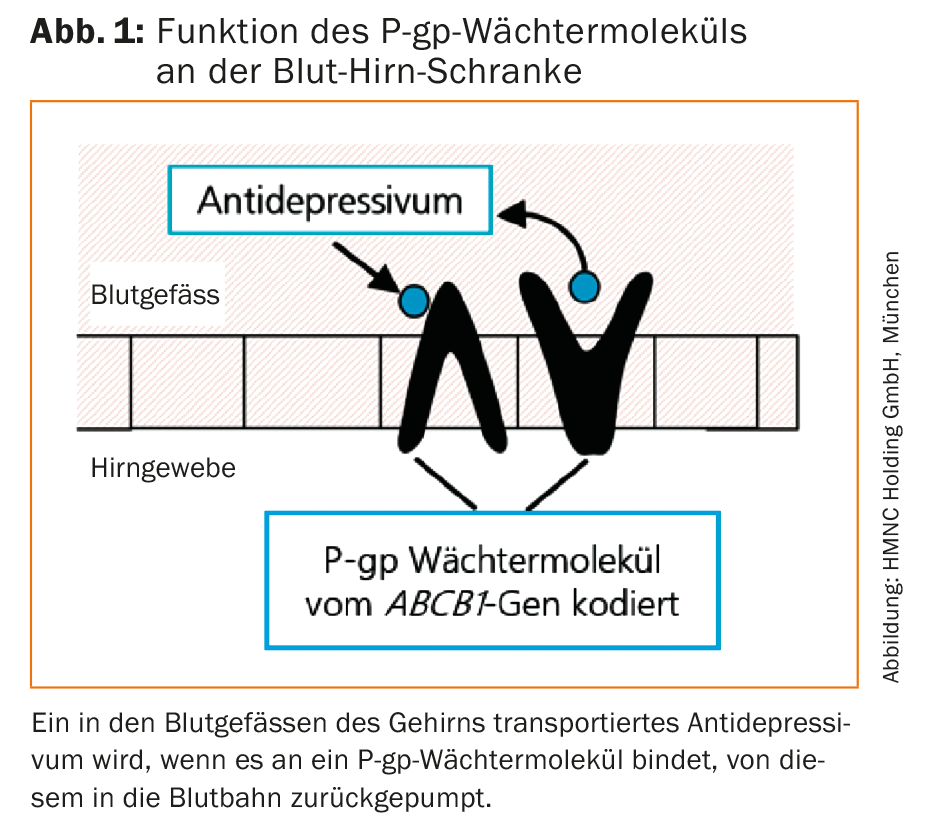
A maioria dos antidepressivos também pertence a estas pequenas moléculas. Qualquer antidepressivo que se liga ao P-gp, ou seja, é um substrato, é bombeado de volta da célula para o interior dos capilares pelo P-gp. O P-gp é assim uma espécie de “molécula guardiã” que é de considerável importância clínica não só para a terapia com antidepressivos, mas também para o tratamento com anti-epilépticos, antipsicóticos e analgésicos.
As variantes do gene ABCB1determinam a função guardiã da glicoproteína P
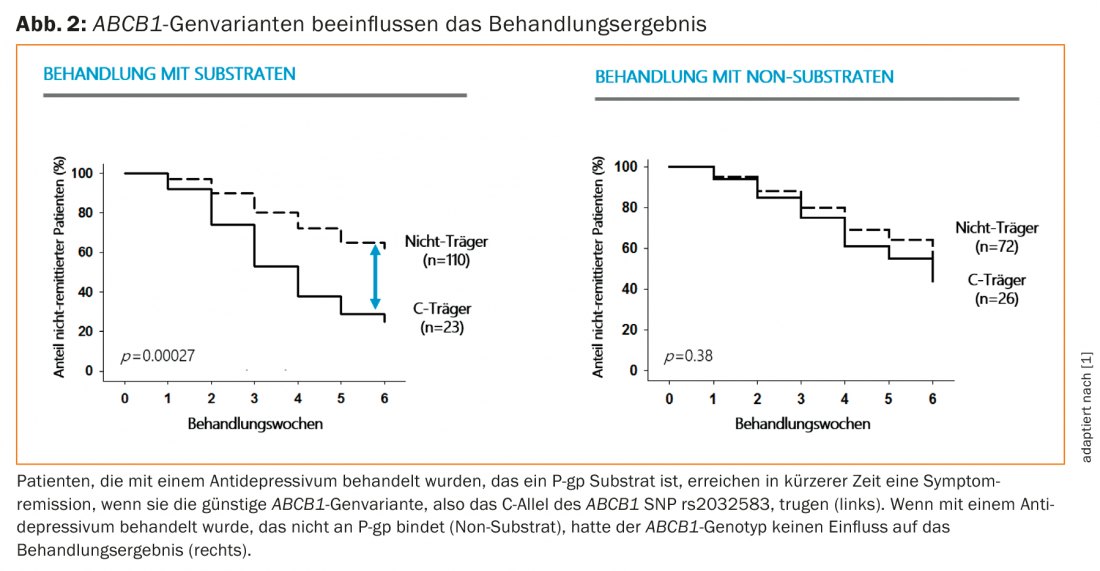
A molécula guardiã P-gp é codificada pelo gene ABCB1, que tem diversidade de variantes no ser humano. Clock et al. 2008 [1] foram os primeiros a encontrar uma associação entre a resposta ao tratamento com antidepressivos e diferentes variantes do gene ABCB1. No entanto, estas diferenças só foram observadas (Fig. 2) se o antidepressivo fosse um substrato de P-gp. Uma investigação extensiva no Instituto Max Planck de Psiquiatria em Munique tornou possível identificar polimorfismos do gene ABCB1que aparentemente estão relacionados com a função desta proteína e assim influenciar se a droga pode ter efeito no sistema nervoso central de forma suficiente. A disponibilidade suficiente do antidepressivo no tecido cerebral é indispensável para o efeito clínico desejado. A descoberta de Uhr et al. 2008 [1] contém outra mensagem importante para aqueles que geralmente duvidam da eficácia clínica dos antidepressivos: se estes medicamentos fossem ineficazes, então as variantes do gene ABCB1não teriam qualquer influência no resultado terapêutico.
Implementação clínica e experiência com o teste ABCB1– situação de estudo
Os médicos decidem qual o antidepressivo mais adequado para o paciente individual na fase actual da doença com base no seu conhecimento dos estudos clínicos, na história individual do paciente e na sua própria experiência. Os perfis de efeitos secundários de diferentes antidepressivos desempenham um papel importante nas decisões de tratamento dos médicos: um doente agitado atormentado pela inquietação interior é mais provável que lhe seja prescrito um antidepressivo sedante. O paciente que tem pouca capacidade de condução, é retraído e só participa esporadicamente na vida à sua volta é mais susceptível de ser tratado com um antidepressivo que aumenta a capacidade de condução. Muitos mecanismos farmacológicos dos medicamentos antidepressivos de que hoje dispomos são conhecidos, mas não sabemos se estes mecanismos são também aqueles para os quais os antidepressivos funcionam clinicamente. Certamente, as influências na transdução de sinal por serotonina, noradrenalina e dopamina desempenham um papel importante no efeito destas drogas. Se o medicamento antidepressivo é um substrato de P-gp está a atrair cada vez mais atenção na investigação clínica. A descoberta de Uhr et al. 2008 [1], segundo o qual os dois únicos polimorfismos nucleotídicos ( [SNPs]) rs2032583 e rs2235015 do gene ABCB1, em particular, podem prever se um doente responderá ou não a um antidepressivo prescrito, suscitou numerosos ensaios clínicos em todo o mundo [2–4]. Numa meta-análise de todos os estudos que testaram a associação entre as variantes do gene ABCB1com resposta clínica aos antidepressivos e incluíram um total de 2650 doentes, foram considerados não só os SNPs acima mencionados mas também quatro outros polimorfismos do gene ABCB1. Breitenstein et al. 2015 [5] descobriu que o SNP rs2032583 foi significativamente associado ao resultado do tratamento quando tratado com antidepressivos que são substratos de P-gp. SNP rs2235015 foi também significativamente associado ao resultado do tratamento num subgrupo mais pequeno. Não foram encontradas correlações significativas para os outros SNPs. Concluiu-se que as futuras aplicações clínicas do teste ABCB1deveriam concentrar-se no SNP rs2032583.
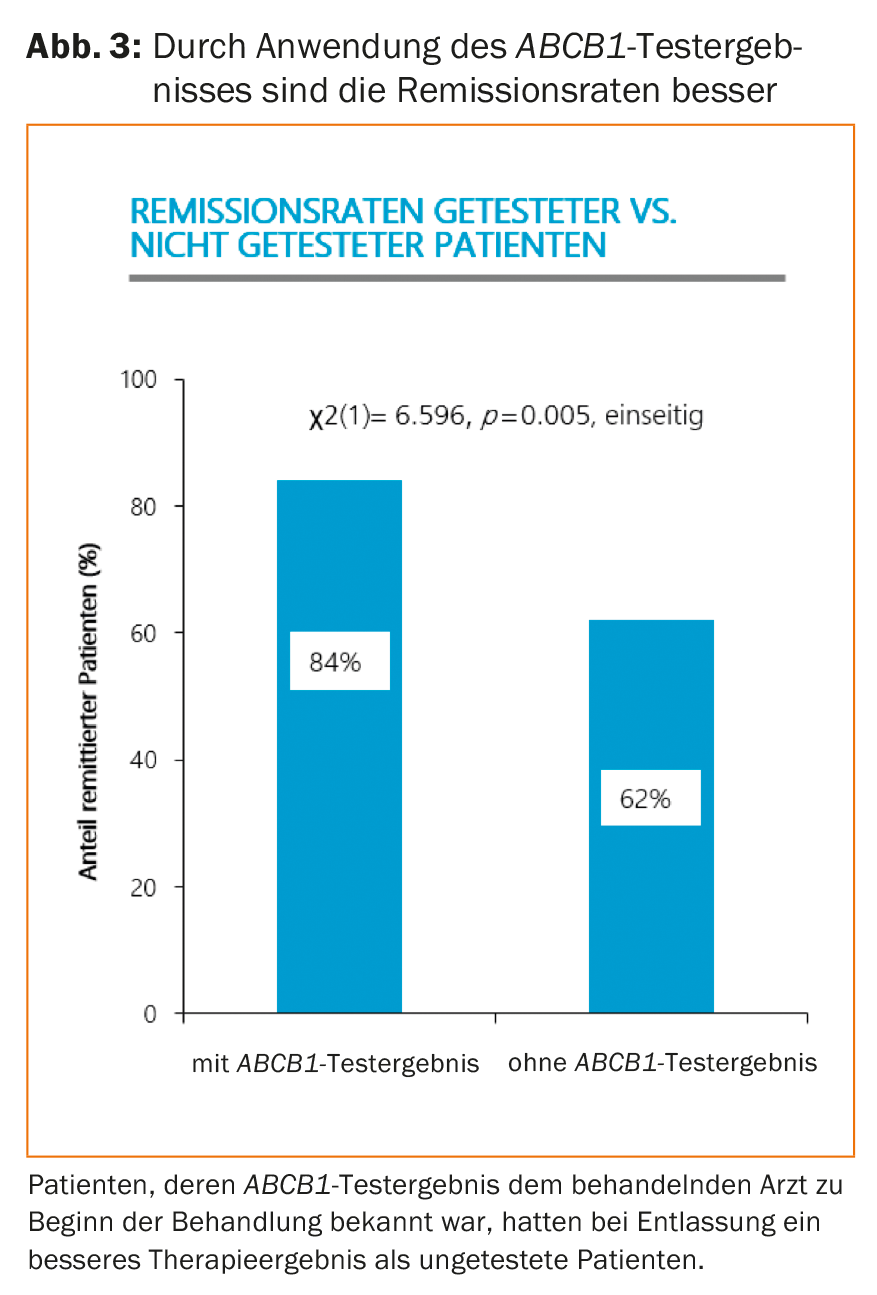
Quer o teste ABCB1seja realizado em pacientes logo no início de uma terapia antidepressiva ou apenas após um curso insatisfatório ser deixado ao critério dos médicos tratantes. Num estudo retrospectivo de Breitenstein et al. Em 2014 [6], os dados de acompanhamento dos pacientes cujo resultado do teste ABCB1era conhecido no início do tratamento foram comparados com os dados de acompanhamento dos pacientes que não foram testados. O conhecimento apenas do resultado do teste ABCB1– independentemente da presença do genótipo ABCB1favorável ou menos favorável no caso individual – levou a um melhor resultado terapêutico (Fig. 3). Os pacientes que fizeram um teste ABCB1no início do tratamento tinham uma escala de Depressão de Hamilton mais baixa no momento da alta da clínica. A pontuação medida da gravidade dos sintomas na Escala de Depressão de Hamilton também influencia a decisão se o tratamento hospitalar é transferido para terapia ambulatorial. Quanto mais cedo for atingido um valor baixo nesta escala, mais cedo o paciente pode ser dispensado de tratamento hospitalar.
Os estudos muito extensos hoje disponíveis justificam portanto a conclusão de que, para além da avaliação clínica de qual a terapia mais adequada para o paciente individual, é também útil incluir o teste ABCB1e descobrir sobre a propriedade do substrato P-gp do fármaco que deve ser prescrito. Para realizar o teste, basta enviar uma amostra de sangue para o laboratório clínico.
Para além dos benefícios individuais para os pacientes em causa, a resposta terapêutica mais rápida e o melhor resultado terapêutico têm também consequências económicas para a saúde. Estes aspectos e a melhoria da qualidade dos cuidados em geral levaram à inclusão do teste ABCB1nas recomendações de tratamento das sociedades profissionais suíças [7]. Na Alemanha, também se está a procurar a consideração do teste ABCB1nas directrizes para o tratamento da depressão.
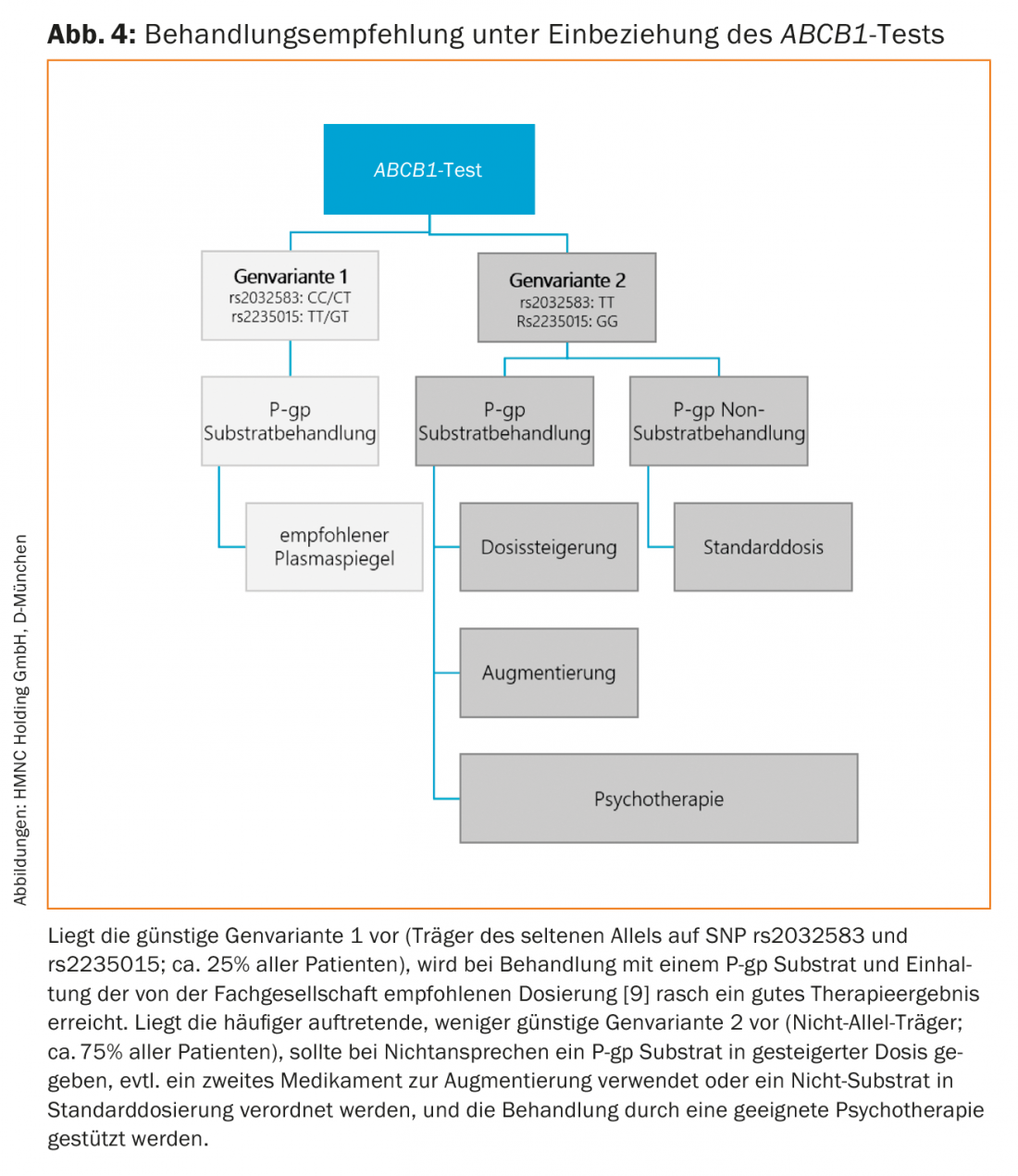
Recomendações de tratamento concreto pelo teste ABCB1: propriedade do substrato P-gp e dosagem de antidepressivos
Outro estudo clínico realizado no Instituto Max Planck de Psiquiatria investigou a influência da dosagem de drogas, ou concentração de drogas no plasma sanguíneo, em relação ao genótipo ABCB1e resultado do tratamento [8]. Foi demonstrado que os portadores do genótipo raro (alelo C do ABCB1 SNP rs2032583 e alelo T do ABCB1 SNP rs2235015) (aproximadamente 25% de todos os pacientes) responderam particularmente bem à terapia com um antidepressivo. Os pré-requisitos para uma terapia bem sucedida eram, em primeiro lugar, que o antidepressivo fosse um substrato P-gp e, em segundo lugar, que o nível plasmático do antidepressivo no sangue não excedesse a gama normal recomendada [9]. Os pacientes com este genótipo ABCB1não só responderam melhor aos antidepressivos do grupo do substrato (separador 1) na dose padrão do que os pacientes com o genótipo desfavorável (TT/GG), mas também significativamente melhor do que aqueles que receberam qualquer terapia padrão. Em pacientes com o genótipo raro ABCB1 (alelo C do ABCB1 SNP rs2032583 e alelo T do ABCB1 SNP rs2235015), se a concentração plasmática do substrato P-gp exceder a gama normal recomendada, o resultado do tratamento foi significativamente pior do que dentro da gama normal recomendada. Isto pode servir como prova adicional de que o raro genótipo ABCB1 está associado a uma “função sentinela” P-gp reduzida e que isto acaba por conduzir a uma concentração demasiado elevada da droga no cérebro quando a concentração plasmática da droga é demasiado elevada. Isto tem efeitos clínicos negativos, principalmente devido aos efeitos secundários induzidos centralmente.

O teste ABCB1 determina a expressão individual dos ABCB1 SNPs rs2032583 e rs2235015 num laboratório clínico. Os genótipos ABCB1relevantes são medidos na amostra de sangue submetida com a ajuda de um kit de teste RIDA®-PRECISION da R-Biopharm AG, utilizando o método PCR. Os resultados são enviados aos médicos assistentes, incluindo as recomendações terapêuticas resultantes. Com base nestas descobertas, desenvolvemos um esquema terapêutico para a prática (Fig. 4).
Conclusão
A terapia da depressão com antidepressivos é actualmente ainda insatisfatória: demora demasiado tempo para que o efeito ocorra, os medicamentos funcionam em muito poucos doentes e há demasiados efeitos secundários. O teste ABCB1 permite decidir quais os antidepressivos com maior probabilidade de proporcionar um bom resultado de tratamento para o paciente individual. A curta duração do tratamento e a perspectiva de uma remissão completa, e portanto a reduzida probabilidade de um novo episódio depressivo, justificam a integração do teste ABCB1 na prática clínica do tratamento da depressão.
Literatura:
- Uhr M, et al: Polimorfismos no gene do transportador de drogas ABCB1 prevêem resposta ao tratamento antidepressivo na depressão. Neuron 2008; 57: 203-209.
- O’Brien FE, Dinan TG, Griffin BT, Cryan JF: Interacções entre antidepressivos e P-glycoprotein na barreira hemato-encefálica: significado clínico das descobertas in vitro e in vivo. Br J Pharmacol 2012; 165: 289-312.
- Sarginson JE, et al: ABCB1 (MDR1) polimorfismos e resposta antidepressiva em depressão geriátrica. Pharmacogenet Genomics 2010; 20: 467-475.
- Schatzberg AF, et al: ABCB1 Genetic Effects on Antidepressant Outcomes (Efeitos Genéticos sobre os Resultados dos Antidepressivos): Um Relatório do Julgamento iSpot-D. Am J Psiquiatria 2015; 172: 751-759.
- Breitenstein B, et al: ABCB1 Gene Variants and Antidepressant Treatment Outcome: A Meta-analysis. Am J Med Genet Parte B Neuropsichiatr Genet 2015; 168B(4): 274-283.
- Breitenstein B, et al: A aplicação clínica da genotipagem ABCB1 no tratamento antidepressivo: um estudo piloto. CNS Spectr 2014; 19: 165-175.
- Holsboer-Trachsler E, et al: O tratamento somático das perturbações depressivas unipolares: Actualização 2016, parte 1. O tratamento agudo de episódios depressivos. Swiss Med Forum 2016; 16(35): 716-724.
- Breitenstein B, et al: Associação de variantes do gene ABCB1, concentração plasmática antidepressiva, e resposta ao tratamento: Resultados de um estudo clínico aleatório. J Psiquiatra Res 2016; 73: 86-95.
- Baumann P, et al: The AGNP-TDM Expert Group Consensus Guidelines: Therapeutic Drug Monitoring in Psychiatry. Farmacopsiquiatria 2004; 37: 243-265.
InFo NEUROLOGIA & PSYCHIATRY 2016; 14(6): 36-40