O tratamento da hidradenite supurativa continua a ser um desafio clínico. Muitas vezes, é necessária uma combinação de diferentes modalidades de tratamento para alcançar um grau suficiente de controlo da doença. Um estudo demonstrou que a utilização combinada de adalimumab em paralelo com a excisão cirúrgica é eficaz e segura. Até ao momento, o adalimumab é o único medicamento biológico aprovado para a SS, mas vários outros candidatos a medicamentos anti-inflamatórios sistémicos estão actualmente a ser investigados em programas de ensaios clínicos.
A hidradenite supurativa (HS) é uma doença crónica, recidivante, progressiva e imunomediada. Os nódulos, abcessos e fístulas ocorrem preferencialmente a nível axilar, inguinal e anogenital e podem ser muito dolorosos. Se o tratamento não for efectuado suficientemente cedo, as inflamações podem evoluir para danos irreversíveis nos tecidos, explicou o Prof. Dr. Falk Bechara, médico sénior de Dermatologia no Hospital Universitário da Universidade Ruhr de Bochum (D) [1]. A HS pode ser diagnosticada utilizando os seguintes critérios [2–4]:
- morfologia característica das lesões,
- distribuição característica das lesões,
- Cronicidade e manifestações recorrentes
Se um doente preencher todos estes três critérios de diagnóstico, é HS com uma sensibilidade de 90% e uma especificidade de 97% [2–4]. A gravidade da HS é geralmente avaliada de acordo com a classificação de Hurley [2–4] (ligeiro=estágio I, moderado=estágio II, grave=estágio III). No que respeita à fisiopatologia, há ainda muitas questões em aberto, disse o orador. Parece que muitos mediadores inflamatórios e outros parâmetros estão sobre-regulados nos doentes com HS.
Actualmente, as opções de tratamento mais importantes para a HS são: antibióticos sistémicos, cirurgia e produtos biológicos. O Prof. Bechara acrescentou que, normalmente, várias destas abordagens terapêuticas são combinadas [1].
OP: Mudança de paradigma relativamente à abordagem
A intervenção cirúrgica é normalmente necessária para os doentes nos estádios II ou III de Hurley [11]. O objectivo principal é remover os trajectos da fístula e evitar a ocorrência recorrente de lesões individuais [12,13]. Uma ressecção anatómica completa e profilática para as fístulas iniciais, tal como era praticada no passado, já não seria feita hoje em dia, explicou o Prof. Em vez disso, a atenção centra-se actualmente na identificação dos danos irreversíveis nos tecidos. O objectivo é ressecar as fases irreversíveis da cicatrização fistulizante e não apenas todas as manifestações da doença inflamatória. O conferencista explicou que as lesões planas também podem ser operadas de forma plana e combinadas com medicação; nem sempre é necessário um procedimento radical.
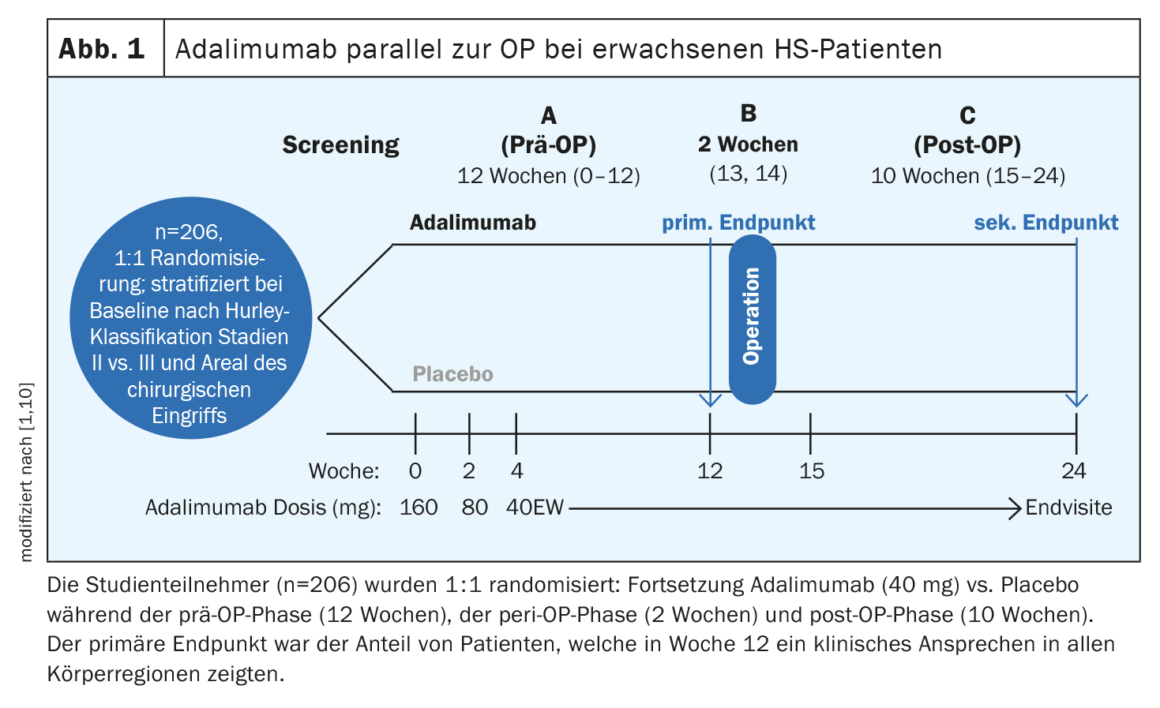
O adalimumab paralelo à cirurgia revelou-se eficaz e seguro
Para além do adalimumab, nenhum outro medicamento biológico ultrapassou os obstáculos de aprovação até agora. “Temos uma preparação que funciona e também estamos a trabalhar com ela, mas há muito espaço para melhorias”, resumiu o orador [1]. Nos ensaios PIONEER I e II, o adalimumab atingiu taxas de resposta HiSCR50 de 42% e 59%, respectivamente, em comparação com 26% e 28% para o placebo [5]. Antes de uma intervenção cirúrgica, coloca-se frequentemente a questão de saber se se deve ou não suspender o medicamento biológico. Num estudo publicado em 2021, o adalimumab demonstrou ser eficaz em combinação com uma grande cirurgia seguida de cicatrização secundária, sem necessidade de interromper o tratamento antes da cirurgia [10]. O estudo SHARPS (Safety and Efficacy of Adalimumab for Hidradenitis Suppurativa Peri-Surgically) foi um estudo de fase IV, aleatório, em dupla ocultação e controlado por placebo, de adalimumab em combinação com cirurgia (Fig. 1) . Um total de 103 doentes foram aleatorizados para adalimumab e 103 para placebo. A idade média (DP) foi de 37,6 (11,3) anos e 51% dos participantes eram mulheres. Uma resposta clínica à HS em todas as regiões do corpo foi alcançada na semana 12 em 48% dos participantes do estudo que tomaram adalimumab e 34% que tomaram placebo (p=0,049). Os eventos adversos relacionados com o tratamento foram registados em 72% no grupo do adalimumab e em 69% no grupo do placebo. Não foi observado um aumento do risco de infecções da ferida pós-operatória, complicações ou hemorragias com o adalimumab em comparação com o placebo.
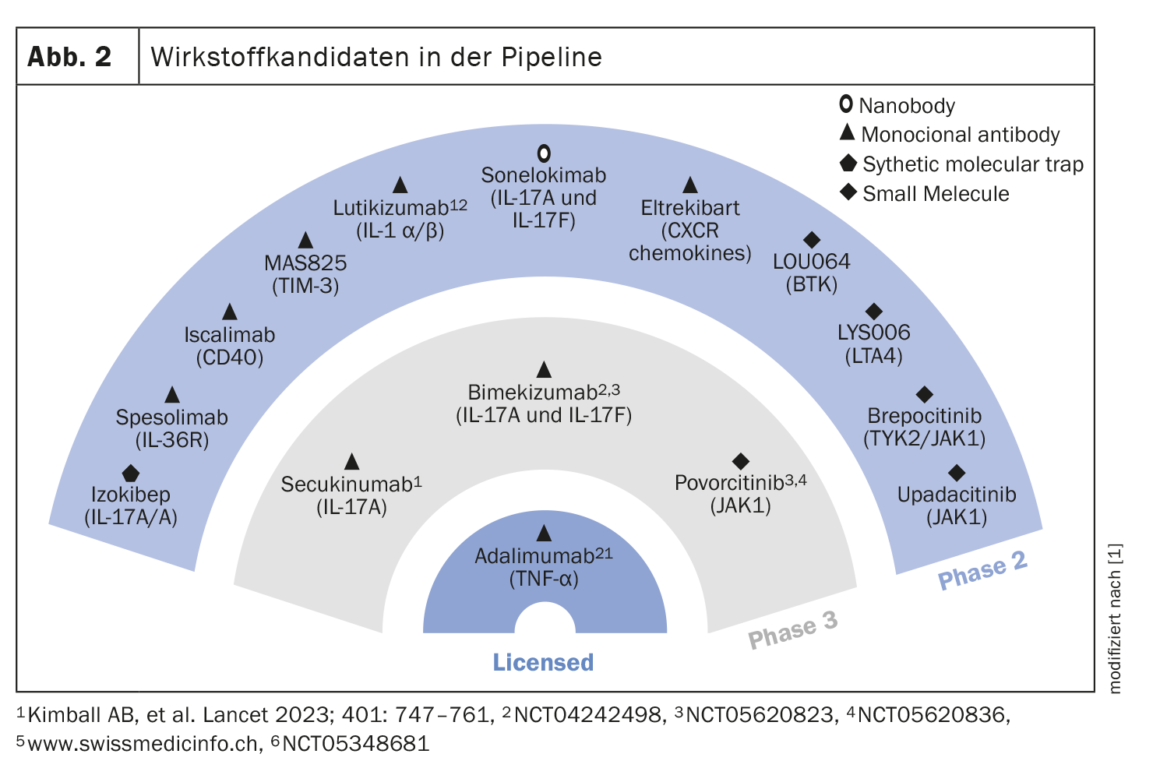
Outros candidatos a medicamentos na calha
Os candidatos a medicamentos actualmente em investigação nas fases II e III são apresentados na Figura 2. Em dois ensaios clínicos, o inibidor da IL17A secukinumab em duas doses (300 mg de 2 em 2 semanas ou de 4 em 4 semanas) demonstrou ter taxas de resposta estáveis até à semana 52, com 54,8% e 55,3% no SUNSHINE e 63,4% e 58,6% no SUNRISE [6]. O inibidor duplo de IL17A/F bimekizumab (320 mg q2w) atingiu o objectivo primário de HiSCR50 no ensaio BE HEARD I em comparação com o placebo, e também atingiu o nível de significância no BE HEARD II. Um anticorpo monoclonal que tem como alvo o IL36R é o espesolimab [7]. Num estudo de prova de conceito, o espesolimab demonstrou ser muito eficaz na semana 12, particularmente no que diz respeito a fístulas drenantes. A dose de carga foi de 1200 mg (i.v.) nas semanas 0, 1 e 2. Na terapia de manutenção, a mesma dose foi administrada nas semanas 4, 6, 8 e 10. Outro candidato a medicamento que está a ser investigado para utilização na SH é o Izokibep. O seu alvo é o homodímero IL17A. O tamanho reduzido da molécula permite uma melhor penetração nos tecidos. Num estudo aberto não controlado por placebo com 30 doentes, uma percentagem de 71% obteve uma resposta HiSCR50 na semana 12 com Izokibep 160 mg [8]. O povorcitinib é um inibidor selectivo da JAK1 para o qual estão disponíveis dados de fase II para a área de indicação HS. Na dose mais elevada (90 mg), mais de 80% de 9 doentes atingiram HiSCR50 na semana 8 [9].
Congresso: Conferência Anual do DDG
Literatura:
- «Acne inversa: Medikamente, Messer, Mischung», Prof. Dr. med. Falk Bechara, DDG-Jahrestagung, 26.–29.04.2023.
- Johnston LA, et al.: Practical Guidelines for Managing Patients With Hidradenitis Suppurativa: An Update. J Cutan Med Surg 2022; 26(2_suppl): 2S–24S.
- Daxhelet M, et al.: Proposed definitions of typical lesions in hidradenitis suppurativa. Dermatology 2020; 236(5): 431–438.
- Revuz JE, Jemec GBE: Diagnosing hidradenitis suppurativa. Dermatol Clin 2016; 34(1): 1–5.
- Kimball AB, et al.: Two Phase 3 Trials of Adalimumab for Hidradenitis Suppurativa. NEJM 2016; 375: 422–434.
- Kimball AB, et al.: Secukinumab in moderate-to-severe hidradenitis suppurativa (SUNSHINE and SUNRISE): week 16 and week 52 results of two identical, multicentre, randomised, placebo-controlled, double-blind phase 3 trials. Lancet 2023; 401(10378): 747–761.
- Alavi et al. Spesolimab for Hidradenitis Suppurativa: a proof-of-concept study in patients with Hidradenitis suppurativa. AAD 2023; Poster 43019
- Papp K, et al.: Izokibep, a novel IL17A-inhibitor demnstrates HiSCR100 Responses in moderate-to-severe Hidradenitis suppurativa: week 12 results of open-label par A of a Phase 2b/3-study. AAD 2023; Late-breaking oral.
- Alavi A, et al.: Janus kinase 1 inhibitor INCB054707 for patients with moderate-to-severe hidradenitis suppurativa: results from two phase II studies. Br J Dermatol 2022; 186(5): 803–813.
- Bechara FG, et al.: Efficacy and Safety of Adalimumab in Conjunction With Surgery in Moderate to Severe Hidradenitis Suppurativa: The SHARPS Randomized Clinical Trial. JAMA Surg 2021; 156(11): 1001–1009.
- Schuch A, Absmaier-Kijak M, Volz T: Acne inversa/Hidradenitis suppurativa – Von der Pathogenese zur Therapie. Akt Dermatol 2019; 45: 277–287.
- Melendez Gonzalez MDM, Sayed CJ. Surgery is an essential aspect of managing patients with hidradenitis suppurativa. J Am Acad Dermatol 2020; 83(3): 979–980.
- Janse I, et al.: Surgical procedures in hidradenitis suppurativa. Dermatol Clin 2016; 34(1): 97109.
DERMATOLOGIE PRAXIS 2023; 33(3): 28–29