A histologia (ressecção tumoral ou biopsia) é essencial para diagnosticar gliomas de grau superior e avaliar o prognóstico e a terapia. Os marcadores moleculares servem como suplemento à classificação da OMS relativamente ao curso esperado da doença e à resposta terapêutica à quimioterapia alquilante. A terapia padrão para pacientes com menos de 65 ou 70 anos consiste em radioterapia e quimioterapia combinadas com temozolomida concomitante e adjuvante (TMZ). Os pacientes com mais de 65 ou 70 anos de idade têm uma vantagem de sobrevivência com quimioterapia com TMZ no caso de um promotor de MGMT metilado; sem um promotor de MGMT metilado, só a radioterapia é recomendada. Nos oligodendrogliomas anaplásicos e oligoastrocitomas com codeleção 1p/19q, existe uma vantagem de sobrevivência no caso de quimioterapia alquilante precoce (PCV ou TMZ).
Os gliomas anaplásicos e glioblastomas estão entre os tumores cerebrais malignos mais comuns. Caracterizam-se por um prognóstico desfavorável. A confirmação histológica através de biopsia do tecido cirúrgico é necessária para estabelecer o diagnóstico. Para todos os gliomas malignos, deve visar-se um elevado grau de ressecção, na medida do possível sem ter de aceitar um défice neurológico permanente, devido ao prognóstico mais favorável. Os tumores cerebrais são classificados em graus I a IV de acordo com a classificação da OMS (2007) com base em critérios anatómico-patológicos. O objectivo desta classificação é fornecer orientações sobre prognóstico, curso clínico e opções de tratamento baseadas em provas, com base no grau de malignidade.
Marcadores moleculares
Nos últimos anos, foram identificados marcadores moleculares que caracterizam subtipos de glioma com diferentes prognósticos e respostas às terapias. Um marcador com valor prognóstico informa sobre o prognóstico da doença independentemente da terapia efectuada. Particularmente relevante para a tomada de decisões clínicas é um marcador com valor preditivo que prevê a resposta a uma determinada terapia.
- 1p/19q codeletion: Um marcador molecular estreitamente associado a tumores oligodendrógicos é a perda combinada dos braços cromossómicos 1p e 19q (“perda de heterozigosidade”, LOH-1p/19q, 1p/19q codeletion).
- Promotor do MGMT: Outro marcador importante é o estado de metilação do promotor da metiltransferase de O6-metilguanina ADN (MGMT). A MGMT é uma proteína reparadora do ADN que reduz os efeitos da quimioterapia alquilante. No caso da metilação promotora, o gene MGMT é expresso a um nível reduzido, melhorando assim relativamente a eficácia da quimioterapia alquilante. Um promotor de MGMT metilado tem um valor prognóstico favorável para gliomas de grau III e IV da OMS e, dependendo do subgrupo, é também preditivo em termos de vantagem de sobrevivência no caso de quimioterapia alquilante.
- Mutação IDH: Um marcador prognóstico favorável em todas as gliomentidades é uma mutação no gene da isocitrato desigenase(IDH)-1 ou -2. Os doentes com astrocitoma anaplásico sem mutação IDH (tipo selvagem IDH) têm um prognóstico menos favorável do que os doentes com glioblastoma com mutação IDH [1]. Pensa-se que os glioblastomas alterados pelo IDH tenham surgido de tumores de grau II ou III em termos de progressão maligna (glioblastomas secundários), em contraste com os glioblastomas primários, que são caracterizados pelo tipo selvagem do IDH e provavelmente representam uma entidade biologicamente diferente.
A seguir, apresentaremos uma panorâmica das opções de tratamento actuais, tendo em conta a classificação da OMS, os marcadores moleculares bem como a idade dos pacientes; uma via de decisão clínica sugerida está resumida nas Figuras 1 e 2 .


Oligodendrogliomas anaplásticos e oligoastrogliomas de grau III da OMS
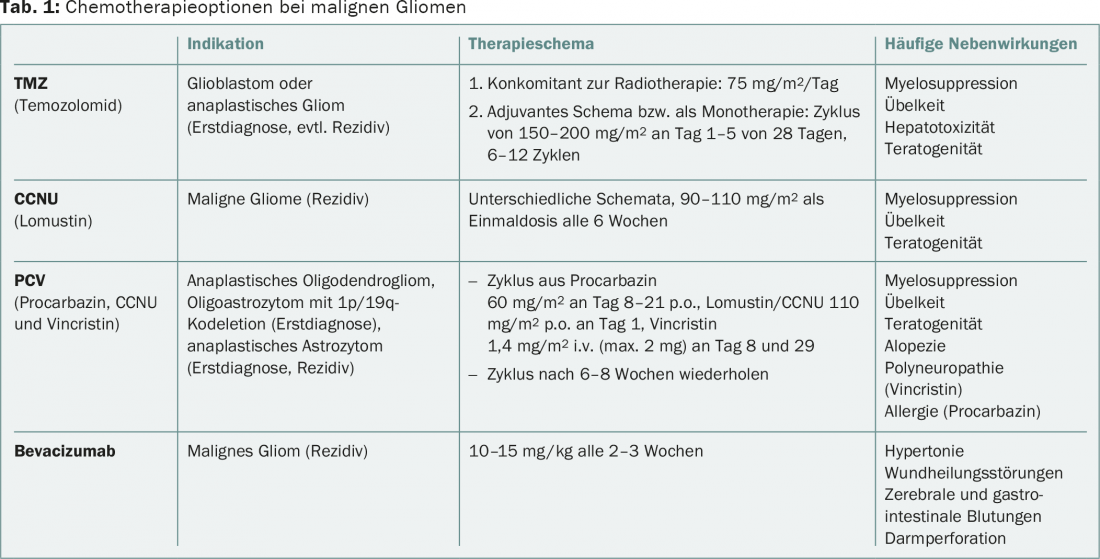
A presença de uma codificação 1p/19q, estritamente associada à mutação IDH, é crucial para a decisão terapêutica em gliomas anaplásicos de origem oligodendroglial. Estes pacientes beneficiam de uma combinação de radioterapia e quimioterapia com procarbazina, lomustina (CCNU) e vincristina (regime PCV) no diagnóstico inicial em comparação com a radioterapia apenas, de acordo com o seguimento a longo prazo dos ensaios RTOG-9402 e EORTC-26951 [2,3]. Os dados do estudo NOA-04 mostram uma eficácia igual dos regimes com PCV resp. com temozolomida (TMZ) em gliomas anaplásicos em geral. Devido à toxicidade do regime PCV, a TMZ mais bem tolerada é frequentemente preferida. Que a quimioterapia alquilante por si só é equivalente à combinação directa de quimioterapia e radioterapia, uma vez que a terapia de primeira linha é bastante improvável quando se consideram os dados disponíveis. No caso de quimioterapia apenas no diagnóstico inicial, a radioterapia deve ser administrada em caso de progressão tumoral. Além disso, não existem recomendações terapêuticas padronizadas para a recidiva de tumores. As opções de glioblastoma também podem ser aplicadas (Tab. 1).
Astrocitomas anaplásticos, OMS grau III
Segundo o ensaio NOA-04, para a terapia de primeira linha, a quimioterapia com TMZ ou PCV seguida de radioterapia em caso de recidiva é equivalente à radioterapia primária seguida de TMZ ou PCV em caso de recidiva. Para pacientes com glioma anaplástico sem codeleção 1p/19q, o papel da quimioterapia com TMZ para além da radioterapia no tratamento de primeira linha está actualmente a ser investigado num ensaio de fase III (ensaio CATNON). A codeleção 1p/19q, a metilação promotora da MGMT e a mutação IDH são biomarcadores prognósticos e podem ser úteis na diferenciação de tumores oligodendrógicos (1p/19q) bem como glioblastomas (IDH). Além disso, nos gliomas anaplásicos sem mutação IDH, um promotor de MGMT metilado é preditivo de sobrevivência prolongada sem progressão no caso de quimioterapia alquilante com ou sem radioterapia. Para a recorrência de tumores após radioterapia e quimioterapia com TMZ ou PCV, não há recomendações fiáveis; as opções são análogas às da recorrência do glioblastoma.
Glioblastoma, grau IV da OMS
Os factores prognósticos desfavoráveis nos glioblastomas são a velhice, o mau estado de Karnofsky-Perfomance-Status, a baixa extensão da ressecção, a falta de mutação IDH e um promotor de MGMT não meticuloso. A radioterapia com quimioterapia concomitante e adjuvante com TMZ, que foi estabelecida desde o ensaio EORTC-NCIC, continua a ser considerada como terapia de primeira linha [4]. A metilação promotora de MGMT é também preditiva de uma boa resposta à radiochemoterapia. Para pacientes idosos com mais de 65 ou 70 anos de idade sem estratificação de acordo com o perfil molecular, nenhuma vantagem clinicamente relevante da radiochemoterapia combinada foi provada até agora, tendo em conta a elevada toxicidade do regime em pacientes idosos. Para pacientes idosos com promotor de MGMT metilado, foi demonstrado um benefício de sobrevivência com monoterapia com TMZ em comparação com a radioterapia [5,6]. Sem conhecimento do estado da MGMT ou no caso do promotor da MGMT não metilada, a terapia de escolha em doentes idosos é a radioterapia isolada com um protocolo hipofractor (10× 3,4 Gy), que é equivalente ou possivelmente superior à radioterapia fraccionada convencionalmente [6].
O Bevacizumab, um anticorpo contra o factor de crescimento endotelial vascular (VEGF), não mostrou qualquer efeito na sobrevivência global em dois ensaios aleatórios da fase III [7,8].
Os resultados do ensaio da fase III EF-14 foram apresentados no final de 2014. Mostrou um benefício de sobrevivência de 19,6 vs. 16,6 meses com a adição de NovoTTF-100A (Campos de Tratamento de Tumores) à terapia padrão [9]. A terapia consiste em campos eléctricos alternados aplicados à cabeça através de uma máscara durante pelo menos 18 horas por dia. O valor do NovoTTF para a terapia de primeira linha do glioblastoma na prática clínica está actualmente a ser discutido em círculos de peritos, bem como pelas autoridades reguladoras.
Em caso de progressão do tumor, as opções de tratamento são limitadas, não padronizadas e pouco baseadas em provas. Uma nova ressecção pode ser útil em pacientes jovens com um bom estado geral e uma localização favorável do tumor. As quimioterapias incluem nitrosoureas tais como lomustine/CCNU, TMZ novamente ou bevacizumab (tab. 1). Mais informações podem ser encontradas nas directrizes da Associação Europeia de Neuro-Oncologia (EANO) [10].
Terapias de apoio
Para além da terapia específica para tumores, o uso óptimo de corticosteróides, drogas anticonvulsivantes e apoio psico-oncológico é muito importante para a gestão dos gliomas. Os esteróides (dexametasona até um máximo de 16 mg como dose única de manhã) podem ser úteis em caso de deterioração clínica ou pressão intracraniana e durante a radioterapia. Para evitar efeitos secundários, deve visar-se uma utilização limitada no tempo, dependendo da clínica. Para a terapia anticonvulsiva, substâncias não indutoras de enzimas como o levetiracetam ou a lamotrigina são preferíveis. Também muito potente na profilaxia das convulsões é o ácido valpróico inibidor de enzimas, para o qual os efeitos directos antitumorais também estão a ser discutidos.
Perspectivas
Nos ensaios clínicos actuais, as abordagens imunoterapêuticas são particularmente promissoras. Os estudos de vacinação utilizam vacinas com moléculas alvo específicas de tumores, por exemplo a variante do receptor EGFR EGFRvIII (estudo ACT-IV, fase III) ou com combinações de antigénios associados a tumores (estudo ICT-107 fase II), ou abordagens baseadas em células, incluindo células dendríticas activadas. Entre as terapias imunomoduladoras, os inibidores da via de sinalização de morte-1 programada ou ligand são particularmente dignos de nota. Apesar dos avanços na compreensão da biologia molecular do glioblastoma, é necessário um maior desenvolvimento de terapias translacionais bem sucedidas para melhorar as ainda limitadas opções terapêuticas.
Literatura:
- Hartmann C, et al.: Sobrevivência a longo prazo no glioblastoma primário com versus sem mutações de isocitrato desidrogenase. Clin Cancer Res 2013; 19(18): 5146-5157.
- van den Bent MJ, et al: Adjuvant Procarbazine, Lomustine, and Vincristine Chemotherapy in Newly Diagnosed Anaplastic Oligodendroglioma: Long-Term Follow-Up of EORTC Brain Tumor Group Study 26951. Journal of Clinical Oncology 2013; 31(3): 344-350.
- Cairncross G, et al: Ensaio Fase III de quimioradioterapia para oligodendroglioma anaplásico: resultados a longo prazo do RTOG 9402. J Clin Oncol 2013; 31(3): 337-343.
- Stupp R, et al: Radioterapia mais concomitante e temozolomida adjuvante para glioblastoma. N Engl J Med 2005; 352(10): 987-996.
- Wick W, et al: Quimioterapia temozolomida apenas versus radioterapia apenas para astrocitoma maligno em idosos: o ensaio NOA-08 aleatorizado, fase 3. Lancet Oncol 2012; 13(7): 707-715.
- Malmström A, et al: Temozolomida versus radioterapia padrão de 6 semanas versus radioterapia hipofractiva em doentes com mais de 60 anos com glioblastoma: o ensaio nórdico aleatório, fase 3. Lancet Oncol 2012; 13(9): 916-926.
- Chinot OL, et al: Bevacizumab plus radiotherapy-temozolomide para glioblastoma recém-diagnosticado. N Engl J Med 2014; 370(8): 709-722.
- Gilbert MR, et al: Um ensaio aleatório de bevacizumab para glioblastoma recém-diagnosticado. N Engl J Med 2014; 370(8): 699-708.
- Stupp R, et al: NT-40 Interim Analysis of the EF-14 Trial: A Prospective, Multi-center Trial of NovoTTF-100A Together With Temozolomide Compared to Temozolomide Alone in Patients with Newly Diagnosed GBM. Neuro-Oncologia 2014; 16 (suppl 5): v167.
- Weller M, et al: Directriz EANO para o diagnóstico e tratamento de gliomas anaplásicos e glioblastoma. Lancet Oncol 2014; 15(9): e395-403.
InFo ONCOLOGy & HEMATOLOGy 2015; 3(3-4): 24-27