A gestão do tratamento de doentes com cancro do endométrio primariamente avançado ou recorrente está a mudar. O potencial do dostarlimab, que é particularmente eficaz em doentes com deficiência de reparação da incompatibilidade/elevada instabilidade de microssatélites, oferece a oportunidade de o conseguir. No entanto, as novas análises intercalares também alimentam a esperança de mais.
O carcinoma do endométrio é o sexto cancro mais frequente nas mulheres em todo o mundo e o segundo tipo de cancro ginecológico mais frequente. No tratamento de primeira linha do carcinoma do endométrio primário avançado ou recorrente, a carboplatina mais paclitaxel é geralmente utilizada como quimioterapia padrão. No entanto, os resultados a longo prazo continuam a ser fracos, com um tempo médio de sobrevivência global inferior a 3 anos. Os tumores deficientes em reparação de incompatibilidades (dMMR) com elevada instabilidade de microssatélites (MSI-H) representam 25-30% dos cancros do endométrio. A expressão aumentada do recetor 1 de morte celular programada (PD-1) e dos seus ligandos (PD-L1 e PD-L2), bem como a elevada carga mutacional dos tumores dMMR-MSI-H, tornam-nos potencialmente susceptíveis às terapêuticas anti-PD-1 e anti-PD-L1. Por conseguinte, o inibidor ativo do ponto de controlo imunitário que tem como alvo o recetor PD-1, o dostarlimab, foi investigado em mais pormenor para esta clientela. O medicamento foi aprovado na Suíça com base nos resultados do ensaio GARNET para o tratamento de doentes adultos com cancro do endométrio (CE) MSI-H dMMR recorrente ou avançado que tenha progredido durante ou após um tratamento anterior com um regime contendo platina. Os dados demonstram também uma atividade antitumoral duradoura em doentes com tumores mismatch repair-proficient (pMMR), microsatellite-stable (MSS), embora a resposta tenha sido menos frequente do que em doentes com tumores dMMR-MSI-H. Uma vez que a quimioterapia citotóxica pode também ter efeitos imunomoduladores, como a perturbação das vias de sinalização imunossupressoras e uma resposta reforçada das células T citotóxicas, a combinação de quimioterapia e imunoterapia pode ter efeitos sinérgicos no microambiente tumoral. Foram comunicados benefícios clínicos, incluindo uma maior sobrevivência, com esta combinação em vários cancros.
Concentre-se na sobrevivência sem progressão e na sobrevivência global
Num estudo aleatório, em dupla ocultação, de fase III, a eficácia e a segurança do dostarlimab em combinação com carboplatina e paclitaxel foram analisadas em comparação com placebo mais carboplatina e paclitaxel em 494 doentes com cancro do endométrio primário avançado ou recorrente. As doentes foram aleatorizadas numa proporção de 1:1, as doentes receberam 500 mg do anticorpo monoclonal ou placebo por via intravenosa em combinação com carboplatina a uma área sob a curva de 5 mg por mililitro por minuto e paclitaxel a uma dose de 175 mg por metro quadrado de área de superfície corporal por via intravenosa de três em três semanas durante os primeiros seis ciclos, seguido de dostarlimab (1000 mg) ou placebo, por via intravenosa, de seis em seis semanas, durante um período máximo de três anos ou até à progressão da doença, interrupção do tratamento devido a efeitos tóxicos, desistência do doente, decisão do investigador de retirar o doente ou morte.
Os endpoints primários foram a sobrevivência livre de progressão (PFS) em doentes com cancro do endométrio dMMR MSI-H primário avançado ou recorrente e na população em geral, e a sobrevivência global (OS) na população em geral. A sobrevivência sem progressão foi definida como o tempo decorrido desde a aleatorização até à data mais antiga de avaliação radiológica de doença progressiva ou morte por qualquer causa na ausência de doença progressiva, consoante o que ocorrer primeiro. A sobrevivência global foi definida como o tempo decorrido desde a aleatorização até à morte por qualquer causa. Os endpoints secundários incluíram a sobrevivência livre de progressão determinada por uma revisão central independente e cega, resposta objetiva, controlo da doença, duração da resposta, tempo até à segunda progressão da doença, resultados relatados pelos doentes e análises farmacocinéticas e de imunogenicidade.
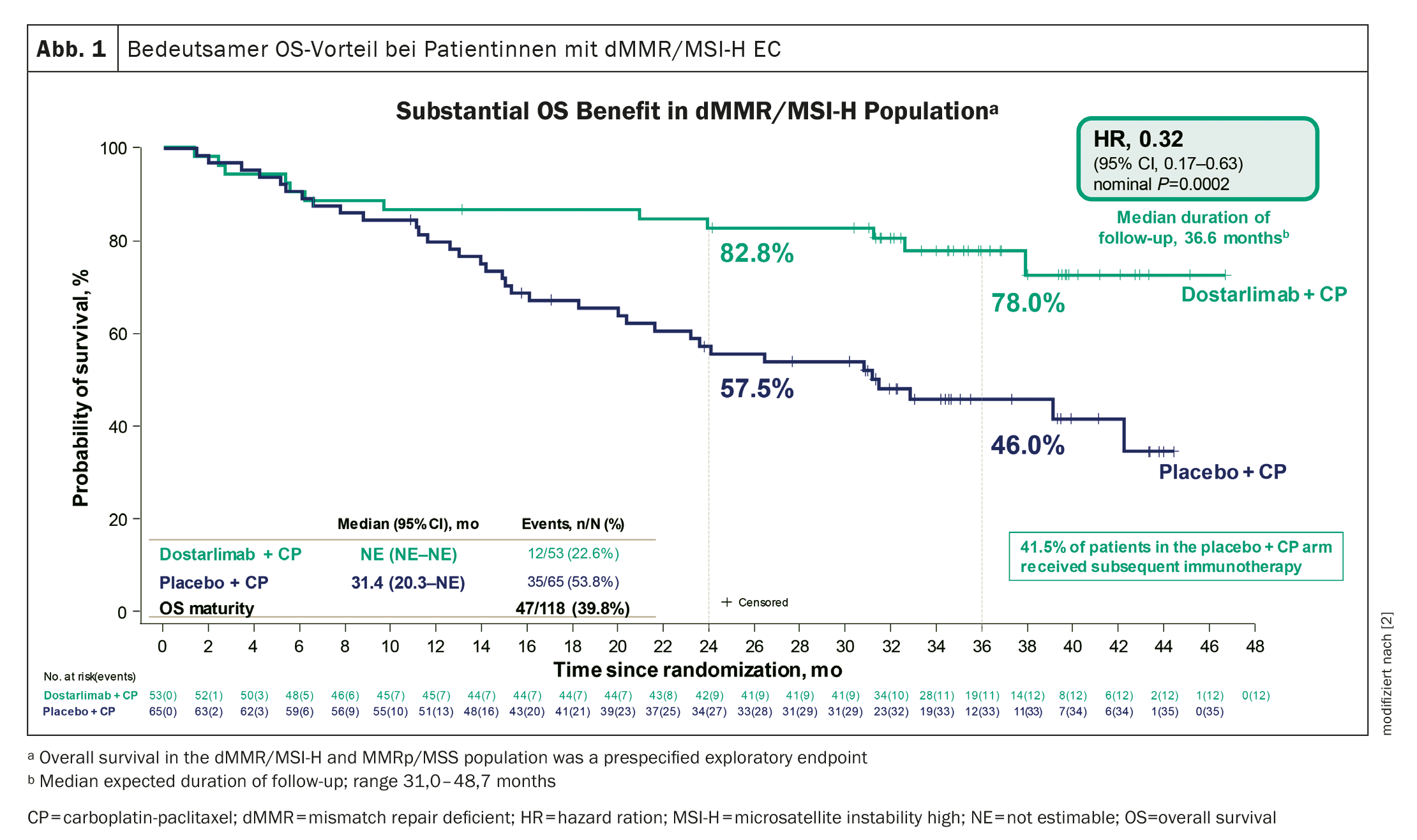
Vantagem significativa na sobrevivência global
A duração mediana do acompanhamento foi de 24,8 meses na população dMMR-MSI-H e de 25,4 meses na população geral.
Na data de corte, 36% da população dMMR-MSI-H no grupo do dostarlimab e 72% no grupo do placebo tinham morrido ou registado progressão da doença.
Na população em geral, 55,1% no grupo do dostarlimab e 71,1% no grupo do placebo tinham morrido ou registado uma progressão da doença.
O tratamento com dostarlimab foi associado a um risco 72% menor de progressão da doença ou morte em doentes com tumores dMMR MSI-H do que o tratamento com placebo.
Na população geral, a PFS aos 24 meses foi de 36,1% no grupo verum e de 18,1% no grupo placebo.
A OS foi também mais longa com o tratamento combinado com o anticorpo monoclonal do que com o placebo num período de seguimento de 25,4 meses, mas os resultados não atingiram o nível de significância que foi definido como regra de paragem. Os resultados mais recentes de uma segunda análise provisória traçam agora um quadro mais preciso.
Foi demonstrado um benefício significativo e sem precedentes da OS em doentes com CE dMMR/MSI-H (Fig. 1) . Além disso, o tratamento com dostarlimab mostrou uma melhoria estatisticamente significativa e clinicamente significativa da OS na população geral e um benefício consistente na maioria dos subgrupos.
Os subgrupos também beneficiam
Enquanto os tumores dMMR-MSI-H são predominantemente endometrióides, os tumores pMMR-MSS são mais heterogéneos e incluem subtipos histológicos de alto risco – incluindo carcinossarcomas. As doentes com carcinossarcomas foram incluídas no estudo. Os tumores que são pMMR-MSS têm geralmente uma carga de mutação tumoral menor, mas a expressão de PD-1 é predominante no cancro do endométrio pMMR-MSS. Também se observou um benefício do regime com dostarlimab** na população pMMR-MSS, embora tenha sido menor do que na população dMMR-MSI-H. O benefício do tratamento foi consistente em termos de sobrevivência livre de progressão e sobrevivência global.
** Atualmente, o Dostarlimab só está autorizado na Suíça em combinação com quimioterapia para a população de doentes com dMMR/MSI-H.
Perfil de segurança conhecido confirmado
O perfil de segurança de dostarlimab-carboplatina-paclitaxel correspondeu ao dos componentes individuais do regime de tratamento. A frequência de acontecimentos adversos graves e sérios foi cerca de 10% mais elevada com a terapêutica com Dostarlimab do que com a terapêutica com placebo. A frequência com que a quimioterapia foi descontinuada foi semelhante em ambos os grupos. A qualidade de vida também foi semelhante em ambos os grupos durante a quimioterapia.
Globalmente, a combinação de dostarlimab, carboplatina e paclitaxel melhorou significativamente os resultados em doentes com cancro do endométrio primário avançado ou recorrente recentemente diagnosticado, com um benefício substancial observado nos tumores MSI-H dMMR – mas também para além disso. Por conseguinte, os dados confirmam que o tratamento combinado é o novo padrão de tratamento para doentes com CE primário avançado ou recorrente, independentemente do estado de reparação da incompatibilidade.
Literatura:
- Mirza MR, Chase DM, Slomovitz BM, et al.: Dostarlimab for Primary Advanced or Recurrent Endometrial Cancer. N Engl J Med. 2023 Jun 8; 388(23): 2145–2158.
- Powell MA, Auranen A, Willmott L, et al.: Overall survival in patients with primary advanced or recurrent endometrial cancer treated with dostarlimab plus chemotherapy in Part 1 of the ENGOT-EN6-NSGO/GOG-3031/RUBY trial. Poster. Annual Meeting on Women’s Cancer (SGO), 16–18.03.2024, San Diego (USA).
- Mirza MR, Sharma S, Herrstedt J, et al.: Dostarlimab + Chemotherapy for the Treatment of Primary Advanced or Recurrent Endometrial Cancer: Analysis of Progression-Free Survival and Overall Survival Outcomes by Molecular Classification in the ENGOT-EN6-NSGO/GOG-3031/RUBY Trial. Poster. European Society of Medical Oncology (ESMO), 20–24.10.2023, Madrid (ES).
InFo ONKOLOGIE HÄMATOLOGIE 2024; 12(3): 26–27