Para pacientes com artrite psoriásica que não respondem adequadamente aos DMARD convencionais ou a um biológico, as recomendações EULAR aconselham a utilização de um inibidor JAK. Recentemente, o upadacitinib, outro membro deste grupo de medicamentos, recebeu uma extensão de indicação para a artrite psoriásica. Esta aprovação é baseada nos estudos SELECT-PsA 1 e 2.
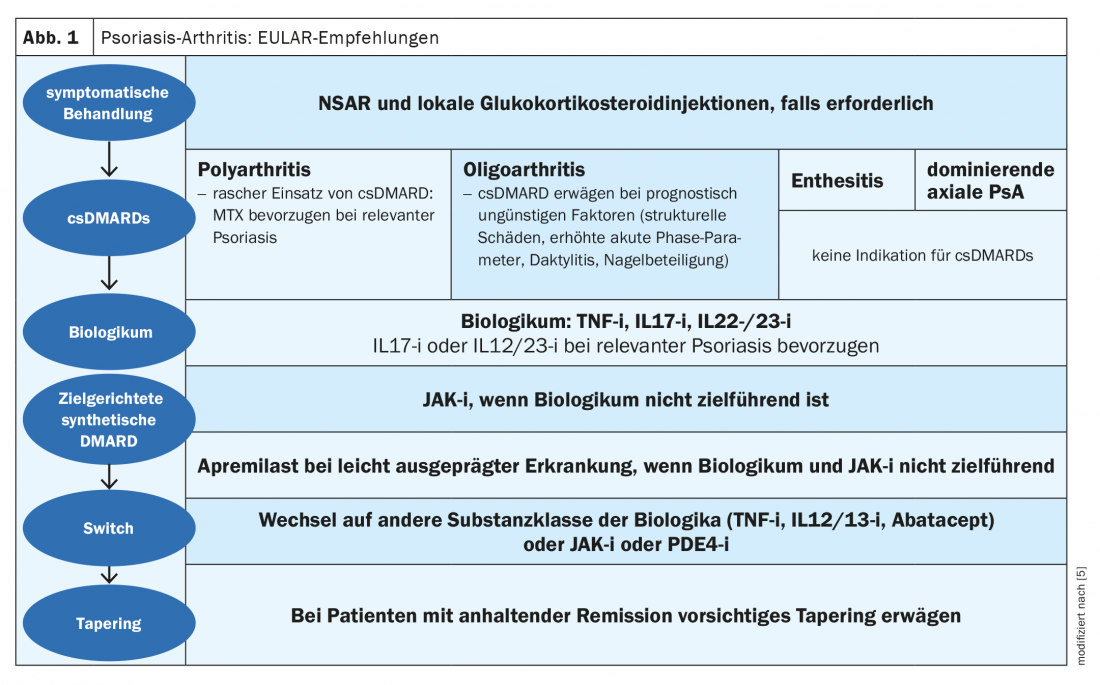
Até 30% dos doentes com psoríase em placas desenvolvem artrite psoriásica (PsoA) durante o curso da doença [1]. A classificação CASPAR (“Critérios de Classificação para Artrite Psoriática”) é utilizada para o diagnóstico. Esta ferramenta de diagnóstico detecta sacroilite, entesite, dactilites e infestação de unhas, entre outras. Se o inibidor JAK upadacitinib (Rinvoq®), aprovado na Suíça desde Janeiro de 2020 para o tratamento da artrite reumatóide, é também eficaz noutras doenças com envolvimento articular, tais como a artrite psoriásica e a espondilite anquilosante, tem sido objecto de vários ensaios clínicos [2]. Upadacitinib é um inibidor oral Janus kinase (JAK1)-selectivo. Nas recomendações EULAR, os inibidores JAK são sugeridos como uma opção terapêutica para o tratamento da artrite psoriásica quando uma primeira biologia falhou (Fig. 1) [5].
SELECT-PsA 1 e 2
Após a apresentação dos resultados do ensaio aleatório, duplo-cego e controlado por placebo fase III SELECT-PsA 2 na EULAR online no ano passado, a publicação dos dados completos por Mease et al. publicado [3,4]. Enquanto o ensaio SELECT-PsA 1 envolveu uma comparação directa com o adalimumab, o ensaio mais pequeno SELECT-PsA 2 investigou o upadacitinib em pacientes adultos com PsoA activo (SJC ≥3 e TJC ≥3) de acordo com os critérios CASPAR e o fracasso ou intolerância de ≥1 bDMARD. No estudo, 642 pacientes (54% mulheres, idade média de 53 anos, duração desde o diagnóstico PsoA 10 anos) foram aleatorizados numa proporção de 2:2:1:1 durante 24 semanas para upadacitinib 15 mg ou 30 mg 1× ao dia. mg ou placebo (estratificado pelo uso de csDMARD, número de bDMARD anteriores e grau de psoríase), depois os doentes com placebo mudaram para upadacitinib 15 mg ou 30 mg. 61% dos participantes tiveram uma resposta inadequada a um bDMARD, 18% a dois e 13% a ≥3, a média SJC66 (“Swollen Joint Count” com 66 juntas) e TJC68 (“Tender Joint Count” com 68 juntas) na linha de base foram 12 e 25, respectivamente.
Alívio dos sintomas articulares e cutâneos
O parâmetro primário foi a resposta ACR20 na semana 12, os parâmetros secundários incluíram a resposta ACR50/70, resposta PASI 75/90/100, realização de actividade mínima de doença (MDA) e resolução de entesite e dactilites. Os melhores resultados de tratamento foram consistentemente alcançados com a dose de 30 mg, que também se mostrou ser superior ao adalimumab no SELECT-PsA 1 (ACR20, HAQ-DI e dor) [3,4]. Na semana 12, um número significativamente maior de pacientes que receberam upadacitinib 15 mg e 30 mg conseguiram uma resposta ACR20 (56,9% e 63,8% vs. 24,1%; cada p<0,0001). Um resultado semelhante foi também observado para a resposta ACR50/70 (31,8% e 37,6% vs. 4,7% e 8,5% e 16,5% vs. 0,9%, respectivamente; cada p<0,05). Ambos os braços upadacitinib também tiveram um desempenho significativamente melhor em todos os outros pontos finais secundários na semana 12, tais como ΔHAQ-DI (-0,30 e -0,41 vs. -0,10), ΔSF-36 PCS (5,2 e 7,1 vs. 1,6) e ΔFACIT-F (5,0 e 6,1 vs. 1,3) (cada p<0,0001). O upadacitinib 15 mg e 30 mg foram também superiores em resposta cutânea na semana 24 (PASI 75/90/100: 53,8% e 62,6% vs. 19,1%; 36,2% e 46,6% vs. 6,9%; 22,3% e 33,6% vs. 4,6%) e redução dos sintomas de entesite (LEI=0: 39% e 48% vs. 20%) e dactilites (LDI=0: 64% e 76% vs. 36%) na semana 12. mg foi significativamente superior numa comparação com placebo. O perfil de segurança do upadacitinib foi o esperado, sendo todos os eventos adversos emergentes do tratamento ligeiramente mais frequentes com a dose de 30 mg do que com o upadacitinib 15 mg ou placebo. As infecções graves ocorreram em 0,5% dos participantes tomando placebo e upadacitinib 15 mg e 2,8% tomando upadacitinib 30 mg, respectivamente, e o herpes zoster desenvolveu-se em 0,9%, 1,4% e 3,7%, respectivamente.

Com base nos resultados dos estudos SELECT-PsA 1 e 2, o upadacitinib recebeu recentemente uma extensão de indicação para a artrite psoriásica na Suíça (caixa) . Globalmente, o upadacitinib é o primeiro e actualmente o único inibidor JAK que pode ser utilizado na artrite reumatóide, bem como na espondilite anquilosante e na artrite psoriásica [2,7]. A fim de minimizar o risco de efeitos secundários, a protecção vacinal dos doentes deve ser actualizada antes de se iniciar a terapia de acordo com as recomendações de vacinação actuais [6]. A utilização de vacinas vivas atenuadas não é recomendada durante ou imediatamente antes de iniciar o tratamento com upadacitinib [6].
Literatura:
- Chicken CK, et al: JDDG 2019; 17(1): 43-66.
- Swissmedic: www.swissmedic.ch (último acesso: 29.03.2021)
- Rheumamanagement-online.de: Psoríase Artrite: www.rheumamanagement-online.de, 01.03.2021, (último acesso: 29.03.2021)
- Mease PJ: artrite psoriásica: Upadacitinib para a artrite psoriásica refratária à biologia: SELECT-PsA 2 Rheum Dis 2020; doi: 10.1136/annrheumdis-2020-218870
- Lunzer R, Nothnagl T: Eular 2020: Breve visão geral – Relevante na prática …! Rheumatismo Plus. 2020 Set 9: 1-3.
- Brochura informativa para médicos, versão 2.0, Janeiro 2021, https://www.bfarm.de, (último acesso 31.03.21)
- Keim J, www.medizinonline.ch/artikel/neue-therapieoption-bei-ankylosierender-spondylitis-und-psoriasis-arthritis-1, (último acesso 31.03.21)
- van der Heijde D, et al: Eficácia e segurança do upadacitinib em doentes com espondilite anquilosante activa (SELECT-AXIS 1): um ensaio multicêntrico, randomizado, duplo-cego, controlado por placebo, fase 2/3. Lancet, 2019. 394(10214): 2108-2117.
- McInnes I, et al: Eficácia e segurança do upadacitinib versus placebo e adalimumab em doentes com artrite psoriásica activa e resposta inadequada a doenças não biológicas modificando os medicamentos anti-reumáticos (SELECT-PsA-1): um ensaio duplo-cego, randomizado e controlado de fase 3 [abstract LB0001]. Ann Rheum Dis 2020. 79(Suppl 1); 16: 2-17.
PRÁTICA DA DERMATOLOGIA 2021; 31(2): 46-47