Com a crescente aplicação clínica das células CAR-T, os aspectos práticos da terapia são uma questão cada vez maior. Que doentes devem receber tratamento com células CAR-T fora dos ensaios clínicos? Qual é a melhor forma de lidar com os efeitos secundários? E como pode a eficácia da terapia ser maximizada? Estas e outras questões foram discutidas por peritos no congresso deste ano da Associação Europeia de Hematologia (EHA).
Dois produtos celulares CAR-T, axicaptagen ciloleucel e tisagenlecleucel, estão actualmente aprovados na Suíça, e três já se encontram no mercado nos EUA. Mais recentemente, a U.S. Food and Drug Administration aprovou lisocaptagen maraleucel em Fevereiro de 2021. E outros produtos estão a ser diligentemente investigados, os ensaios clínicos estão em pleno andamento. Não é de admirar que várias questões sobre a implementação prática das terapias celulares CAR-T estejam a surgir cada vez mais.
Selecção de doentes: Um passeio de corda bamba
As diferentes características do paciente e da doença desempenham um papel importante na selecção de candidatos adequados. A selecção é o primeiro passo crítico para o sucesso da terapia. É importante excluir os doentes com poucas hipóteses de sucesso ou com um risco demasiado elevado de toxicidade. E no entanto, a terapia não deve ser retida a ninguém que dela possa potencialmente beneficiar. No linfoma difuso de grandes células B (DLBCL), por exemplo, há também alguns candidatos entre os doentes não transplantados que são adequados para o tratamento de células CAR-T na terceira linha de terapia – apesar da idade mais avançada e do maior número de comorbilidades neste grupo de doentes. Os dados actuais mostram que os resultados em pacientes com mais de 65 anos são comparáveis aos dos pacientes mais jovens. Para além de um ligeiro aumento da neurotoxicidade, não foram até agora demonstrados efeitos negativos da idade mais elevada dos pacientes.
Ao contrário da idade, o estado de desempenho parece ter um impacto significativo nas hipóteses de sucesso do tratamento com células CAR-T. Os peritos do Congresso da EHA concordaram com isto. Uma vez que o mau desempenho é consistentemente demonstrado como um pré-requisito desfavorável para a terapia, as células CAR-T não devem ser utilizadas em doentes com um estatuto ECOG (Eastern Cooperative Oncology Group) ≥3. Para a maioria dos ensaios clínicos, o pré-requisito é um estatuto ECOG de 0-1. E mesmo no cenário comercial, existem diferentes directrizes em diferentes países.
Existe ainda muita incerteza quanto ao papel das comorbidades na selecção de doentes. Globalmente, contudo, as terapias celulares CAR-T são melhor toleradas do que os transplantes de células estaminais e, portanto, colocam menos exigências às funções dos órgãos do coração, pulmões e rins. Segundo os conhecimentos actuais, as comorbidades desempenham apenas um papel menor no risco de efeitos secundários. Pelo menos as doenças secundárias leves a moderadas não são um problema para uma terapia com células CAR-T e não devem ser avaliadas como um critério de exclusão. Para alguns pacientes que não são adequados para transplante devido às suas comorbidades, as células CAR-T são assim uma nova opção, potencialmente curativa.
Para além das características dos doentes – especialmente a pontuação de desempenho – que devem ser tidas em conta na selecção de candidatos adequados, vários aspectos da doença também desempenham um papel na selecção de doentes para as terapias celulares CAR-T. Em particular, uma actividade proliferativa elevada, um grande volume de tumores, sinais de um ambiente pró-inflamatório do tumor e envolvimento do SNC são considerados factores desfavoráveis. (Caixa). A redução da carga tumoral antes do início da terapia celular CAR-T – a chamada “ponte” – é um tópico importante a este respeito, sobre o qual podemos provavelmente esperar mais algumas notícias no futuro.

Efeitos secundários: Acção ou reacção?
O espectro de efeitos secundários das células CAR-T é caracterizado pela síndrome de libertação de citocinas (CRS), uma reacção inflamatória sistémica, e neurotoxicidade (Tab. 1) [1]. Enquanto o CRS ocorre classicamente nos primeiros dias de tratamento, os danos nos nervos ocorrem normalmente em fases posteriores da terapia. Complicações que têm sido estudadas com menos detalhe até à data incluem a síndrome de lise tumoral e as citopénias. Estes últimos têm sido bastante subestimados até agora, mas têm-se revelado frequentemente problemáticos na prática clínica diária. Dependendo de o produto, o perfil de efeito secundário é um pouco diferente.
Além disso, os pacientes com uma maior carga tumoral têm geralmente um risco acrescido de toxicidade. Os danos nervosos são mais comuns em doentes mais idosos. Conhecendo estes factores de risco, é possível a estratificação do risco e, portanto, a tomada atempada de medidas. Estes consistem, entre outras coisas, na reserva de lugares na unidade de cuidados intensivos e na administração profiláctica de tocilizumabe ou esteróides.
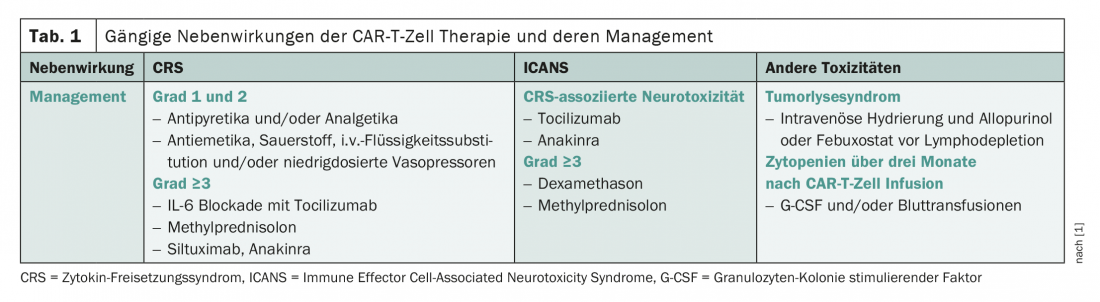
A profilaxia de CRS e neurotoxicidade não é isenta de controvérsia. Por exemplo, alguns estudos mostram que embora os efeitos secundários possam ser atenuados, o efeito no controlo de doenças não é insignificante. Assim, de acordo com Pere Barba do Hospital Vall d’Hebron em Barcelona, cada caso deve ser avaliado individualmente no que diz respeito à utilidade da profilaxia. Por exemplo, aconselha contra a profilaxia de tocilizumab para lisocaptagen maraleucel por causa do baixo risco de CRS. Em geral, as toxicidades estão hoje em dia a ser tratadas de forma cada vez mais agressiva. Enquanto no passado a terapia específica era normalmente realizada apenas a partir de reacções adversas a medicamentos de quase terceiro grau, agora todas as toxicidades de grau 2 – ou seja, de extensão moderada – são tratadas. No CRS, o tocilizumabe em particular é utilizado; na neurotoxicidade, os esteróides assumem o papel mais importante no tratamento. O efeito desta utilização anterior de esteróides na eficácia da terapia com células T de CAR é um tema muito debatido. Além disso, o aumento do risco de infecção não deve ser negligenciado. Nesta tensão, a melhor abordagem, de acordo com Barba, é tratar agressivamente no início, mas parar os esteróides o mais depressa possível. Infelizmente, alguns pacientes experimentam um novo episódio de neurotoxicidade, a chamada “segunda vaga”, durante a retirada.
No futuro, o produto poderá ser modificado para melhorar o tratamento dos efeitos secundários; os estudos correspondentes estão em curso. Se ocorrerem toxicidade graves, as células CAR-T poderiam ser “desligadas” usando anticorpos, por exemplo. Resta saber se esta abordagem pode evitar consequências graves da terapia. Os peritos no Congresso da EHA mostraram-se bastante cépticos a este respeito. O dano já está então muitas vezes definido, a cascata inflamatória desencadeada.
Antes da infusão: Optimizar as condições
Antes que as células CAR-T possam ser infundidas, estão na ordem do dia passos importantes com terapias de transição para reduzir a carga tumoral, a leucaférese e a linfodepleção, que podem ter um impacto significativo no sucesso do tratamento. No que diz respeito à estratégia óptima para o controlo de doenças antes da terapia celular CAR-T, ainda existe actualmente uma grande incerteza; a situação dos dados é insuficiente. Parece claro que a terapia de transição é necessária para a maioria dos pacientes, uma vez que uma elevada carga de doença implica indiscutivelmente um resultado pior e um risco acrescido de toxicidade. Os peritos no congresso da EHA concordaram que a progressão da doença deve ser evitada, se possível, mesmo que isso signifique quimioterapia de alta dose. Num estudo retrospectivo comparando diferentes procedimentos de ponte em relação à sobrevivência global e sem progressão de pacientes com DLBCL, a radioterapia foi a que melhor se realizou [2]. No entanto, esta análise incluía apenas uma centena de pacientes e era de natureza retrospectiva.
Para assegurar a propagação, manutenção e função mais eficiente das células CAR-T, as células imunitárias citotóxicas endógenas e as células imunossupressoras são eliminadas na chamada “linfodepleção”. Entre outras coisas, são libertadas citocinas endógenas que promovem a proliferação das células T. Nos ensaios, é normalmente utilizada uma combinação de fludarabina e ciclofosfamida, que é administrada durante três dias. Em alternativa, existe a opção de utilizar bendamustina. Um ponto de discussão é a questão de saber se a quimioterapia linfodepletiva também deve ser administrada aos pacientes que – por exemplo, após o transplante de células estaminais – já têm linfopenia. Isto deve tornar-se mais claro com a crescente utilização de células CAR-T, bem como a questão de saber se são possíveis melhores regimes para a linfodepleção.
O tempo é o factor decisivo na obtenção das células T do próprio paciente por leucaférese. Em particular, a recolha deve ter lugar a uma distância suficiente para a quimioterapia de transição. Isto é da maior importância para a qualidade do produto. Como regra geral: intervalo de duas semanas da quimioterapia, intervalo de três dias a uma semana da administração de esteróides. No entanto, não só o timing da fase de pré-tratamento é de grande importância para o sucesso da terapia celular CAR-T, mas também a sua duração global. Actualmente, demora cerca de dois meses desde o contacto inicial até à infusão das células CAR-T – demasiado tempo, considerando que a doença progride durante este tempo. Por exemplo, um estudo recentemente publicado mostra que dos 108 pacientes que inicialmente eram adequados para a terapia com células T de CAR, apenas 52 acabaram por receber o produto [3]. Embora haja uma tendência notória para encurtar o tempo de espera, ainda há espaço para melhorias. A procura crescente exige cada vez mais infra-estruturas e condutas, que primeiro têm de ser construídas em muitos locais. Estes requisitos só podem ser satisfeitos através de uma cooperação eficiente entre clínicas, centros e indústria.
Fonte: Sessão de peritos/ mesa redonda “Como melhor ajudar os doentes a ter sucesso com as terapias celulares CAR T?” no Congresso da EHA praticamente realizado, 11.06.2021, Claire Roddie, Londres, Reino Unido e Pere Barba, Barcelona, Espanha.
Literatura:
- Yáñez L, Sánchez-Escamilla M, Perales MA: Toxicidade celular CAR T: Gestão actual e direcções futuras. Hemasfera. 2019; 3(2): e186.
- Pinnix CC, et al: Terapia de ponte antes do axicabtagene ciloleucel para linfoma de grandes células B recidivante/refractário. Blood Adv. 2020; 4(13): 2871-2883.
- Carpio C, et al.: Processo de selecção e causas de não elegibilidade para a terapia celular CD19 CAR-T em doentes com linfoma não-Hodgkin de células B recidivante/refractário agressivo num centro europeu. Linfoma de Leuk. 2021: 1-4.
InFo ONCOLOGY & HEMATOLOGY 2021; 9(4): 26-27 (publicado 20.9.21, antes da impressão).