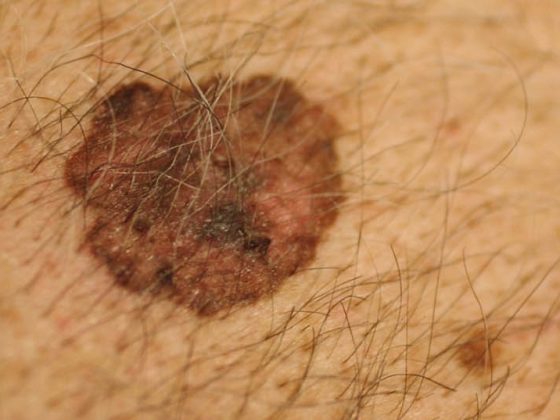
A incidência de cancro da pele branca é três a cinco vezes maior nas pessoas infectadas pelo VIH. Os carcinomas de células escamosas e células basais ocorrem numa idade mais jovem em pessoas infectadas pelo VIH, levam mais frequentemente a recorrências e mais frequentemente à morte. O melanoma também tem uma incidência ligeiramente maior em pessoas infectadas pelo VIH. Além disso, o prognóstico é significativamente pior do que o da população normal. Enquanto o sarcoma de Kaposi, linfoma não-Hodgkin e carcinoma cervical são significativamente menos comuns no HAART, a incidência da maioria dos cancros não-definidores de SIDA aumentou. Para além do cancro do fígado, o linfoma de Hodgkin e o carcinoma anal em particular mostram um forte aumento sob HAART. O cancro da pele branca e o melanoma também apresentam um aumento – embora mais fraco -. Uma razão pela qual muitos tumores aumentam em vez de diminuírem ao longo da HAART poderia ser que os doentes com VIH são frequentemente diagnosticados jovens, vivem mais tempo na HAART e “crescem” no grupo de maior risco de tumores.
Sabe-se há muito tempo que os doentes imunossuprimidos, especialmente os doentes transplantados de órgãos, desenvolvem cancro de pele significativamente mais frequentemente do que os doentes imunocompetentes. Assim, nesta população, o espinalioma é 65 vezes mais comum, o carcinoma das células basais dez vezes mais comum e o melanoma três vezes mais comum. O risco de cancro da pele é também aumentado nas pessoas infectadas pelo VIH, embora não na mesma medida.
É interessante ver como a frequência dos diferentes tipos de cancro mudou com a HAART (“terapia anti-retroviral altamente activa”). Desde a introdução do HAART, os doentes seropositivos têm um prognóstico de sobrevivência significativamente melhor do que antes. Do mesmo modo, as doenças que definem a SIDA diminuíram maciçamente, de modo que as vemos com muito menos frequência na prática diária. As doenças que definem a SIDA também incluem tumores malignos (“cancros que definem a SIDA”, ADC). Estes incluem o sarcoma de Kaposi, carcinoma cervical e linfoma não-Hodgkin (Quadro 1).

No entanto, foi descrita toda uma série de outros tumores que ocorrem mais frequentemente em pessoas infectadas pelo VIH, os chamados cancros não-definidores da SIDA (NADC) (Tab. 2) . Isto inclui também o cancro de pele não-melanoma (NMSC). Entende-se por carcinoma espinocelular da pele (espinalioma, carcinoma do fuso celular) e carcinoma basocelular (basalioma). A doença de Bowen (epiderme inteira) e as queratoses actínicas (camada de células basais apenas) são chamadas de carcinoma in situ. Outros tumores malignos cutâneos são o muito raro carcinoma e melanoma de células Merkel.

Este relatório concentra-se na incidência e na mudança dos cancros que definiram e não definiram a SIDA, antes e depois da era HAART.
Fatos
Globalmente, os tumores diminuíram significativamente no âmbito da terapia HAART, mas em média ainda existe um risco 1,5 a 2 vezes maior em comparação com a população normal.Num estudo francês, os seguintes tipos de cancro foram diagnosticados em pessoas infectadas com VIH em frequência decrescente: Linfoma não-Hodgkin 21,5%, sarcoma de Kaposi 16,0%, cancro do pulmão 9,4%, cancro anal 8,2%, linfoma de Hodgkin 7,6%, NMSC 6,8% e cancro do fígado 5,6%. Os cancros que não são de definição de SIDA representam um total de 68% de todos os tumores.
Cancro da pele branca (NMSC)
A incidência de CNSN é três a cinco vezes maior em pessoas infectadas com VIH. A relação entre células basais e o carcinoma espinocelular é de 1:7. Isto está em contraste acentuado com os pacientes de transplante renal, onde a proporção é invertida a 1,8:1. Os factores de risco para o desenvolvimento do NMSC são os mesmos que na população normal, em primeiro lugar e acima de tudo a exposição UV. A medida em que os papilomavírus humanos (HPV) contribuem para o desenvolvimento do carcinoma espinocelular em pessoas infectadas pelo VIH não é clara. Os CNSN ocorrem claramente numa idade mais jovem em pessoas infectadas com VIH, são mais propensos à recorrência e levam mais frequentemente à morte. A consequência disto deve ser um tratamento agressivo das lesões pré-cancerosas neste colectivo.
Melanoma
O melanoma tem uma incidência ligeiramente maior em pessoas infectadas pelo VIH. Dependendo da fonte, a taxa de incidência normalizada (SIR) situa-se entre 1,1 e 2,6. Discute-se se esta incidência ligeiramente maior pode estar relacionada com um aumento da vigilância dos pacientes em relação às lesões cutâneas ou com um controlo médico mais intensivo destes pacientes. No entanto, pode-se afirmar que as pessoas infectadas com melanoma com VIH têm um prognóstico significativamente pior do que os doentes com melanoma na população normal. Quanto menor for a contagem de células CD4, pior será o prognóstico. Contudo, a profundidade de penetração Breslow, o marcador de prognóstico mais importante, é independente da contagem de células CD4.
O sarcoma de Kaposi
O sarcoma de Kaposi é um dos tumores definidores da SIDA. Trata-se de uma proliferação vascular. Antes da era HAART, o sarcoma de Kaposi resultava geralmente em morte, com uma sobrevivência média de 18 meses, uma vez que o sarcoma de Kaposi associado ao VIH é uma variante agressiva. Sob HAART, a incidência poderia ser maciçamente reduzida (Tab. 1) . O sarcoma de Kaposi pode afectar não só a pele mas também os órgãos internos. O vírus do herpes humano 8 (HHV8) é responsável. A terapia consiste principalmente na reconstituição imunitária.
Carcinoma anal
O carcinoma anal está associado ao HPV. A incidência é aumentada especialmente em homens homossexuais. Os factores de risco são uma contagem baixa de células CD4, infecção com tipos de HPV de alto risco (HPV-16, -18, -31 e -33) e infecção com múltiplos tipos de HPV. A patogénese é comparável à patogénese do carcinoma cervical. As pessoas infectadas pelo VIH, independentemente das práticas sexuais, mostram um aumento de duas a seis vezes na colonização por HPV na área do ânus, em comparação com as pessoas seronegativas. Homens homossexuais com HIV têm HPV na área anal em 93% dos casos, em comparação com 61% de homens homossexuais não infectados pelo HIV.
Linfomas cutâneos
Os linfomas cutâneos desempenham um papel menor devido à sua raridade, mas devem ser aqui mencionados por uma questão de completude. Os tipos possíveis incluem linfoma cutâneo de células T de grandes dimensões CD30+, micose fungóide e síndrome de Sézary, bem como formas cutâneas do linfoma de Hodgkin.
ADC e NADC no curso sob HAART
O HAART foi introduzido em 1996 e teve um grande impacto no desenvolvimento dos vários tumores malignos em pessoas infectadas com o VIH. Por exemplo, o sarcoma de Kaposi e o linfoma não-Hodgkin ocorrem de forma maciça e o carcinoma cervical ocorre com menos frequência sob HAART. No estudo Swiss HIV Cohort Study, que tem vindo a recolher dados prospectivos sobre pessoas infectadas pelo VIH há mais de 20 anos, o SIR para todos os cancros definidores da SIDA desceu de 136 para 14,7.
Em contraste, o SIR para a maioria dos cancros que não são de definição de SIDA aumentou. Para além do cancro do fígado, o linfoma de Hodgkin e o carcinoma anal em particular mostram um forte aumento sob HAART. O cancro da pele branca também aumentou, com um SIR antes do HAART de 1,7 e sob HAART de 3,3. O melanoma mostra um aumento mais fraco, de 1,2 para 2,0. No entanto, alguns cancros não-definidores da SIDA também sofreram uma diminuição sob HAART, como o mieloma múltiplo (de 14,8 para 5,1) ou tumores na cabeça e pescoço (de 4,3 para 2,2) (Tabela 2).
É interessante comparar a frequência dos tumores associados ao HPV entre os receptores de transplante de órgãos e as pessoas infectadas pelo VIH. No campo dos tumores de pele, há um claro aumento do CCNM entre os receptores de transplante de órgãos com um SIR de 28. Entre as pessoas infectadas pelo HIV, há apenas um SIR de 4 Os melanomas mostram uma relação semelhante, a sua incidência dificilmente aumenta em pessoas infectadas pelo VIH, mas duplicou para triplicar em doentes com transplante de órgãos. No caso do carcinoma anal, os rácios são invertidos: aqui, as pessoas infectadas pelo VIH apresentam um SIR de 28, enquanto os doentes com transplante de órgãos apresentam um SIR de 5 Além disso, não estão incluídos outros tumores induzidos por vírus devido a infecções com HHVH8, vírus Epstein-Barr (EBV) ou vírus da hepatite B ou hepatite B (EBV). C, mais frequentemente em pessoas infectadas com VIH do que em receptores de transplantes de órgãos.
Discussão
A razão exacta do aumento parcial do risco de cancro em pessoas infectadas pelo VIH acaba por não ser clara. É sabido que as linfopénias CD4 geralmente aumentam o risco de cancro. Sob HAART, os pacientes vivem significativamente mais tempo, mesmo com baixas contagens de células CD4. Neste contexto, é interessante notar que a duração da doença VIH – mas não a sua gravidade – aumenta o risco de cancro. Há também disfunção celular CD4 e CD8, o que leva a uma diminuição da vigilância imunológica dos tumores. Os vírus oncogénicos tais como HHV8, HPV, EBV ou o vírus linfotrópico de células T humanas (HTLV1/2) podem proliferar mais facilmente. Além disso, a infecção pelo VIH leva a uma predominância de citocinas Th2. Isto tem uma influência consecutiva na angiogénese, apoptose, apresentação de antigénios, evasão imunitária e transcrição de vários oncogenes.
Além disso, certas proteínas do VIH desempenham um papel no desenvolvimento de alguns tumores malignos. Assim, o VIH pode ter efeitos directos a nível celular ou mesmo a nível genético. O VIH pode activar protooncogenes, interferir com o ciclo celular, inactivar genes supressores de tumores (por exemplo, p53) e contribuir para a estabilização ou alteração dos genes.
Porque é que muitos tumores aumentam e não diminuem sob HAART?
Curiosamente, o NADC só está a aumentar entre os caucasianos, não entre os africanos negros ou outros grupos étnicos. No entanto, pode haver aqui um preconceito, uma vez que a qualidade dos relatórios sobre o cancro pode ser diferente. Deve também notar-se que este aumento só é observado entre os homens infectados pelo VIH, não entre as mulheres infectadas pelo VIH. O maior factor de risco, como na população normal, é a idade. O facto de a maioria dos doentes infectados com VIH serem jovens, de viverem significativamente mais tempo com HAART e assim “crescerem” num grupo de maior risco, torna compreensível que certos cancros, que ocorrem principalmente na velhice, aumentem durante o curso da HAART, ou apesar da HAART. Especialmente no caso do NMSC como o espinalioma, este é provavelmente o factor decisivo, devido à crescente dose cumulativa de UV a uma idade mais avançada. Não foi encontrada qualquer correlação entre factores histologicamente desfavoráveis (nem no carcinoma basocelular nem no espinalioma) e a contagem de células CD4, viremia do VIH, duração HAART, duração da doença do VIH ou nadir CD4.
Especula-se também que as pessoas infectadas pelo VIH têm uma maior tolerância ao risco e possivelmente também um estilo de vida diferente (mais pouco saudável). A medida em que a actual terapia tem uma influência negativa ainda não foi conclusivamente esclarecida. Alguns medicamentos contra o VIH são pelo menos fotossensibilizantes.
Perspectivas
Foram propostos programas de rastreio para alguns ADC e NADC (carcinoma anal, carcinoma cervical, cancro da mama, carcinoma colorrectal, carcinoma hepático e carcinoma da próstata). Até à data, não há recomendação para o rastreio do tumor de pele. Embora os tumores de pele não sejam tão comuns em indivíduos infectados com VIH, ocorrem numa idade mais jovem, o que justificaria um programa de rastreio por analogia com os receptores de transplante de órgãos.
Literatura:
- Franceschi S, et al: Br J Canc 2010; 103: 416-422.
Leitura adicional:
- Wilkins K, et al: J Am Acad Dermatol 2006; 54: 189-206.
- Deeken JF, et al: CID 2012; 55(9): 1228-1235.
- Grulich AE, et al: Lancet 2007; 370: 59-67.
- Silverberg MJ, et al: J Natl Cancer Inst 2013; 105: 350-360.
- Guiguet M, et al: Lancet Oncol 2009; 10: 1152-1159.
- Lanoy E, et al: Int J Cancer 2011; 129: 467-475.
- Schulz TF: Int J Cancer 2009; 125(8): 1755-1763.
- Garlassi E, et al: J Acquir Immune Defic Syndr 2012; 60(2): e63-65.
- Hofbauer GFL, et al: Swiss Med Wkly 2009; 139(29-30): 407-415.
InFo ONCOLOGy & HaEMATOLOGy 2015; 3(11-12): 25-27
PRÁTICA DE DERMATOLOGIA 2016; 26(5): 12-14