A prevalência da actual queratose actínica (AK) na população aumenta com a idade. Dependendo da exposição aos raios UV, o desenvolvimento de AK é relevante a partir dos 40 anos de idade. Na Austrália, até 60% deste grupo etário é afectado; nas latitudes europeias, 15-30% podem ser assumidos. É de esperar um número de 70% de pacientes afectados por AK nos seus 70 anos de idade, desde uma única AK até ao cancro de campo.
A prevalência, como a taxa de pessoas actualmente doentes na população, aumenta com a idade. Dependendo da exposição UV, o desenvolvimento de queratoses actínicas (AK) é relevante a partir dos 40 anos de idade. Na Austrália, até 60% deste grupo etário é afectado, na Europa estima-se que seja de 15-30% [1]. É de esperar um número de 70% de pacientes afectados por AK nos seus 70 anos de idade, desde uma única AK até ao cancro de campo.
A incidência, como medida de novos casos num ano, é dada pelo Instituto Robert Koch como 229.750 novos casos para 2016. A incidência da doença em 2844 pacientes consecutivos vistos na clínica geral suíça foi de 25% [2]. AK é assim um dos diagnósticos mais frequentes em dermatologia e liga pacientes e médicos a uma parceria de tratamento. Neste contexto, são necessárias a educação, a prevenção, terapias orientadas.
Patogénese
A causa básica é o dano induzido pelos raios UV nos queratinócitos da epiderme. Constitucionalmente, os tipos de pele I e II favorecem o desenvolvimento de AK. Outras predisposições adquiridas são as queimaduras solares na infância e a exposição cumulativa aos raios UV. Possíveis danos moleculares relacionados com UV são explicados numa revisão recente [1].
Até agora, as mutações p53 e mutações do ras oncogene foram identificadas como causas genéticas. p53 está activa no controlo do ciclo celular. As mutações da p53 previnem uma apoptose necessária. O envolvimento da p53 na génese da AK é assumido em até 80% dos casos. A imunossupressão, induzida ou não por drogas, também contribui para um maior desenvolvimento da AK.
Num estudo recente utilizando sequenciação da próxima geração, os papilomavírus beta-humanos (HPV), que anteriormente foram destacados como proeminentes, não demonstraram ser significativamente importantes em AK em comparação com pele normal, mas os tipos gama1-HPV4 foram significativamente enriquecidos em AK. As declarações sobre a persistência de vírus, variações mesmo de novos tipos de HPV, etc., dependendo da localização, continuam a ser insuficientes.
A toma de hidroclorotiazida mostrou aumentar o risco de carcinoma basocelular (BCC) 1,2 vezes e o risco de carcinoma espinocelular (PEC) 4 vezes. Um estudo de caso-controlo de 400 pacientes com doença cardiovascular não mostrou qualquer correlação de AK com diuréticos tiazídicos [3].
Classificações
A classificação clínica geralmente utilizada de acordo com Olsen existe desde 1991. É utilizado em estudos e também na linha de orientação.
- Olsen grau I: suave – AK pouco visível e pouco palpável,
- Olsen grau II: moderado – AK bem visível e palpável,
- Olsen grau III: severo – claramente visível e severamente hiperqueratósico AK [4].
A classificação clínico-histológica e histológica de Cockerell et al. também vale a pena conhecer. 2000 e por Röwert-Huber et al. 2007 [5,6].
Contudo, a falta de uma classificação aplicável reflecte-se em variações específicas do país, tais como a classificação AK da Associação Britânica de Dermatologistas:
- AK grau 1 suave – mancha de escalada mínima,
- Grau 2 moderado – mancha escamosa moderada,
- Grau 3 grave – lesão hiperqueratósica.
É essencial compreender que os achados clínicos e a histologia correspondente não estão necessariamente correlacionados, ou seja, um achado clínico crescente não tem de corresponder a um potencial maligno crescente, por exemplo, em termos de invasividade. E há outro ponto importante sobre a clínica e histologia: no caso de cancro de campo, a biopsia de uma AK incluída não deve ser considerada representativa da área circundante. Por conseguinte, o trabalho actual está cada vez mais voltado para um trabalho histológico de possíveis critérios prognósticos relevantes. Trabalho de Dirschka et al. sobre o padrão de crescimento de queratinócitos atípicos confirmam um potencial invasivo mesmo de AK inicial (grau I de acordo com Olsen) [9].
O que é que isto significa para o médico assistente? A avaliação clínica primária permanece actualmente a mesma. As biópsias devem ser realizadas com urgência se uma lesão não for clara ou progredir rapidamente. Neste momento, há uma indicação de terapia precoce e amplamente aplicada para todas as AK. Só uma melhor avaliação e prognóstico cientificamente fundamentado pode permitir uma intervenção terapêutica mais direccionada. Na AK existente, o objectivo principal é evitar a progressão para o PEK invasivo.
Prevenção
A prevenção primária tem como objectivo impedir o desenvolvimento de AK. No comportamento individual, isto significa evitar riscos pessoais. Mas as mudanças no ambiente, que podem estar envolvidas no desenvolvimento da doença, também precisam de ser abordadas. Acções relacionadas incluem, por exemplo, a protecção solar em jardins de infância ou a proibição da utilização de um solário para menores de 18 anos (em 01.06.19 entrou em vigor o SR 814.711 “Portaria para a Lei Federal de Protecção contra os Riscos das Radiações Não-Ionizantes e do Som”).
A prevenção secundária centra-se no diagnóstico precoce de AK. O aconselhamento ao doente e as terapias rápidas destinam-se a curar ou mitigar o curso da doença. Uma possibilidade é a realização de exames de rastreio. Na Suíça, o rastreio bienal gratuito do cancro da pele é oferecido aos segurados a partir dos 35 anos de idade. Mesmo que AK não sejam um componente definido do rastreio do cancro da pele, são encontradas altas taxas de sucesso, especialmente em subpopulações mais antigas.
No que diz respeito ao possível desenvolvimento do PEK, a prevenção terciária deve ser mencionada como um pilar de diagnóstico e terapia para evitar danos consequentes. Em múltiplas AK, o risco de desenvolvimento de carcinoma espinocelular (PEK) durante toda a vida é avaliado em 6-10% durante um período de 10 anos.
No que diz respeito à patogénese, uma protecção solar precoce e consistente deve ser colocada antes de tudo o resto. A protecção solar têxtil (protectores de cabeça, óculos, vestuário) e a utilização adequada de preparações de protecção UV, que devem incluir protecção UVA e UVB, são necessárias. O vestuário Denser pode fornecer um Factor de Protecção UV de 50, o que significa que <1/50 da radiação UV passa, 2% no máximo. Para a correcta aplicação de agentes protectores dos UV, deve chamar-se a atenção para uma aplicação atempada e suficientemente espessa, uniforme e repetida. O tempo de permanência permitido, relacionado com o tipo de pele, não é, portanto, extensível.
Embora a aceitação da protecção solar aumente com a idade e especialmente após a detecção dos primeiros danos causados pelos raios UV, esta pode ser melhorada em geral e especialmente entre os jovens. As campanhas regulares de protecção solar são iniciadas na Suíça pela Liga do Cancro. Brochuras e pequenos vídeos fornecem informações sobre os perigos da sobre-exposição ao sol e recomendações de protecção solar. Além disso, a Campanha Nacional do Cancro da Pele, organizada pela Sociedade Suíça de Dermatologia e Venereologia (SGDV), tem tido lugar anualmente desde 2006. Entre outras coisas, promove a sensibilização da população para uma protecção solar consistente, bem como exames de detecção precoce.
Se houver um risco elevado de cancro da pele, por exemplo, em pacientes transplantados, o nível de vitamina D deve ser determinado e, se necessário, deve ser realizado um novo teste de vitamina D. ser substituído. A produção suficiente de vitamina D ocorre com uma exposição solar diária moderada de cerca de 20-25% do corpo (por exemplo, rosto, mãos e braços) durante pelo menos 5 minutos cerca de 2-3×/semana [7].
A prevenção com outros agentes tais como selénio, vitamina A e beta-caroteno não são recomendados como medidas para a prevenção do cancro da pele. A nicotinamida pode ser utilizada para prevenção, especialmente no que diz respeito ao BCC e PEK, em doentes com cancro de pele não melanoma (NMSC) e doentes com transplante de órgãos. Os estudos sobre a cafeína, como factor de protecção, e a nicotina e o álcool como factores negativos não são convincentes.
Clínica
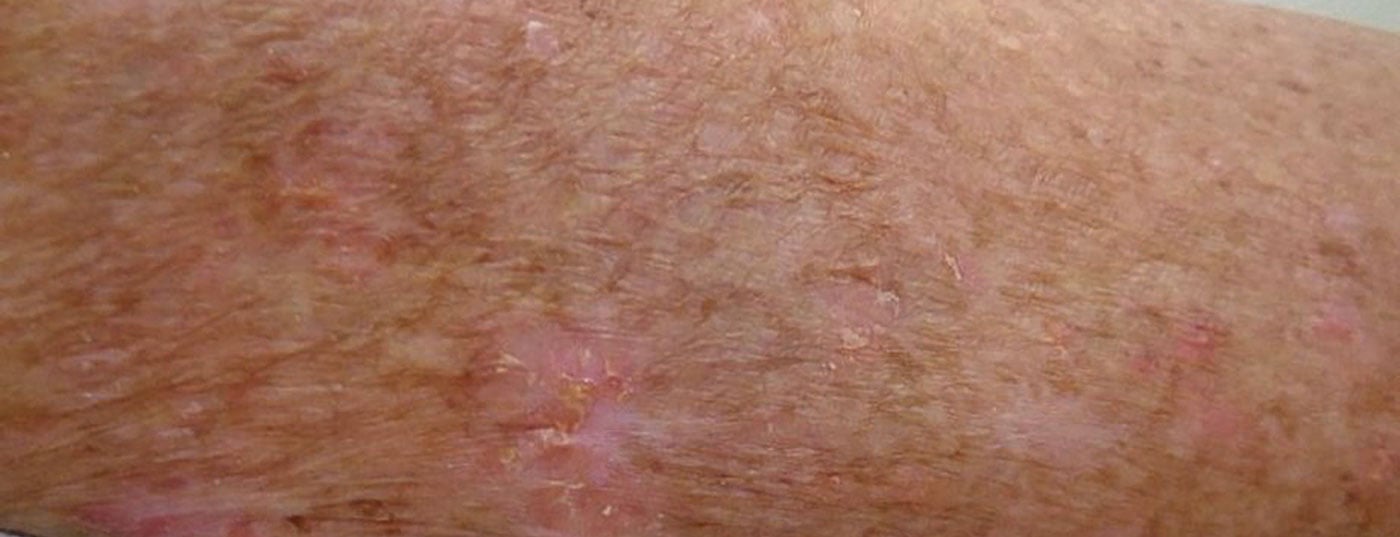
O espectro das lesões varia desde uma pequena mácula vermelha, uma queratose sésseis baixa a claramente sobreposta, lesões pigmentadas, crustosas ou atróficas até à carcinomatização de campo (Fig. 1) . Esta caracteriza-se por múltiplas AK rodeadas por danos visíveis na pele relacionados com os raios UV, incluindo uma pele manchada de cor castanha-avermelhada e proporcionalmente atrofiada. No entanto, não existe uma definição uniforme de cancerização de campo.
AK ocorre principalmente em áreas de pele expostas aos raios UV, tais como o topo sem pêlos da cabeça, a testa, a bochecha, o nariz ou as orelhas (“terraços de sol”). Mas AK também pode ser encontrada no decote, no pescoço e nas extremidades.
Diagnósticos
AK é principalmente diagnosticado clinicamente através de exame visual e palpatório. As características podem ser detectadas por meio de dermoscopia. Os pontos brancos dispostos num padrão de folhas de trevo perifolicularmente são descritos como “marcas de roseta”. Típico da AK não pigmentada é o padrão “morango”, caracterizado por aberturas foliculares com tampas queratóticas rodeadas por um pseudonetwork avermelhado. Na AK pigmentada, aparece um pseudônimo castanho a cinzento, que é composto por múltiplos pontos ou glóbulos castanhos a cinzentos dispostos em torno das aberturas foliculares. A progressão para uma PEK pode ser visível através de queratoses grosseiras e das mais pequenas inclusões de crostas.
A microscopia de varrimento laser confocal é uma técnica não invasiva de diagnóstico por imagem que utiliza uma fonte de luz monocromática pontual para avaliar microscopicamente as camadas superiores da pele com uma profundidade de penetração de aproximadamente 300 µm. AK caracteriza-se por uma perda da estrutura normal dos favos com atipias e pleomorfismo de queratinócitos epidérmicos, paraqueratose e dilatações dos vasos sanguíneos. A hiperqueratose compacta sobreposta pode, em alguns casos, complicar significativamente a análise das estruturas mais profundas, o que pode limitar o diagnóstico de carcinoma espinocelular invasivo.
Outro método de imagem é a tomografia de coerência óptica, que funciona com raios electromagnéticos na faixa de infravermelhos próximos (700-1300 nm). Aqui, imagens da secção de profundidade com uma profundidade de penetração de aprox. 1,5-2,6 mm e imagens horizontais são criadas ao mesmo tempo. AK mostram acantose com zona de junção bem preservada. Nos carcinomas invasivos de células escamosas, a estratificação regular da epiderme é abolida e a zona juncional já não pode ser claramente demarcada. Uma hiperqueratose grave pode também levar a limitações de diagnóstico. As primeiras tentativas de consulta virtual sobre AK foram publicadas. Após aconselhamento crítico e instrução do paciente sobre AK, uma visão geral regular e imagens de grande plano são uma base para possíveis cuidados [8].
Terapia
A indicação para a terapia de AK deve ser feita em sinopse do quadro clínico, factores de risco, comorbilidades, esperança de vida e desejos do paciente, bem como a sua conformidade. A pontuação AKASI pode ser utilizada para classificar a gravidade clínica e objectivar o sucesso terapêutico da AK na cabeça [9].
A actual “S3 Guideline Actinic Keratosis and Squamous Cell Carcinoma of the Skin” fornece uma visão geral das opções de tratamento aprovadas, indicações e parâmetros de aplicação [10]. Dois grandes blocos devem ser considerados: procedimentos não invasivos e procedimentos invasivos / mecânicos-destrutivos. No que diz respeito aos pacientes transplantados imunossuprimidos e aos doentes profissionais, existem critérios de tratamento modificados que não são apresentados mais aqui [10].
Procedimentos não invasivos
Procedimentos de assistência a medicamentos tópicos
Para consideração individual, os possíveis critérios de decisão e recomendações da directriz são resumidamente delineados abaixo. Relativamente aos mecanismos de acção e efeitos secundários, gostaríamos de consultar a literatura actual disponível em linha (Tab. 1) [11].
3% de diclofenaco em ácido 2,5% hialurónico pode ser utilizado em áreas maiores de todo o corpo. A vantagem desta opção de tratamento é um baixo espectro de efeitos secundários. É possível uma aplicação 2× ao dia durante 60-90 dias até uma quantidade máxima de 8g por dia. De acordo com a directriz, 3% de diclofenaco em ácido 2,5% hialurónico deve ser oferecido para uma ou várias AK de Olsen grau I-II em doentes imunocompetentes ou cancro de campo [10]. A taxa de resposta situa-se entre 25% e 89%, dependendo em grande parte dos resultados clínicos. Esta opção de tratamento tem sido frequentemente utilizada durante anos, pelo que outras opções precisam de ser consideradas.
O creme 5-Fluorouracil 5% deve ser oferecido para o tratamento de uma e múltiplas AK de grau I-II de acordo com a directriz de Olsen. A terapia orientada para o campo com 5-fluorouracil 5% de creme pode ser utilizada para o cancro de campo [10]. 5% 5-FU aplicados 2× diariamente durante 2-4 semanas podem causar efeitos secundários tais como vermelhidão, comichão, ardor, erosão, ulceração e sarna. Reacções locais mais fortes são mais susceptíveis de serem encontradas em pele atrofiada de idosos ou quando se tomam anticoagulantes. Estudos têm demonstrado uma taxa de resposta muito boa e um sucesso a longo prazo, também no que diz respeito às recorrências [12]. As taxas de resposta mostram uma ampla gama e situam-se entre 38% e 96%.
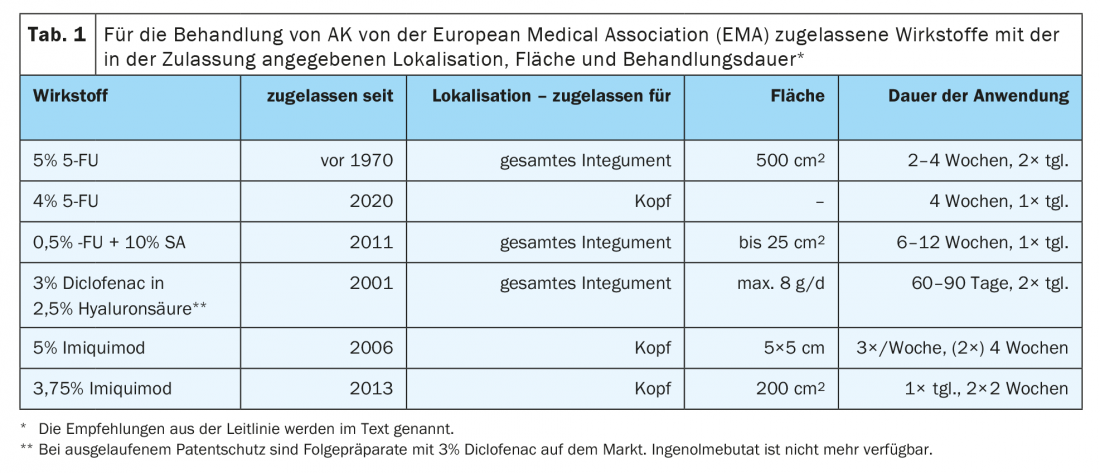
4% 5-FU é também aprovado para a área da cabeça e é utilizado para AK grau I-II. Com uma eficácia comparável a 5% 5-FU, é utilizado apenas 1× diariamente e promete efeitos secundários menos pronunciados, levando a uma melhor aderência do paciente à terapia [13]. 0,5% 5-FU com 10% SA foi aprovado principalmente para a terapia dirigida às lesões de AK. No estudo pós-admissão, AK grau I e II mostrou uma cura completa de 75% das lesões e uma cura completa em 50% dos casos após 8 semanas, em comparação com o tratamento com placebo nas terapias orientadas para o campo. A duração do tratamento é normalmente de 6-12 semanas. 0,5% FU com 10% SA é para ser aplicado diariamente com um pincel. Forma um filme pouco visível e é bem tolerado.
O Imiquimod está aprovado para utilização na área da cabeça. 3,75% Imiquimod mostra aqui uma resposta fiável e a longo prazo, especialmente no caso de uma reacção claramente inflamatória. Os efeitos secundários típicos são prurido, dor local e crosta. Portanto, foram estabelecidos intervalos terapêuticos mais curtos com um ritmo “2 ligado – 2 desligado – 2 ligado”. Isto significa uma aplicação 1× diariamente durante 2 semanas e após um intervalo de 2 semanas outra aplicação durante 2 semanas. Isto leva a uma boa aderência terapêutica nos pacientes quando usado de uma forma adaptada ao efeito secundário. De acordo com a directriz, o creme Imiquimod 3,75% deve ser oferecido em campo para a AK de grau múltiplo I-II de acordo com Olsen e para a cancerização de campo em indivíduos imunocompetentes no rosto ou no capilar sem cabelo [10]. As taxas de resposta variam de 34% a 82%.
O tratamento de AK com 5% de imiquimod é possível, mas tem ficado atrás da concentração de 3,75% de imiquimod na frequência do tratamento devido a efeitos secundários mais graves. Utilização como parte de um tratamento combinado de BCC superficial, para o qual 5% de imiquimod é aprovado, e AK existente permanece por considerar.
O PDT baseia-se na conversão de ácido 5-aminolevulínico (5-ALA) e ácido metilaminolevulínico (MAL) para o metabolito fotoactivo protoporfirina IX, que se acumula em células neoplásicas e é activado pela luz. Isto forma espécies ácidas reactivas que induzem a apoptose, entre outras coisas. Várias fontes externas e de luz estão disponíveis para a PDT. As linhas de orientação resumem: A terapia fotodinâmica convencional com ácido 5-aminolevulínico ou o seu éster metílico (5-ALA ou MAL) deve ser oferecida de forma orientada para o campo para AK de grau único ou múltiplo I-II de acordo com Olsen e para a carcinogénese de campo [10].
O creme contendo MAL pode ser utilizado como um medicamento pronto a usar e é aplicado na área de tratamento com uma espessura de 1 mm. Após 3 horas de oclusão, a irradiação com 570-670 nm (75 J/cm2) ou alternativamente com 630 nm (37 J/cm2) pode ser realizada. Se a AK não sarar completamente, pode ser reaplicada após 12 semanas. ALA está disponível sob a forma de remendo e gel com uma nanoemulsão ALA (BF-200 ALA). Podem ser usados até 6 adesivos ALA com um tamanho de 4 cm2 ao mesmo tempo. Podem ser utilizados tanto para AK simples como para AK múltiplas. Quatro horas após a incubação, exposição com uma luz vermelha de espectro estreito (630 nm).
Gel BF-200 ALA é lesionado e aprovado em campo. O tubo de 2g é suficiente para uma área de 20 cm2 com uma aplicação de 1 mm de espessura. Após 3 horas de oclusão, segue-se a irradiação com uma luz vermelha de largo espectro ou uma lâmpada de espectro estreito. BF-200 ALA foi também aprovado para utilização nas extremidades, tronco e pescoço desde 20/0320. Tal como formulado pela Swiss medic 2018, o seguinte aplica-se à utilização de BF-200 ALA: “Tratamento de queratoses actínicas (AK) de intensidade ligeira a moderada na face e couro cabeludo (grau I-II de acordo com Olsen) e cancros de campo em adultos”. Uma combinação de PDT com terapias locais, por um lado no sentido da descamação e queratólise ou também terapêutica com imiquimod ou 5-FU, pode melhorar a eficiência.
O PDT diurno pode ser utilizado tanto com creme contendo MAL como com gel ALA BF-200. Menos dor com tal tratamento deve-se ao início mais lento do protoporfirina IX com tempo de incubação mais curto (<30 minutos) e exposição subsequente (2 horas). MAL em combinação com a luz do dia (daylight-MAL-PDT) deve ser oferecido em campo para AK de grau I-II não pigmentado, único ou múltiplo de acordo com Olsen, e para a carcinogénese de campo do rosto e capilaridade em indivíduos imunocompetentes [10]. Novo é o PDT de luz diurna domiciliar, onde os pacientes aplicam eles próprios o fotossensibilizador e depois se expõem à luz do dia.
As meta-análises servem, até certo ponto, para classificar as terapias: Os sucessos terapêuticos mostraram a maior taxa de cura para BF-200 ALA com 75,8%, seguido de 5% 5-FU com 59,9%, remendos ALA com 56,8%, 5% imiquimod com 56,3%, 3,75% imiquimod com 39,9% e 3% diclofenac em 2,5% ácido hialurónico com 24,7% [14]. Numa outra meta-análise, a PDT também mostrou o maior sucesso na cura, seguida de 5% 5-FU, 5% imiquimod e 3% diclofenaco em ácido hialurónico 2,5% [8].
Procedimentos mecânicos invasivos
A criocirurgia é um procedimento amplamente utilizado, frequentemente combinado com terapêutica local ou PDT. Usando azoto líquido de -196 ˚C, uma temperatura de -25˚C é visada na área de pele tratada através de carimbagem ou pulverização de contacto. Isto é normalmente conseguido através de uma aplicação de 15-60 segundos e 2 tempos de gelo. No entanto, não foram estabelecidas normas claras. É recomendado para AK de grau único ou múltiplo I-III de acordo com Olsen em indivíduos imunocompetentes [10]. Muitas vezes deixa para trás áreas de pele hipopigmentadas, de modo a que os aspectos estéticos também possam vir a estar em foco de acordo com a idade e o curso da doença.
O domínio dos procedimentos cirúrgicos é mais o divulgado, especialmente AK mais pronunciada. A directriz recomenda a remoção cirúrgica de AK grau I-III de acordo com Olsen para lesões individuais tanto em doentes imunocompetentes como imunossuprimidos, por exemplo através de curetagem, ablação rasa ou excisão completa [10]. Uma vantagem deste método é a confirmação simultânea do diagnóstico. Há um aviso contra a excisão da barba e a cobertura insuficiente das estruturas mais profundas. Em comparação com os procedimentos não invasivos, estas abordagens têm uma pontuação mais baixa na avaliação cosmética simplesmente devido à formação de cicatrizes.
Os procedimentos laser são populares devido à sua boa viabilidade e, de acordo com a directriz, devem ser oferecidos para uma ou várias AK grau I-III de acordo com Olsen, bem como para a cancerização de campo em doentes imunocompetentes. Com olaser Er:YAG ouCO2, AK pode ser removido rápida e especificamente. Recomenda-se uma cópia de segurança histológica suplementar, bem como documentação fotográfica. A terapia laser seguida de tratamento local, por exemplo, com 5% 5-FU, leva a uma melhor distribuição de medicamentos [15].
Um resumo interessante de Steeb et al. aborda a questão “Quanto mais melhor?”. Poderia ser demonstrado que uma terapia combinada pode aumentar a eficácia do sucesso da terapia. Em particular, pode ser útil uma combinação de terapia orientada para a lesão com terapia orientada para o campo. Um aumento significativo do sucesso é ainda questionado de forma crítica sem mais estudos [16].
Desenvolvimentos
A tirbanibulina é um novo ingrediente activo produzido sinteticamente que tem tido a aprovação da FDA para AK na cabeça desde Dezembro de 2020. A polimerização da tubulina é inibida. Segue-se a paragem do ciclo celular (fase G2/M) e a apoptose. Dois ensaios de fase III, controlados por placebo, relatam taxas de resposta completas de 44% e 54% no 57º dia, significativamente melhores do que o efeito placebo (5%, 13%) [17]. 1% de tirbanibulina é aplicada localmente a cerca de 25 cm2 uma vez por dia durante 5 dias. O oitavo dia mostra eritema, escamação, prurido e dor, de gravidade ligeira a moderada e regressão rápida.
Do grupo dos flavonóides, subgrupo dos polifenóis e pertencente às catequinas, o desenvolvimento de uma sinecatequina (extracto de chá verde) para o tratamento de AK está a avançar. Como abordagem terapêutica causal, os efeitos antioxidantes, anti-inflamatórios e anti-carcinogénicos das catequinas devem ser mencionados. O efeito antiproliferativo sobre queratinócitos também no contexto da fotocarcinogénese foi demonstrado [18]. Os dados de tratamento baseados em provas para AK ainda precisam de ser gerados mais.
Quatro compostos adicionais são nomeados num possível desenvolvimento para o tratamento de AK [19]: O dobesilato de potássio tem efeitos anti-inflamatórios, anti-angiogénicos e anti-tumorais como inibidor da sinalização FGF e da síntese de prostaglandinas. Foram publicadas taxas de resposta de cerca de 60% para AK, num estudo mais antigo da fase II. Tuvatexib é um modulador de hexoquinase 2 Comp-1. A apoptose segue-se através de uma interacção com a hexoquinase na mitocôndria. Analógico a 5-FU, o paclitaxel foi aconselhado como um agente quimioterápico aplicável localmente. Liga-se a β-tubulin e inibe o citosqueletoesqueleto. Existe uma “prova de princípio” para paclitaxel, como partículas submicron localmente aplicáveis, bem como para “furosemida mais digoxina”, mas sem que tenham sido realizados mais estudos em AK.
Resumo
As ceratoses actínicas (AK) continuam a ser um tema para o futuro devido a um novo aumento da incidência. Tendo em conta o curso crónico da doença, o paciente idoso que requer uma gestão terapêutica a longo prazo, educação precoce e prevenção tanto primária como secundária, está a ganhar importância.
Os desenvolvimentos actuais em matéria de patogénese, avaliação de riscos, avaliação crítica das classificações, medidas preventivas e diagnósticos são delineados. As opções e conceitos terapêuticos são delineados com base na directriz S3 “Actinic keratosis and squamous cell canceroma” da pele. É apresentado o estado actual, bem como as possíveis terapias futuras.
Mensagens Take-Home
- AK é principalmente diagnosticada clinicamente.
- O termo cancerização de campo não se baseia actualmente numa definição clara.
- As anteriores classificações AK não se correlacionam de forma fiável com o risco de invasividade.
- A indicação de tratamento baseia-se em numerosos critérios individuais e, além da remissão, serve para evitar a progressão, bem como o desenvolvimento de PEK.
- A prevenção e as terapias são estabelecidas numa base ampla, tais como directrizes e medidas de política sanitária.
Literatura:
- Reinehr CPH, Bakos RM: Actinic keratoses: revisão dos aspectos clínicos, dermoscópicos, e terapêuticos. An Bras Dermatol 2019 Nov-Dez; 94(6): 637-657; doi: 10.1016/j.abd.2019.10.004.
- Dziunycz PJ, Schuller E, Hofbauer GFL: Prevalência de Queratose Actínica em Pacientes que Atendem Médicos de Clínica Geral na Suíça. Dermatologia 2018; 234(5-6): 214-219; doi: 10.1159/000491820.
- Warszawik-Hendzel O, Olszewska M, Rakowska A, et al: Cardiovascular Drug Use and Risk of Actinic Keratosis: A Case-Control Study. Dermatol Ther 2020; 10: 735-743; doi: 10.1007/s13555-020-00405-8.
- Olsen EA, Abernethy ML, Kulp-Shorten C, et al: Um estudo duplo-cego, controlado por veículo, avaliando o creme masoprocol no tratamento de queratoses actínicas na cabeça e pescoço. J Am Acad Dermatol 1991 Maio; 24(5 Pt 1): 738-743; doi: 10.1016/0190-9622(91)70113-g.
- Cockerell CJ: Histopatologia do carcinoma espinocelular intraepidérmico incipiente (“ceratose actínica”). J Am Acad Dermatol 2000 Jan; 42(1 Pt 2): 11-17; doi: 10.1067/mjd.2000.103344.
- Röwert-Huber J, Patel MJ, Forschner T, et al: A queratose actínica é um carcinoma espinocelular in situ precoce: uma proposta de reclassificação. Br J Dermatol 2007 Maio; 156 Suppl 3: 8-12; doi: 10.1111/j.1365-2133.2007.07860.x. Erratum in: Br J Dermatol 2007 Ago; 157(2): 431.
- Holick MF: Vitamina D: uma perspectiva de saúde D-Lightful. Nutr Rev 2008 Oct; 66(10 Suppl 2): S182-194; doi: 10.1111/j.1753-4887.2008.00104.x.
- Dhariwal S, Hari T, Kaur K, et al: Consulta virtual para queratose actínica. BJGP Aberto 2020 Oct 27; 4(4): bjgpopen20X101126; doi: 10.3399/bjgpopen20X101126.
- Dirschka T, Pellacani G, Micali G, et al: Um sistema de pontuação proposto para avaliar a gravidade da queratose actínica na cabeça: área de queratose actínica e índice de gravidade. J Eur Acad Dermatol Venereol 2017 Ago; 31(8): 1295-1302; doi: 10.1111/jdv.14267.
- Programa de orientação oncológica. S3 Guideline Actinic keratosis and squamous cell canceroma of the skin 2019. Número de registo AWMF:032/0220L, www.leitlinienprogramm-onkologie.de/leitlinien/aktinische-keratosen-und-plattenepithelkarzinom-der-haut.
- Nashan D, Hüning S, Heppt MV, et al: Actinic keratoses: directriz actual e recomendações baseadas na prática. Dermatologista 2020; 71: 463-475.
- Walker JL, Siegel JA, Sachar M, et al: 5-Fluorouracil para o Tratamento da Queratose Actínica e Quimioprevenção: Um Ensaio Controlado Aleatório. J Invest Dermatol 2017 Jun; 137(6): 1367-1370; doi: 10.1016/j.jid.2016.12.029.
- Dohil MA: Eficácia, Segurança, e Tolerabilidade de 4% de creme de 5-Fluorouracil num novo creme aquoso patenteado contendo óleo de amendoim uma vez por dia em comparação com 5% de creme de 5-Fluorouracil duas vezes por dia: Responder ao desafio no tratamento da queratose actínica. J Dermatol 2016 Oct 1; 15(10): 1218-1224.
- Vegter S, Tolley K: Uma meta-análise em rede da eficácia relativa dos tratamentos para a queratose actínica da face ou do couro cabeludo na Europa. PLoS One 2014 Jun 3; 9(6): e96829; doi: 10.1371/journal.pone.0096829.
- Nguyen BT, Gan SD, Konnikov N, Liang CA: Tratamento in situ do carcinoma basocelular superficial e do carcinoma de células escamosas no tronco e nas extremidades com a entrega ablativa fracionada a laser de fluorouracil tópico. J Am Acad Dermatol 2015 Mar; 72(3): 558-560; doi: 10.1016/j.jaad.2014.11.033.
- Steeb T, Wessely A, Leiter U, et al: Quanto mais, melhor? Uma avaliação das terapias combinadas para a queratose actínica. J Eur Acad Dermatol Venereol 2020 Abr; 34(4): 727-732; doi: 10.1111/jdv.15998.
- Kempers S, DuBois J, Forman S, et al: Pomada de Tirbanibulina 1% como Tratamento Novel para Queratose Actínica: Resultados das Fases 1 e 2. J Dermatol 2020 Nov 1; 19(11): 1093-1100.
- Zink A, Traidl-Hoffmann C, et al.: Chá verde em dermatologia – mitos e factos. J Dtsch Dermatol Ges 2015 Ago; 13(8): 768-775.
- Cramer P, Stockfleth E, et al: Actinic keratosis: qual é a nossa posição e onde nos levará o futuro? Pareceres de peritos Drogas Emergentes 2020 Mar; 25(1): 49-58.
DERMATOLOGIE PRAXIS 2021; 31(2): xx-xx